11 грудня, 2021
Адекватна аналгезія як компонент хірургічного лікування та післяопераційної реабілітації
За матеріалами конференції
У статті розглянуто особливості больового синдрому у хірургічній практиці, поняття і складові адекватної аналгезії та схеми застосування деяких анальгетиків.
Ключові слова: біль, аналгезія, анальгетик, нестероїдні протизапальні препарати, кеторолаку трометамін, німесулід.
На науково-практичній конференції «Сучасні консенсуси в клінічній практиці хірурга та анестезіолога», що відбулась 11 жовтня, з актуальною темою виступив доцент кафедри загальної хірургії Львівського національного медичного університету ім. Данила Галицького, кандидат медичних наук Всеволод Васильович Ващук. У своїй доповіді він зазначив, що усунення больового синдрому не лише покращує самопочуття пацієнта і зменшує вартість лікування, а й сприяє швидкому загоєнню післяопераційної рани. Тому важливим завданням щодо операційних хворих є забезпечення адекватної аналгезії, яка має бути результатом співпраці хірурга та анестезіолога.
Больовий синдром – це багатокомпонентне явище. Психологічними проявами болю можуть бути тривожність, гнів, депресія, страх смерті й невпевненість пацієнта в майбутньому. У соціальній сфері тривалий біль може призводити до втрати доходів, соціального статусу та сімейних проблем. Бюрократичні процеси під час лікування, неефективність терапії та неналежна комунікація з лікарями часто завершуються розчаруванням у медицині та самолікуванням. Тому важливою є вчасна діагностика й терапія болю.
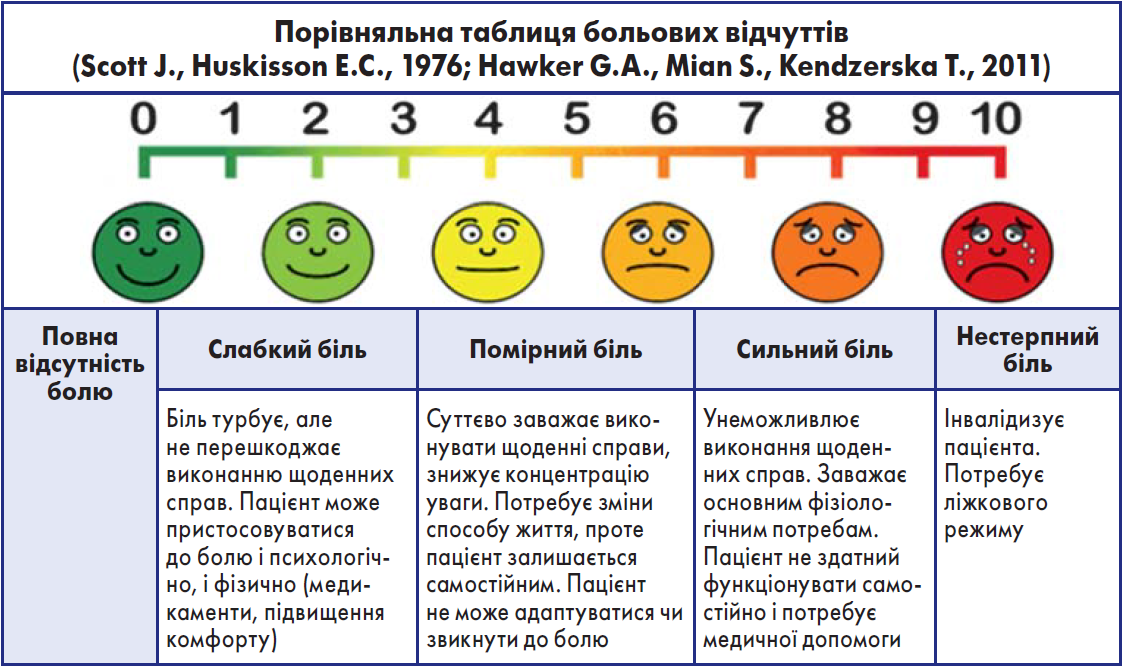
Доведено, що належний контроль больового синдрому сприяє швидшому одужанню, підвищує виживаність пацієнтів (особливо осіб віком >60 років) і зменшує витрати на лікування (Строгуш М.О., Білінський П.І., 2015). Для діагностики болю зазвичай використовують візуально-аналогову шкалу (ВАШ), за допомогою якої пацієнт позначає інтенсивність болю (таблиця).
Виникнення інтенсивного больового синдрому та його хронізація можуть бути спричинені такими факторами ризику:
- надмірно збудлива психіка;
- надлишкова маса тіла;
- малорухливий спосіб життя;
- цукровий діабет;
- тривалий больовий анамнез;
- депресивні розлади;
- генетична схильність;
- чинники лікувального процесу, зокрема перевантаження рідиною, відсутність превентивного і персоніфікованого підходу у схемах знеболення.
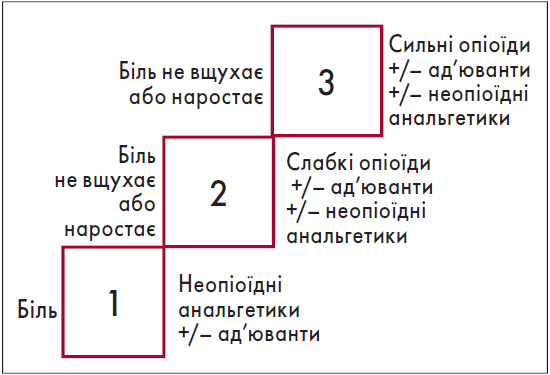
Найчастіше клініцисти мають справу з ноцицептивним болем, зумовленим травмою або хірургічним втручанням, у патогенезі якого беруть участь запалення, набряк та ішемія тканин. Сучасна концепція адекватної аналгезії передбачає вплив на численні патогенетичні ланки больового синдрому, тому для знеболення призначають препарати різних груп або різні методики. Таку аналгезію називають багатокомпонентною або мультимодальною. Вибір препарату залежить від інтенсивності болю (рис. 1).
Рис. 1. «Драбина» лікування болю за ВООЗ (Scott J., Huskisson E.C., 1976; Hawker G.A., Mian S., Kendzerska T., 2011)
До слабких опіоїдів відносять оксикодон і трамадол, до сильних – морфін. З-поміж неопіоїдних медикаментів часто застосовують нестероїдні протизапальні препарати (НПЗП), які діють на ряд ланок больового процесу, зменшуючи утворення з арахідонової кислоти простагландинів, медіаторів болю і запалення. НПЗП призначають також для знеболення пацієнтів, яким протипоказані опіоїди, наприклад при пораненні голови, травматичному шоку ІІ-ІІІ ступеня (Строгуш М.О., Білінський П.І., 2015).
Серед сучасних НПЗП добре зарекомендував себе препарат Кеторол® виробництва Dr. Reddy’s Laboratories Ltd. (діюча речовина – кеторолаку трометамін, що походить від арилоцтової кислоти).
Основні характеристики діючої речовини препарату Кеторол®:
- інгібітор циклооксигеназ 1-го і 2-го типу (ЦОГ‑1 і ЦОГ‑2), потужний анальгетик, що за знеболювальною дією перевищує ефекти інших НПЗП, наприклад ацетилсаліцилової кислоти – у 800 разів (Rooks W. et al., 1982);
- має високу біодоступність (80-100%);
- тривалість дії – 6-10 год;
- 30 мг кеторолаку, введених парентерально, еквівалентні за дією 10-12 мг морфіну або 50 мг меперидину (Brown C. et al., 1990);
- на відміну від опіоїдів не пригнічує дихання, не має седативного і психомоторного впливу;
- перевищує за анальгетичною дією ефекти метамізолу натрію у 2,6 раза (Вєрткін А.Л. та співавт., 2004);
- на 25-30% ефективніший за диклофенак (Галушко Є.А. та співавт., 2008);
- при застосуванні кеторолаку повне блокування тяжкого больового синдрому виявлено у 20% пацієнтів, значне полегшення – у 55%, зменшення вираженості болю – у 25% (Рябоконь І.В. та співавт., 2013);
- кеторолак можна застосовувати за такою схемою: Кеторол® (30 мг/мл) у дозі 1 мл внутрішньом’язово 2 р./добу протягом 2 днів, потім – Кеторол Експрес по 10 мг 2 р./на добу до 5 днів (якщо біль не вщухає, слід шукати його причину);
- кеторолаку трометамін, що випускає компанія Dr. Reddy’s Laboratories Ltd., представлений у трьох лікарських формах: таблетки Кеторол Експрес (10 мг), розчин Кеторол® (30 мг/мл) і 2% гель Кеторол® (30 г).
Ефективність знеболювальної дії кеторолаку підтверджена у багатьох дослідженнях. У пацієнтів, які підлягали холецистектомії, кеторолак призначали для премедикації в дозі 30 мг та вводили шляхом безперервної інфузії в дозі 2 мг/год. Анальгетик зменшував відчуття болю, визначене за ВАШ, знижував рівень кортизолу й не викликав значних побічних явищ, зокрема не впливав на рівень крововтрати, концентрацію глюкози у крові, на гемостаз і функцію нирок. Частота побічних явищ у групі кеторолаку була нижчою, ніж у контрольній (Varassi G. et al., 1994). Під час торакальних втручань кеторолак вводили в дозі 30 мг внутрішньовенно кожні 6 год, поєднуючи з опіоїдами. Призначення кеторолаку зменшувало біль і потребу в опіоїдах (Singh H. et al., 1997). У випробуванні Stahlgren L.R. et al. (1993) за участю 210 осіб, які підлягали гістеректомії або холецистектомії, кеторолак уводили в дозі 30 мг внутрішньовенно, потім – 10 мг внутрішньом’язово кожні 6 год. В осіб, які отримували кеторолак, швидше відновлювалась перистальтика кишок, ніж у пацієнтів, яких лікували меперидином, поєднаним із препаратами ацетамінофену/кодеїну. Крім того, пацієнти із групи кеторолаку швидше починали ходити без сторонньої допомоги і вживати рідку їжу.
Автор доповіді навів низку хірургічних втручань, у яких для знеболення призначали кеторолак у дозі <60 мг:
- лапароскопічні гінекологічні операції, під час яких встановлено, що внутрішньовенне введення кеторолаку в дозі 30 мг ефективніше усуває ранній післяопераційний біль, ніж уведення парекоксибу в дозі 40 мг (Ng A. et al., 2004);
- лапароскопічні гінекологічні втручання, де внутрішньовенне введення 40 мг кеторолаку після індукції анестезії ефективніше зменшувало післяопераційний біль, ніж пероральний прийом 120 мг еторикоксибу (Lenz H., Raeder J., 2008);
- амбулаторне видалення гриж, при якому кеторолак (30 мг внутрішньовенно) виявився ефективнішим, ніж бетометазон і дексаметазон (Thagaard K.S. et al., 2007);
- втручання із приводу заміни суглобів, де внутрішньовенна форма кеторолаку в дозах 15 мг і 30 мг не поступалася за ефективністю 2 г пропацетамолу і була дієвішою, ніж плацебо (Zhou T.S. et al., 2001);
- лапароскопічні урологічні втручання: кеторолак поєднували з опіоїдами, що призводило до зменшення болю, натомість як рівень крововтрати і функція нирок залишились незмінними (Ghow G.K. et al., 2001);
- нефректомія, де кеторолак у комбінації з опіоїдами порівнювали з монотерапією опіоїдами (особи, які отримували кеторолак, відзначали більш швидке покращення стану самопочуття після операції й швидше переходили до вживання твердої їжі) (DiBlasio C.J. et al., 2004).
Досить цікавими є результати окремих досліджень кеторолаку. M.C. Engloren et al. (2007) довели, що аналгезія кеторолаком асоційована із швидшим приживленням трансплантата після операцій артеріального шунтування. P. Forget et al. (2010) виявили нижчий ризик рецидиву раку молочної залози у прооперованих осіб, які отримували кеторолак, порівняно з пацієнтами, які отримували після хірургічного втручання виключно опіоїди.
Кеторолак часто призначають у травматології. В одному з досліджень встановлено, що при переломах гомілковостопного суглоба превентивна аналгезія кеторолаком ефективніша, ніж його введення після втручання (Norman P.H. et al., 2001). A.P. Kurmis et al. (2012) довели, що кеторолак безпечний при травмах кісток і не порушує регенерацію кісткової тканини. У дослідженні, де вивчали 158 осіб із ідіопатичним сколіозом, було спростовано, що лікування кеторолаком супроводжується високим ризиком псевдоартрозів. За даними цього дослідження, частота псевдоартрозу становила всього 2,5% (Sucato D.J. et al., 2008).
Ефективність таблетованої форми кеторолаку доведено у нещодавньому великому дослідженні (McDonald E.L., Daniel J.N., Rogero R.G. et al., 2020) за участю пацієнтів із переломами гомілковостопного суглоба. У терапевтичній групі (n=54) пацієнтам вводили 30 мг кеторолаку внутрішньовенно під час операції, надалі — призначали 20 таблеток кеторолаку дозуванням 10 мг, які слід було приймати по одній кожні 6 год, та 30 таблеток препаратів оксикодону/ацетамінофену (5 мг/325 мг), по одній-дві таблетки кожні 4-6 год за потреби. Учасники контрольної групи (n=45) приймали тільки оксикодон/ацетамінофен за вищевказаною схемою. На думку авторів, особливо важливо досягти ефективного знеболення у 1-2-й післяопераційні дні, оскільки протягом цього періоду пацієнти отримують найбільшу кількість опіоїдів. Застосування кеторолаку в обох лікарських формах дозволило зменшити дози опіоїдів.
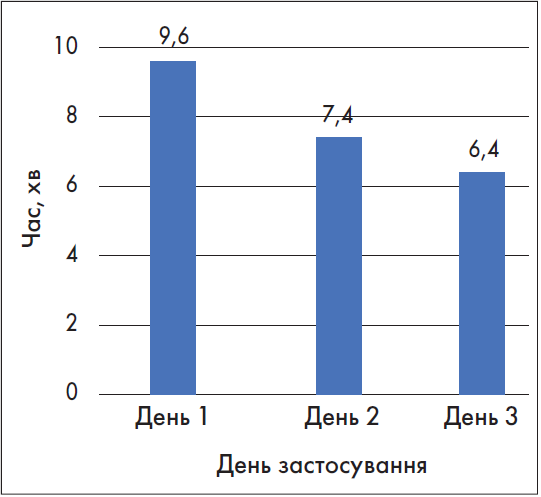
Кеторол Експрес – перший і єдиний в Україні препарат кеторолаку у формі таблеток, що диспергуються у ротовій порожнині. Таблетки Кеторол Експрес відрізняються від традиційних тим, що розчиняються швидше ніж за 30 секунд – варто лише покласти їх на язик. Таблетки не потребують обов’язкового запивання водою (хоча при бажанні їх можна запити) і не впливають на продукцію слини. Знеболювальна концентрація кеторолаку в крові досягається менше ніж за 10 хвилин. За даними одного з випробувань, виконаного у стоматологічних пацієнтів, протягом 2-го і 3-го дня дослідження таблетки Кеторол Експрес починали діяти швидше, ніж у 1-й день застосування (Анісімова Є.Н., Анісімова Н.Ю., Рязанцев Н.А. та співавт., 2020) (рис. 2).
Рис. 2. Початок знеболювальної дії препарату Кеторол Експрес від моменту прийому (Анісімова Є.Н. та співавт., 2020)
Разова доза препарату Кеторол Експрес становить 10 мг, а максимальна добова – 4 таблетки. Кеторол Експрес можна приймати пацієнтам із порушеннями акту ковтання при поведінкових або неврологічних розладах. Таблетки призначають для короткочасного (не більше 5 днів) лікування болю помірної інтенсивності, гострого болю різного генезу, зокрема післяопераційного.
Враховуючи вищенаведені дані, кеторолак можна вважати ефективним і безпечним анальгетиком із високою знеболювальною активністю, що обґрунтовує його застосування у травматологічній, ортопедичній і хірургічній практиці.
Іншими поширеними анальгетиками є препарати німесуліду. Знеболювальний ефект німесуліду реалізується на центральному й периферичному рівнях. Німесулід інгібує ЦОГ‑1 та ЦОГ‑2 і пригнічує синтез прозапальних цитокінів інтерлейкіну 6, фактора некрозу пухлини α (TNF-α). Діючи на ЦОГ‑1 і ЦОГ‑2, він виявляє протизапальну, анальгетичну й жарознижувальну активність. Із впливом на ЦОГ‑2 пов’язані такі ефекти німесуліду: блокування простагландину E2; інгібування фосфодіестерази IV, зменшення активності тромбоцитів, нейтрофілів і зниження виділення гістаміну; хондропротективна дія, зумовлена пригніченням активності металопротеаз; антиоксидантна активність. У випробуваннях безпеки німесуліду було неодноразово доведено позитивне співвідношення між користю та ризиком (Rojas J. et al., 2012; Kress H.G. et al., 2016). Серед відомих препаратів німесуліду заслуговують на увагу таблетки Найз® (Dr. Reddy’s Laboratories Ltd.). Негайний ефект препарату Найз® зумовлений наявною у складі таблеток комбінацією крохмалю та натрію крохмальгліколяту, що сприяє їх швидкому розпаду.
Основні характеристики діючої речовини препарату Найз® (Rovensky J., Payer J., 2009; Головач І.Ю., 2016):
- чинить протизапальну, знеболювальну й жарознижувальну дію;
- інгібує мієлопероксидазу, пригнічує утворення вільних радикалів, синтез TNF-α та інших медіаторів запалення;
- швидко всмоктується у шлунково-кишковому тракті;
- забезпечує максимальну концентрацію у плазмі крові через 2-3 год;
- ефективніший, ніж метамізол.
Найз® призначають при гострому болю під час хірургічних втручань на м’яких тканинах, для післяопераційного знеболення у якості препарату другої лінії, у ЛОР-практиці, де відзначено його ефективність у 86% випадків (Подовжній О.Г., 2015), у хірургічній стоматології, при травмах м’яких тканин, в онкологічних пацієнтів (Шень Н.П. та співавт., 2017; Karataev A.E. et al., 2018). Режим дозування препарату: 1 таблетка (100 мг) 2 рази на добу, вранці та ввечері. Тривалість застосування – до 15 діб.
У багатоцентровому подвійному сліпому дослідженні, де взяли участь 94 особи з післяопераційним болем після артроскопії та меніскектомії, учені порівнювали німесулід (100 мг 2 р./добу), напроксен (500 мг 2 р./добу) і плацебо, які вводили досліджуваним пацієнтам протягом 3 днів. За результатами випробування доведено, що німесулід – ефективна швидкодіюча речовина, яку добре переносять пацієнти і яка має виражену знеболювальну дію при застосуванні після амбулаторних ортопедичних операцій (Binning A., 2007).
E.C. Pouchain et al. (2015) вивчали аналгезію німесулідом в осіб після видалення третіх молярів. Німесулід та кетопрофен призначали в дозі 100 мг 2 р./добу. У групі німесуліду зменшення болю реєстрували через 48 год, а у групі кетопрофену – через 7 днів. Обидва препарати ефективно усували біль, набряк та тризм після хірургічного втручання.
Ефективність німесуліду доведена також в експериментах на щурах. В одному з таких досліджень (Saghaei E. et al., 2012) учені вивчали знеболювальну дію німесуліду, нефопаму та морфіну окремо й у поєднанні з іншими медичними препаратами, моделюючи у щурів нейропатичний біль. Встановлено, що нефопам (30 мг/кг) та німесулід (5 мг/кг) блокують механічну й термічну алодинію. Алодинію було повністю усунуто поєднанням неанальгетичних доз нефопаму (10 мг/кг), німесуліду (1,25 мг/кг) та морфіну (3 мг/кг).
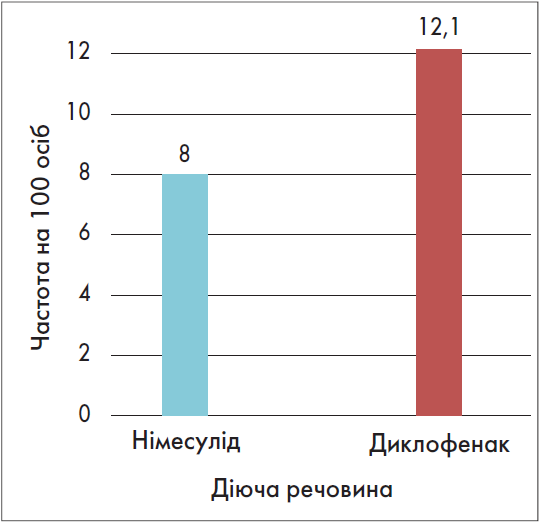
Під час будь-якої терапії постає питання безпеки медичного препарату. Оскільки Найз® належить до НПЗП, слід враховувати його дію на шлунково-кишковий тракт (ШКТ). Негативний вплив німесуліду на травну систему менш виражений, ніж у деяких інших нестероїдних протизапальних анальгетиків (Bradbury F., 2004; Conforti A., Costantini D., Zanetti F., 2012) (рис. 3, 4).
Рис. 3. Частота всіх побічних ефектів із боку ШКТ при застосуванні німесуліду та диклофенаку
Рис. 4. Частота побічних ефектів із боку ШКТ при застосуванні німесуліду та інших НПЗП (за даними 10 608 повідомлень про тяжкі побічні ефекти, викликані прийомом НПЗП)
За результатами відповідних випробувань, застосування німесуліду не супроводжувалося високим ризиком серцево-судинних ускладнень. У багатоцентровому обсерваційному дослідженні, де порівнювали кардіотоксичність НПЗП, ризик виникнення інфаркту міокарда при лікуванні німесулідом становив 1,16, натомість як найвищий ризик – 1,31, а найнижчий – 1,02 (Леонова М.В., 2019).
За даними спеціалізованого ревматологічного центру, протягом 10 років терапії німесулідом зареєстровано лише два випадки гепатотоксичності: одну непрогнозовану ідіосинкразію й один випадок, спричинений перевищенням дози та тривалості застосування. Частота всіх гепатопатій при лікуванні німесулідом становила 35,3 випадку на 100 тис. осіб на рік, що є нижчим показником, ніж при терапії диклофенаком або ібупрофеном (39,2 і 44,6 випадку на 100 тис. осіб на рік відповідно) (Traversa G., Bianchi C., Da Cas R. et al., 2003; Барскова В.Г., 2010). За даними наукової літератури, сумарна частота небезпечних гепатотоксичних реакцій серед 280 млн осіб, котрі отримували німесулід, становила один випадок на 1 млн курсів терапії, що підтверджує сприятливе співвідношення «користь/ризик» при застосуванні цього анальгетика (Хомяк Н.В., 2016).
А.В. Туєв та співавт. (2008) вивчали дію НПЗП різної ЦОГ‑2-селективності на функціональний стан нирок в осіб із ревматоїдним артритом і супутньою артеріальною гіпертонією (n=40). Учені виявили, що німесулід дещо знижує нирковий кровотік, але, на відміну від диклофенаку, майже не впливає на швидкість клубочкової фільтрації та концентраційну функцію.
Препарати Кеторол® і Найз® можна поєднувати. За відсутності абсолютних протипоказань до застосування опіоїдів при гострому болю рекомендована наступна схема:
- Кеторол® – по 30 мг внутрішньом’язово двічі на добу протягом 2 днів;
- надалі Кеторол Експрес – по 10 мг двічі на добу протягом 3 днів;
- надалі Найз® – по 100 мг двічі на добу до 5 днів (за наявності набряку, ознак запалення) (Поворознюк А.В., Макогончук А.В., 2008).
Отже, послідовне застосування комбінації препаратів Кеторол®, Кеторол Експрес та Найз® у комплексному хірургічному, травматологічному або онкологічному лікуванні зменшує вираженість больового синдрому й підвищує функціональні можливості пацієнтів. Призначення такої схеми дозволяє розширити межі рухового режиму, знизити ризик хронізації болю, запобігти ушкодженню центральної нервової системи, а у підсумку – покращити якість життя пацієнта.
Підготувала Анна Сакалош