18 грудня, 2021
«Глісада»: патогенетично обґрунтована схема ведення пацієнтів з COVID-19 на амбулаторному етапі
 Минуло майже 2 роки відтоді, як ми вперше почули слово COVID‑19, однак пандемія все ще продовжує лютувати. На сьогоднішній день є певні очікування ефективності розроблених підходів до етіотропної терапії СOVID‑19. Сьогодні ми набагато краще розуміємо особливості патогенезу хвороби й імунні механізми захисту, що відкриває нові можливості патогенетичного лікування коронавірусної інфекції. Наразі відомо, що захворювання часто має хвилеподібний перебіг: перша хвиля, яка характеризується легкими симптомами, після тимчасового покращення переходить у другу хвилю (так звану легеневу фазу), перебіг якої є значно тяжчим та нерідко закінчується летально. Тому важливо ще на ранньому етапі COVID‑19 призначити відповідне лікування, яке дасть можливість «змінити траекторію» першої хвилі та не допустити її переходу в фатальний «девятий вал» (за аналогією з глісадою – керованою людським інтелектом плановою траєкторією зниження літака для безпечної посадкою). Цього можна досягти як за рахунок стримування реплікації вірусу SARS-CoV‑2 шляхом використання етіотропної терапії, так і своєчасного застосування патогенетичної терапії для пригнічення запалення з метою попередження цитокінового шторму, протекції пневмоцитів, які в першу чергу уражаються вірусом, нівелюванням наслідків оксидантного стресу, максимально знизити можливі порушення коагуляційної системи. Такий підіхід особливо важливий у пацієнтів похилого віку або з хронічними серцево-судинними, ендокринними та пульмонологічними захворюваннями. У цьому огляді наводимо доказову базу ефективності патогенетичної терапії СOVID‑19. Сподіваємося, що представлена терапевтична стратегія дозволить лікарям упевненіше почуватися під час амбулаторного ведення пацієнтів з COVID‑19.
Минуло майже 2 роки відтоді, як ми вперше почули слово COVID‑19, однак пандемія все ще продовжує лютувати. На сьогоднішній день є певні очікування ефективності розроблених підходів до етіотропної терапії СOVID‑19. Сьогодні ми набагато краще розуміємо особливості патогенезу хвороби й імунні механізми захисту, що відкриває нові можливості патогенетичного лікування коронавірусної інфекції. Наразі відомо, що захворювання часто має хвилеподібний перебіг: перша хвиля, яка характеризується легкими симптомами, після тимчасового покращення переходить у другу хвилю (так звану легеневу фазу), перебіг якої є значно тяжчим та нерідко закінчується летально. Тому важливо ще на ранньому етапі COVID‑19 призначити відповідне лікування, яке дасть можливість «змінити траекторію» першої хвилі та не допустити її переходу в фатальний «девятий вал» (за аналогією з глісадою – керованою людським інтелектом плановою траєкторією зниження літака для безпечної посадкою). Цього можна досягти як за рахунок стримування реплікації вірусу SARS-CoV‑2 шляхом використання етіотропної терапії, так і своєчасного застосування патогенетичної терапії для пригнічення запалення з метою попередження цитокінового шторму, протекції пневмоцитів, які в першу чергу уражаються вірусом, нівелюванням наслідків оксидантного стресу, максимально знизити можливі порушення коагуляційної системи. Такий підіхід особливо важливий у пацієнтів похилого віку або з хронічними серцево-судинними, ендокринними та пульмонологічними захворюваннями. У цьому огляді наводимо доказову базу ефективності патогенетичної терапії СOVID‑19. Сподіваємося, що представлена терапевтична стратегія дозволить лікарям упевненіше почуватися під час амбулаторного ведення пацієнтів з COVID‑19.
Щоб зрозуміти суть синдромно-патогенетичного підходу до лікування пацієнтів з COVID‑19, слід детальніше розглянути інформацію про ті клінічно значущі зміни, котрі виникають в організмі під впливом вірусу SARS-CoV‑2.
Ураження SARS-CoV‑2 та розвиток імунної відповіді
У результаті зв’язування S-протеїну з рецептором АПФ2 відбувається проникнення вірусу SARS-CoV‑2 до клітини. Слід зазначити, що для подальшого проникнення вірусу до клітини необхідне розщеплення протеїну ACE2, що здійснюється за допомогою трансмембранної серинової протеази‑2 (TMPRSS2).
Масове інфікування клітин-мішеней спричиняє зростання вірусного навантаження SARS-CoV‑2 (кількість вірусних часток у певному об’ємі біологічної рідини зараженого організму – копій/мл), що діє як сигнал активації для імунної системи, зумовлюючи опосередковані противірусні реакції різної вираженості.
! Вважається, чим вищим є вірусне навантаження, тим значуща ймовірність тяжкого клінічного перебігу і прогресування COVID‑19 у зв’язку з надмірним утворенням прозапальних цитокінів (С-реактивний білок (СРБ), інтерлейкін‑6 (ІЛ‑6), інтерлейкін‑1β, інтерферон-γ, фактор некрозу пухлини) та розвитком вираженої запальної реакції (Liu Y. et al., 2020; Yu X. et al., 2020).
Ураження легеневої тканини
У перші дні захворювання пацієнти зазвичай спостерігають симптоми вірусної інфекції верхніх дихальних шляхів (найчастіше це можуть бути підвищення температури та кашель). На ранній фазі розвитку інфекції альвеолярні макрофаги, розпізнавши SARS-CoV‑2, починають виділяти прозапальні інтерлейкіни й хемокіни, котрі стимулюють збільшення кількості ефекторних Т-лімфоцитів у місці ураження вірусом. Високий рівень продукції прозапальних цитокінів (IL‑6, IL‑1β, TNF та ін.) забезпечує міграцію великої кількості моноцитів і нейтрофілів, які посилюють запалення та спричиняють розвиток набряку тканини легень.
Спостерігаються апоптоз легеневих епітеліальних та ендотеліальних клітин, ушкодження клітинних бар’єрів, пошкодження порушення процесів перекисного окислення ліпідів клітинних мембран, посилення судинної проникності, наслідком чого є набряк і гіпоксія (Xu Z, et al. 2020).
Ураження легень є основною причиною як тяжкості перебігу COVID‑19, так і летальності при цій хворобі (Ruan Q. et al., 2020).
На 8-12-й день захворювання зазвичай розпочинається запальна фаза, коли можуть з’являтися симптоми ураження легень, зокрема задишка.
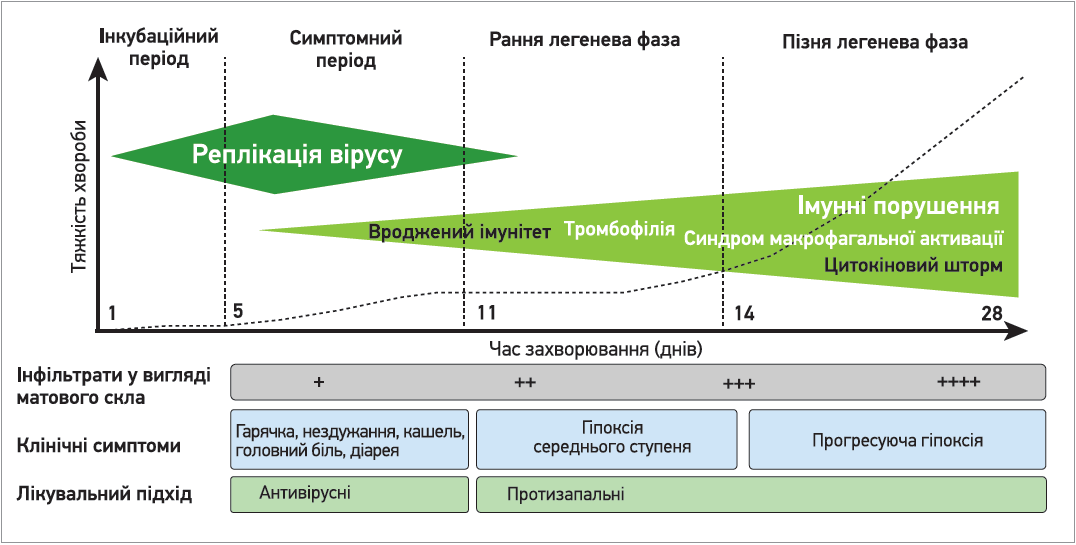
У випадку прогресування COVID‑19 до стадії гіперзапалення з відповідним залученням легеневої тканини, зростає ризик розвитку ГРДС Окрім того, впродовж пізньої фази у пацієнтів розвивається мікротромбоваскуліти як наслідок тромботичних та емболічних ускладнень через стан гіперкоагуляції (рис. 1).
Рис. 1. Клінічні стадії перебігу COVID‑19 та лікувальна тактика
Оксидантний стрес при COVID‑19
Наразі відомо, що респіраторні віруси (в т.ч. SARS-CoV‑2) мають здатність продукувати велику кількість вільних радикалів за рахунок активації ферментів, які генерують активні форми кисню.
! Дихальна система особливо чутлива до ушкодження вільними радикалами, що пов’язано з наявністю високої концентрації О2 у легенях та можливим впливом екзогенних прооксидантів (Cugno M. et al., 2020).
Оксидантний стрес і запалення тісно пов’язані між собою. Вплив гідроксильного радикалу на клітини викликає дозозалежне вивільнення прозапальних цитокінів, і цей процес посилюється за рахунок виснаження ресурсу антиоксидантної системи.
Гіперкоагуляція у пацієнтів з COVID‑19
Кількість тромботичних ускладнень збільшенням збільшується при підвищенні ризику розвитку критичного стану пацієнтів та пов’язані зі значним погіршенням дихання і високою летальністю (Tang N. et al., 2020).
У пацієнтів з COVID‑19 наявність факторів серцево-судинного ризику (високий артеріальний тиск, діабет, куріння, ожиріння), серцево-судинні захворювання в анамнезі виступають загальними обтяжуючими факторами ризику порушень коагуляції (PiazzaG. et al., 2020).
За даними літератури, тромботичні ускладнення розвиваються у 8% пацієнтів з COVID‑19, які не потребують оксигенотерапії та реанімаційних заходів, та у 16% – 69% хворих, госпіталізованих до відділення інтенсивної терапії. Тромботичні ускладнення представлені в основному високою частотою мікротромбоваскулітів, венозної тромбоемболії і невеликою кількістю геморагічних ускладнень (Marietta M. et al., 2020).
Згідно з метааналізом 20 досліджень (1988 пацієнтів з COVID‑19) венозна тромбоемболія розвивалася у 31,3% осіб. Тромбоз глибоких вен зустрічався у 19,8% випадків, а тромбоемболія легеневої артерії – у 18,9%. Факторами ризику тромбоемболії є високий рівень D-димеру, лейкоцитоз, зміни співвідношення нейтрофілів та лімфоцитів у бік перших. Збільшення віку хворого та індексу маси тіла корелювало з вищою поширеністю тромбоемболією легеневої артерії та/аботромбозу глибоких вен (Di Minno A. et al., 2020).
Імунотромбоз при СOVID‑19
Останнім часом пропонується розглядати COVID‑19-асоційовану коагуляцію з позицій імунотромбозу (Nicolai L., et al. 2020; Skendros P., et al. 2020).Так, у відповідь на продукцію прозапальних цитокінів та хемокінів при реплікації SARS-CoV‑2 утворюються нейтрофільні позаклітинні пастки (НПП), які експресують тканинний фактор згортання. НПП у фізіологічних умовах перешкоджають поширенню інфекційного чинника в організмі. Однак при COVID‑19 їх надмірне утворення сприяє генерації тромбіну (Tang N. et al. 2020; Cao W., 2020; Becker R. C. et al. 2020).
Описані зміни виникають вже на ранніх етапах розвитку СOVID‑19, активуючи процеси внутрішньосудинного згортання крові і тромбоутворення в судинах дрібного калібру життєво важливих органів (Zhang L. et al. 2020).
Дисфункція ендотелію при COVID‑19
Механізм гіперкоагуляції у пацієнтів з COVID‑19 у першу чергу пов’язують з вираженою ендотеліальною дисфункцією й індукцією агрегації тромбоцитів (на ендотелії розташовані рецептори АПФ‑2, що роблять йогомішенню для вірусу SARS-CoV‑2).
При ендотеліальному пошкодженні активуються медіатори гострої системної запальної відповіді (Mehta P. et al., 2020; Varga Z. et al., 2020; Magro C. et al., 2020). Ураження ендотеліальних клітин вірусом сприяє масовому вивільненню цитокінів та активаторів плазміногену (тканинного й урокіназного активаторів плазміногену) (Iba T. et al., 2020)
Згідно з публікаціями пошкодження ендотелію, мікросудинне запалення, ендотеліїт відіграють ключову роль у патогенезі гострого респіраторного дистрес-синдрому й органної недостатності у пацієнтів з тяжким перебігом COVID‑19.
Ендотеліальна дисфункція може зумовлювати зростання ризику цереброваскулярних ускладнень у пацієнтів молодшого віку, ішемії міокарда, мікро- та макроциркуляторних тромбоемболічних ускладнень інших органів (Varga Z. et al., 2020).
! Епідеміологічні дані свідчать про те, що пацієнти з COVID‑19, які на момент інфікування SARS-CoV‑2 найімовірніше вже мали ендотеліальну дисфункцію (похилий вік, гіпертонічна хвороба, надлишкова вага, цукровий діабет тощо), частіше госпіталізуються до відділень інтенсивної терапії та мають гірший прогноз (Zhou F. et al., 2020).
Таким чином, ендотеліальна дисфункція з подальшою активацією каскаду згортання крові посідає вагоме місце в патогенезі тромбозу при COVID‑19.
Патогенетична терапія COVID‑19
Сьогодні всі міжнародні медичні спільноти перебувають у пошуках ефективного лікування пацієнтів з COVID‑19. Високі титри вірусу, інтенсивні цитокінові/хемокінові запальні відповіді та оксидантний стрес є причиною високих рівнів захворюваності та смертності. Досвід лікування під час минулих епідемій SARS і MERS свідчить, що патогенетична та симптоматична терапія є ефективними заходами для поліпшення прогнозу перебігу захворювання.
Розглянувши основні зміни, що виникають в організмі при СOVID‑19, можна виділити декілька напрямів ефективної патогенетичної терапії цього захворювання, що було доведено результатами клінічних досліджень.
Передумови використання інгаляційних кортикостероїдів при COVID‑19
Китайський феномен та предиктори використання інгаляційних кортикостероїдів при COVID‑19
Китайські лікарі, котрі першими зустріли епідемію СOVID‑19, виявили певні особливості перебігу захворювання. Лише декілька місяців знадобилося, щоб визначити, що пацієнти з бронхіальною астмою (БА), що приймали інгаляційні кортикостероїди (ІКС), значно рідше госпіталізувались та мали більш легкий перебіг коронавірусної інфекції. Такі неочікувані дані змусили науковців заговорити про «китайський феномен».Втім, якщо згадати вже доведені позитивні ефекти ІКС на перебіг тяжкої легеневої патології, «китайський феномен» був цілком передбачуваним.Про це свідчать результати об’єднаного вторинного аналізу оцінки 5584 пацієнтів, які були госпіталізовані у відділення невідкладної допомоги з принаймні одним фактором ризику розвитку ГРДС (аспірація, пневмонія, сепсис, тяжка травма тощо). Однофакторний аналіз показав, що застосування ІКС перед госпіталізацією асоціювалося з достовірним зниженням ризику розвитку ГРДС у всіх пацієнтів (p=0,05), особливо з прямим ушкодженням легень (p<0,007) (Ortiz-Diaz E. et al., 2011).
Схожий результат отримали при вивченні особливостей перебігу грипу A/H1N1 у 1520 госпіталізованих хворих у Великій Британії. Було показано, що хворі на астму на 49% рідше потребували підтримуючої інтенсивної терапії та мали нижчий ризик смерті порівняно з пацієнтами без астми. Дослідники пов’язують такі розбіжності із застосуванням ІКС. Це вказує на такий можливий ефект ІКС, як пригнічення продукції цитокінів (В. Lipworth. et al., 2020).
ІКС знижують рівні IL‑6, IL‑8 у респіраторному епітелії
Важливою властивістю ІКС є здатність зменшувати вираженість запалення у легеневій тканині. На користь цієї гіпотези вказує супресивний вплив будесоніду на продукцію цитокінів (зокрема, IL‑6 та IL‑8) у культурах клітин носового та трахеального епітелію людини (Yamaya M. et al., 2020).). Це може бути особливо актуальним, оскільки підвищення рівнів IL‑6 пов’язане з гіршими наслідками у пацієнтів з тяжкою асоційованою з COVID‑19 пневмонією та ознаками гіперзапалення (Lipworth B. et al., 2020).
ІКС зменшують представлення мембранних білків АПФ‑2 та ТMPPSS2
Ще одна важлива властивість інгаляційних стероїдів була розглянута науковою спільнотою. Не слід забувати, що ІКС є потужними регуляторами експресії генів. Експресія генів – процес, за якого спадкова інформація у вигляді нуклеотидної послідовності генів використовується для синтезу відповідного функціонального білка.
M. Peters і співавт. (2020) продемонстрували, що застосування ІКС у пацієнтів з бронхіальною астмою супроводжується зниженням експресії генів АПФ‑2 та TMPRSS2 у мокротинні порівняно з контрольною групою осіб, які ІКС не застосовували. Простежувалася чітка кореляція між дозою ІКС і силою експресії генів. Чи транслюється змінена експресія клітинного рецептора зниження вірусного навантаження при терапії ІКС, достименно не відомо.
Один з ефектів кортикостероїдів – зменшення представленості мембранних білків АПФ‑2 та ТMPPSS2, які беруть безпосередню участь у проникненні вірусу SARS-CoV‑2, до клітини. Тому пригнічення експресії зазначених рецепторів через опосередкований вплив кортикостероїдів теоретично може зменшувати можливість одночасного проникнення великої кількості вірусних часток до клітини, а отже, сприяти зменшенню вірусного навантаження.
Попередні дані пригнічення інгаляційними кортикостероїдами реплікації SARS-CoV‑2
Ще однією властивістю є більш специфічний «оздоровчий» ефект ІКС при COVID‑19. Експерименти in vitro показали, що будесонід або беклометазон, циклесонід і мометазон, але не флютиказон пригнічують реплікацію SARS-CoV‑2 так само, як і лопінавір. Інгібуюча дія циклесоніду на реплікацію SARS-CoV‑2 була опосередкована через неструктурний білок 15 (Matsuyama S. et al., 2020).
Доцільність прийому ІКС на амбулаторному етапі лікування COVID‑19
Як уже зазначалося, значне вірусне навантаження супроводжується високою ймовірністю тяжкого клінічного перебігу та прогресування COVID‑19. Саме тому важливою стратегією попередження тяжких форм COVID‑19 є пригнічення розмноження вірусу SARS-CoV‑2 на ранніх етапах інфекційного процесу та можливість протидії гіперзапальній відповіді організму на ранніх етапах.
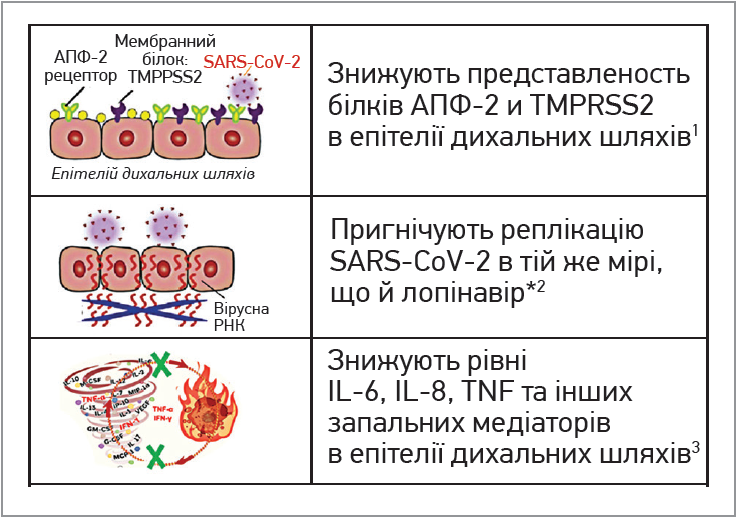
Тому пригнічення експресії білків, які зв’язуються з рецепторами АПФ‑2 і TMPRSS2 в епітелії дихальних шляхів, можливе блокуванням ІКС реплікації SARS-CoV‑2 в епітелії дихальних шляхів, пряма протизапальна дія ІКС в легенях може сприяти зменшенню вірусного навантаження та зниженню продукції IL‑6, IL‑8, ТNF у пацієнтів з COVID‑19 (рис. 2).
Рис. 2. Ефекти ІКС при коронавірусній інфекції (адаптовано)
Примітки: 1Peters M. et al. AJRCCM 2020 in press. Published April 29, 2020 as 10.1164/rccm.20202020; 2Matsuyama S. et al. The inhaled corticosteroid ciclesonide blocks coronavirus RNA replication by targeting viral NSP15; 3Lipworth В. et al., Ann Allergy Asthma Immunol 125 (2020). * *Циклосонід, мометазон.
Кілька рандомізованих досліджень показали, що застосування системних кортикостероїдів призводить до зниження рівня смертності у осіб, госпіталізованих з COVID‑19 (Horby P., Lim W. S., Emberson J. R. et al., 2021; Sterne J. A., Murthy S. et al., 2020). У дослідженні RECOVERY було виявлено найбільшу ефективність системних кортикостероїдів, що знаходились на штучній вентиляції легень; можна думати, що використання ІКС при COVID‑19 на амбулаторному етапі може бути доцільним, особливо враховуючи розповсюджену практику використання системних кортикостероїдів у пацієнтів з легким перебігом коронавірусної хвороби. Щоб перевірити, чи будуть ІКС ефективними засобами лікування коронавірусної інфекції на ранньому етапі, науковці провели кілька рандомізованих клінічних досліджень.
Дослідження STOIC
STOIC (STerOids in COVID‑19 Study) – це відкрите рандомізоване дослідження, у якому взяли участь 146 дорослих пацієнтів з підтвердженим діагнозом COVID‑19 на етапі розвитку перших симптомів захворювання. До випробування не залучали осіб, які на момент обстеження потребували госпіталізації та продовжували приймати системні кортикостероїди чи ІКС або ж приймали їх протягом останніх 7 днів. Пацієнтів розподілили на дві групи: перша група (n=73) отримувала звичайне лікування, друга група (n=73) отримувала будесонід у сухопорошковому інгаляторі в дозі 800 мкг 2 рази на день. До всіх учасників телефонували щодня для реєстрації рівня сатурації крові киснем (SpO2), температури й оцінки будь-яких несприятливих подій протягом випробування.
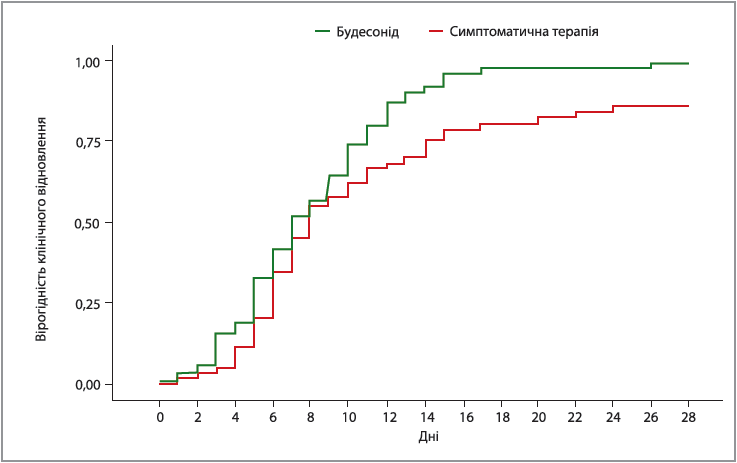
Результати показали, що потреба в невідкладній допомозі зменшилася на 90%. Серед осіб, котрі приймали будесонід, лише 1 пацієнт потребував невідкладної допомоги (проти 10 пацієнтів у групі симптоматичного лікування); клінічне одужання, про яке повідомляли пацієнти, було швидшим на 1 день у групі ІКС порівняно зі стандартним лікуванням (медіана – 7 проти 8 днів); середній час відновлення в цих групах становив 8 і 11 днів відповідно (рис. 3).
Рис. 3. Клінічне відновлення за даними опитування, вираженості симптомів і суб’єктивного стану пацієнтів
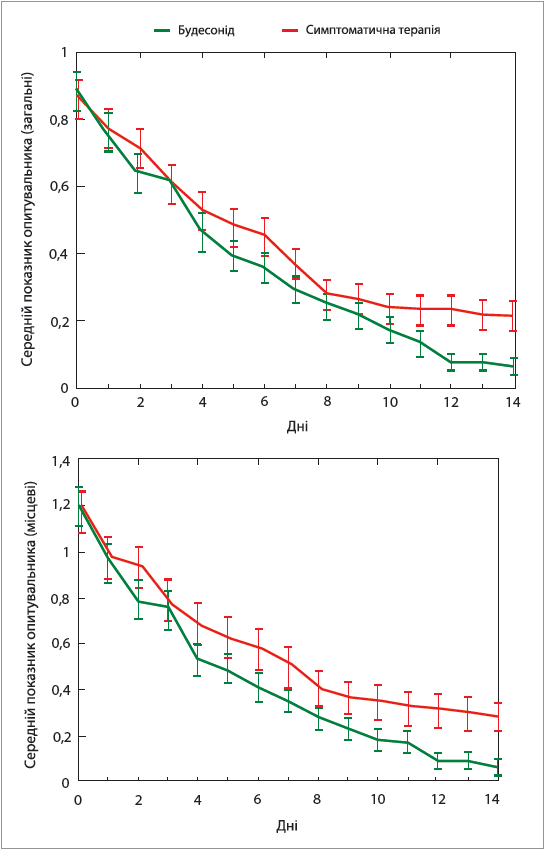
На 14-й день симптоми спостерігались у 10% (n=7) осіб, що приймали ІКС, порівняно з 30% (n=21) осіб з групи стандартного лікування. Середня частка днів із задокументованою лихоманкою (≥37,5 °C) протягом перших 14 днів становила 2,1% у групі ІКС і 7,7% у групі порівняння. Частка пацієнтів із щонайменше 1 добою лихоманки складала 11 і 23% відповідно (рис. 4).
Рис. 4. Щоденні середні показники вираженості симптомів, визначені за допомогою опитувальника симптомів
Попереднє дослідження інгаляційного будесоніду для лікування COVID‑19 у амбулаторних пацієнтів продемонструвало доцільність його застосування, однак ефективність такого лікування у осіб з високим ризиком ускладнень тривалий час залишалася невідомою. Отримати відповідь на це питання допомогли результати дослідження PRINCIPLE.
Дослідження PRINCIPLE
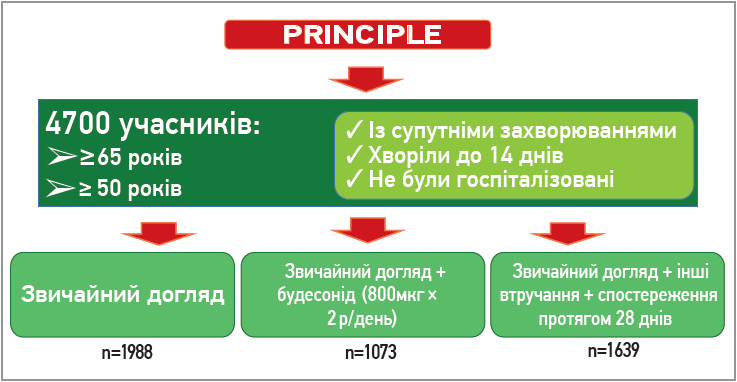
Дослідження PRINCIPLE – багатоцентрове відкрите рандомізоване контрольоване дослідження за участі 4700 жителів Великої Британії, у яких було діагностовано COVID‑19; дослідження проводилось дистанційно з випробувального центрального центру та передбачало надання хворим первинної медичної допомоги. Вік пацієнтів становив ≥65 або >50 років за наявності супутніх захворювань; усі вони хворіли протягом 14 днів, мали позитивний результат з тестування на SARS-CoV‑2, госпіталізованими не були. Всіх учасників рандомно розподілили на групи спостереження (n=1988), спостереження + інгаляційний будесонід (800 мкг 1 р/добу протягом 14 днів) (n=1073) або та спостереження з використанням інших заходів(n=1639) (рис. 5). Тривалість спостереження склала 28 днів. Первинна кінцева точка – час до одужання, госпіталізації чи смерті, пов’язаної з COVID‑19.
Рис. 5. Дизайн дослідження PRINCIPLE (адаптовано)
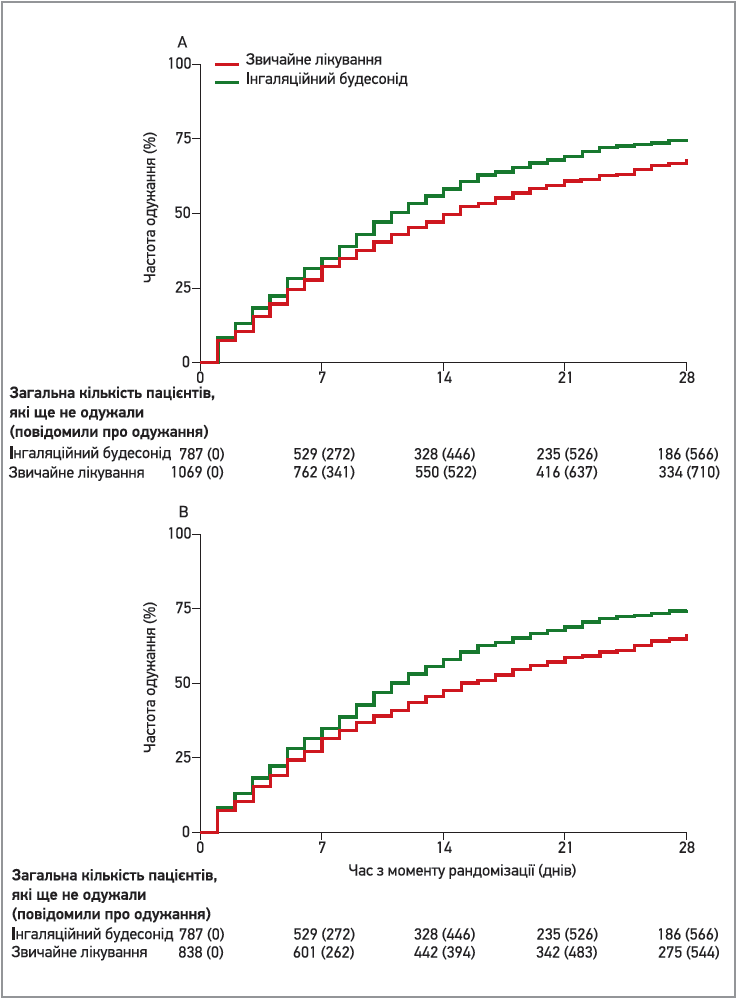
Отримані результати показали, що застосування інгаляційного будесоніду на 2,94 дня скорочує час одужання на ранніх стадіях COVID‑19 у пацієнтів віком ≥65 та ≥50 років, котрі мали супутні захворювання, порівняно з групою стандартного лікування (11,8 дня в групі інгаляційного будесоніду та 14,7 дня в групі стандартного лікування); частота госпіталізації та летальних наслідків була на 2% меншою в групі будесоніду, ніж у групі стандартного лікування. У групі первинного аналізу 72 (9%) із 787 учасників групи інгаляційного будесоніду були госпіталізовані або померли через COVID‑19 (71 госпіталізація, з них 5 осіб померли; 1 випадок смерті без госпіталізації) порівняно зі 116 (11%) із 1069 хворих групи звичайного лікування (114 госпіталізованих, з них 9 осіб померли, двоє померли без госпіталізації). Рівень переваги був трохи нижчим попередньо визначеного порогу в первинному аналізі сукупності (0,963 із запланованим 0,975); учасники, котрі застосовували будесонід, почували себе краще та протягом 28 днів частіше повідомляли про стійке одужання (рис. 6).
Рис. 6. Результати дослідження PRINCIPLE щодо застосування інгаляційного будесоніду порівняно зі звичайним лікуванням симптомів і щодо суб’єктивного стану пацієнтів
! Отримані результати як для первинних, так і для вторинних кінцевих точок свідчать, що інгаляційний будесонід є ефективним, безпечним і легкодоступним методом лікування COVID‑19. Прийом інгаляційного будесонідупацієнтами з COVID‑19, які мають вищий ризик ускладнень, достовірно покращує час до одужання, зменшує виразність симптомів і покращує стійке одужання протягом 28 днів із шансом зменшити кількість госпіталізацій або смертей.
Будесонід Ізіхейлер® 200 мкг /200 доз
Обговорювати питання ефективності ІКС неможливо від без розуміння тих чи інших переваг доставкових пристроїв, адже саме доза вони забезпечують розподіл дози препарату в дихальних шляхах. Високою популярністю користується доставковий пристрій Ізіхейлер® (рис. 7). На відміну від багатьох інших подібних пристроїв сухопорошковий інгалятор Ізіхейлер® забезпечує високий відсоток надходження лікарського засобу до нижніх відділів дихальних шляхів навіть за низького інспіраторного потоку. Сьогодні найдоступнішим інгаляційним препаратом будесоніду в Україні є сухопорошковий інгалятор Будесонід Ізіхейлер 200 доз, по 200 мкг/доза. Важливим є те, що пацієнти з БА можуть отримувати Будесонід Ізіхейлер за рецептом згідно з урядовою програмою «Доступні ліки».
Рис. 7. Багатодозовий сухопорошковий інгалятор Ізіхейлер® у розрізі
Порівняно з аерозольними інгаляторами доставковий пристрій Ізіхейлер® забезпечує вдвічі вищий відсоток доставки препарату до легень та на 35% збільшує депозицію ІКС у легенях.
Відомо, що при застосуванні сухопорошкового інгалятора не вся доза препарату може потрапляти до дихальних шляхів внаслідок недостатньої сили повітряного інспіраторного потоку у пацієнтів. Тобто існує ризик, що доставлена до дихальних шляхів доза не відповідатиме відміряній дозі самим інгалятором.
Ізіхейлер® має високий внутрішній опір. Повітря під час вдиху зумовленим проходить через невеликий розмір вентиляційного отвору, що створює турбулентний повітряний потік у дозувальній чаші. Саме цей потік забезпечує дезагрегацію частинок лікарського засобу та викид достатньої дози навіть за низького інспіраторного потоку.
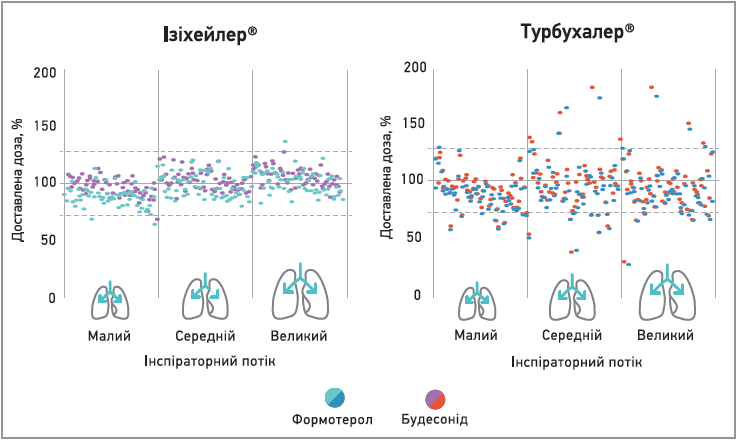
Згідно з даними A. Palander і співавт., Ізіхейлер® доставляє точнішу дозу препарату, ніж Турбухалер® і Дискхaлер, навіть за низького інспіраторного потоку, що зрештою може сприяти покращенню контролю БА (рис. 8). Також варто відзначити простоту та легкість застосування інгалятора Ізіхейлер®. Для виконання інгаляції пацієнту необхідно виконати 3 прості кроки (рис. 9). Більшість пацієнтів навчаються використовувати Ізіхейлер® менш ніж за 5 хв.
Рис. 8. Доставка дози будесоніду та формотеролу з двох багатодозових інгаляторів сухого порошку, котрі містять будесонід/формотерол, – Ізіхейлер® і Сімбікорт Турбухалер® – за різного інспіраторного потоку.
Примітки: доза, що доставляється, виражена у вигляді відсотка від номінальної дози, заявленої на етикетці. У кожному випадку представлена одноразова інгаляція. Ізіхейлер® продемонстрував статистично значиму стабільність дози для всіх трьох інспіраторних потоків порівняно з пристроєм Турбухалер® (р<0,001 для трьох інспіраторних потоків) (Galffy G. et al., 2019).
Рис. 9. Ізіхейлер® – легко вчити, вчитися і застосовувати
Важливою особливістю даного пристрою є лічильник доз, завдяки якому пацієнт може бачити кількість доз, що залишається в інгаляторі.
Небуфлюзон
Альтернативою інгаляційному будесоніду у пацієнтів з COVID‑19 є флютиказону пропіонат, який має високу спорідненість (приблизно вдвічі вищу, ніж у будесоніду) та тривалий зв’язок з КС-рецепторами, що забезпечує його потужну місцеву протизапальну дію. Водночас цей препарат характеризується низькою системною активністю, що забезпечує належний профіль безпеки. В Україні флютиказону пропіонат для небулайзерної терапії у дітей віком ≥4 років випускається під назвою Небуфлюзон® (ТОВ «Юрія-Фарм»).
Використання парентерального ацетилцистеїну при COVID‑19
Знаючи про деякі механізми розвитку COVID‑19, можна припустити, що зниження проявів оксидантного стресу та кількості протизапальних цитокінів IL‑6, IL‑8, TNF у легеневій тканині призведе до зменшення апоптозу клітин респіраторного тракту.
Ацетилцистеїн – потужний антиоксидант
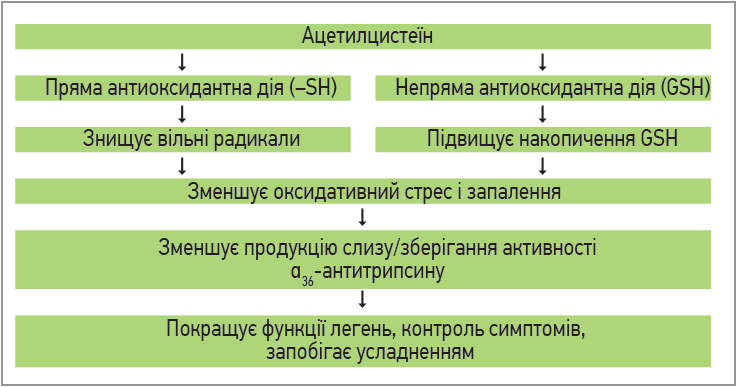
Застосування препаратів з антиоксидантними властивостями у хворих на COVID‑19 є цілком обґрунтованим, оскільки попереджає і зменшує наслідки цитокінового шторму. Один з таких засобів (з добре вивченим антиоксидантним ефектом) – ацетилцистеїн; його потужний антиоксидантний ефект зумовлений непрямою (внаслідок того, що він є попередником найважливішого компонента антиоксидантної системи – глутатіону) і прямою дією (за рахунок наявності вільної сульфгідрильної групи) (рис. 10). Глутатіон вважається основним внутрішньоклітинним антиоксидантом.
Рис. 10. Антиоксидантні властивості ацетилцистеїну
(Yan X. et al., 2017)
Відомо, що глутатіон знижує пошкодження респіраторного епітелію оксидантним стресом при інфекційних захворюваннях, пригнічує вірусні агенти, забезпечує регуляцію клітинного імунітету, регулює синтез та відновлення вітамінів А, С і D, а також бере участь у контролі процесів клітинної проліферації й апоптозу.
У результаті реакції деацетилізації ацетилцистеїн перетворюється в цистеїн, сульфгідрильні (–SH) групи якого зв’язуються з вільними радикалами, зменшуючи тим самим прояви оксидантного стресу та запалення.
Вплив ацетилцистеїну на синтез протизапальних цитокінів в епітеліоцитах легень
Особливо важливим є те, що ацетилцистеїн здатний пригнічувати синтез прозапальних цитокінів (IL‑6 и IL‑8, TNF) в епітеліоцитах легень при вірусних захворюваннях (P. Ghezzi et al., 2016).
Враховуючи вплив на синтез глутатіону та дані про можливість ацетилцистеїну впливати на прозапальні медіатори, у своєму огляді Poe F. L. із співавторами вказують на потенціальну ефективність ацетилцистеїну в лікуванні пацієнтів з COVID‑19 (Poe F. L. et al., 2020).
Позитивний вплив ацетилцистеїну на стан пневмоцитів
Достеменно відомо, що ацетилцистеїн впливає на продукцію сурфактанта. Зокрема, у дослідженні G. C. Mereto та співавт. було продемонстровано, що ацетилцистеїн, який вводився дом’язово в дозі 300 мг 2 р/день, посилював секреторну активність пневмоцитів 2 типу, котрі беруть участь у синтезі сурфактанта.
Ефективність дії ацетилцистеїну на основні ланки патогенезу пневмонії, включаючи вплив на оксидантний стрес та запалення, було підтверджено Q. Zhang і співавт. (2018). У пацієнтів з негоспітальною пневмонією, які додатково до стандартної терапії застосовували ацетилцистеїн у дозі 1200 мг/добу протягом 10 днів, спостерігали достовірне зниження рівнів малонового діальдегіду та фактора некрозу пухлини, а також підвищення загальної антиоксидантної активності.
Ацетилцистеїн для парентерального введення при COVID‑19 також доцільно використовувати для відновлення мукоциліарного кліренсу. Мукостаз зумовлює потенціювання бронхообструктивного синдрому, подовження терміну запального процесу в нижніх дихальних шляхах, колонізацію патогенною флорою з розвитком ускладнень. Ефективність ацетилцистеїну як муколітика, застосовуваного в інгаляціях або ін’єкціях, вивчали у низці досліджень, результати яких продемонстрували, що препарат ефективно розріджує мокротиння, полегшує відкашлювання та сприяє зменшенню виразності кашлю й усуненню симптомів бронхолегеневого процесу (Mokhtari V. et al., 2017).
! Пневмопротекторний ефект ацетилцистеїну також пов’язують з його здатністю запобігати апоптозу. Існуючі докази свідчать про те, що застосування парентерального ацетилцистеїну може бути ефективною стратегією в лікуванні пацієнтів з COVID‑19 внаслідок його пневмопротекторної та антиоксидантної дії.
Досвід застосування ацетилцистеїну для парентерального введення при COVID‑19
Переваги призначення ацетилцистеїну хворим на COVID‑19 вивчали В. В. Гайнітдинова зі співавт. (2021). До дослідження включили дорослих пацієнтів (середній вік – 57 (51; 71) років) з COVID‑19-асоційованою середньотяжкою пневмонією.
Було сформовано 2 групи дослідження: пацієнти 1-ї групи (n=22; контроль) отримували стандартне лікування – гідроксихлорохін 200 мг (800 мг на добу на 1 день); 400 мг на добу – 2-7-й день; азитроміцин 500 мг на добу 5 днів; еноксапарин 0,4 мг на добу підшкірно; дексаметазон 8-12 мг на добу; при рівні С-реактивного білка (СРБ) ≥60 мг/л – тоцилізумаб 400 мг на добу; хворі 2-ї групи (n=24) додатково отримували ацетилцистеїн 1200-1500 мг на добу внутрішньовенно крапельно. Досліджувані групи були зіставні за всіма показниками.
Результати:
- рівень SpO2 у кожного пацієнта групи стандартного лікування зріс у середньому на 3,0±1,5% – з 93 до 96%, водночас приріст цього показника в групі ацетилцистеїну становив у середньому 4,6±1,1% – з 92,5 до 97%;
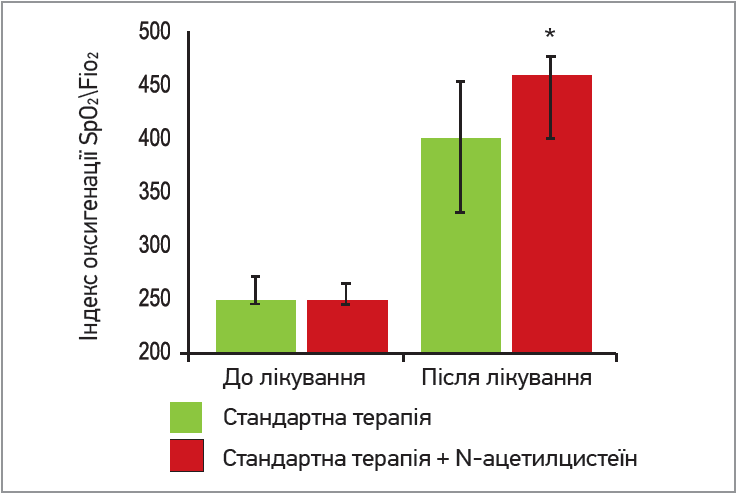
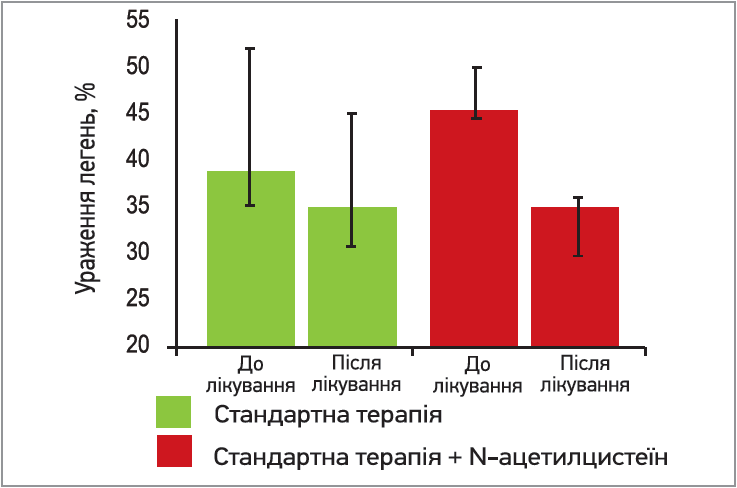
- був отриманий статистично значущий приріст рівня сатурації в групі ацетилцистеїну для парентерального введення, ніж у групі стандартної терапії (рис. 11); об’єм ураження легень за даними КТ до лікування становив 45,5% у пацієнтів групи ацетилцистеїну та 39% у групі стандартного лікування. У результаті лікування даний показник досягнув значень 35% – в 1-й групі (покращення статистично значимо p<0,001) і 35% – у 2-й. Середня інтенсивність зменяшення об’єму ураження легень за даними КТ у хворих досліджуваних груп становила 31,0±8,3 та 17,0±6,2% відповідно (p<0,001) (рис. 12); на 3-й день лікування тільки в групі ацетицистеїну продемонстровано статистично значуще (p=0,002) зниження початкового рівня СРБ в групах дослідження– з 81 до 44 мг/л;
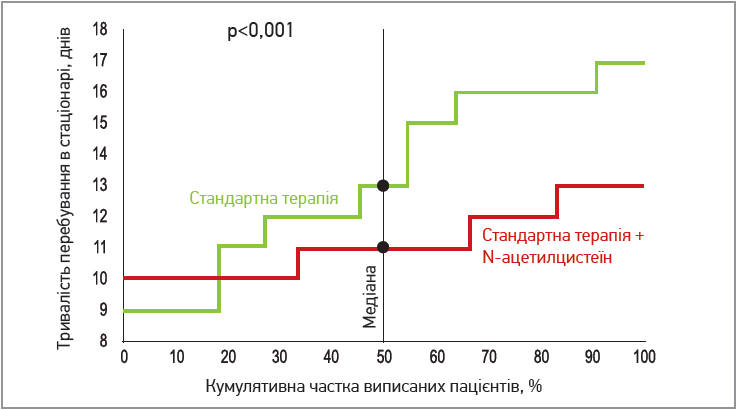
- додавання ацетилцистеїну до стандартної терапії достовірно знижує тривалість госпіталізації (р < 0,001). Так. у групі пацієнтів, які отримали лише стандартну терапію, тривалість госпіталізації в стаціонарі склала 13 (від 11 до 16) ліжко-днів, тоді як у групі пацієнтів, що отримували ацетилцистеїн – 11 (10; 12) ліжко-днів (рис. 13).
Рис. 11. Індекс оксигенації SpO2/FiO2 до та після лікування в групах дослідження (інтерквартильний інтервал)
Примітки: SpO2 – насичення крові киснем; FiO2 – фракція кисню, що надходить у кров під час вдиху. * Статистично значима різниця із групою стандартного лікування (p≤0,05).
Рис. 12. Відсоток ураження легень
(за даними комп’ютерної томографії) до та після лікування в групах дослідження (інтерквартильний інтервал)
Рис. 13. Криві Каплана-Меєра для тривалості госпиталізації в групах дослідження
Рис. 14. Максимальна концентрація N-ацетилцистеїну через 1 год після його прийому per os та в/в введення в дозах 600 і 1200 мг в мг на 1 мл крові
Висновок
Результати дослідження свідчать про ефективність включення парентерального ацетилцистеїну до комплексного лікування середньотяжкої COVID‑19-асоційованої пневмонії. Статистично значущо підвищилися: рівень SpO2, індекс оксигенації, інтенсивність зменшення обсягу ураження легень, інтенсивність зниження рівня СРБ; відзначили скорочення тривалості госпіталізації.
Не дивлячись на те, що дослідження продемонструвало ефективність у пацієнтів із середньотяжким перебігом COVID‑19, на думку авторів, доцільно використовувати ацетилцистеїн для парентерального введення при лікуванні СOVID‑19.
Важливість парентеральної форми ацителцистеїну
Пероральний ацетилцистеїн має низьку біодоступність – 4-10%, що пов’язано з високим ефектом першого проходження препарату через печінку.
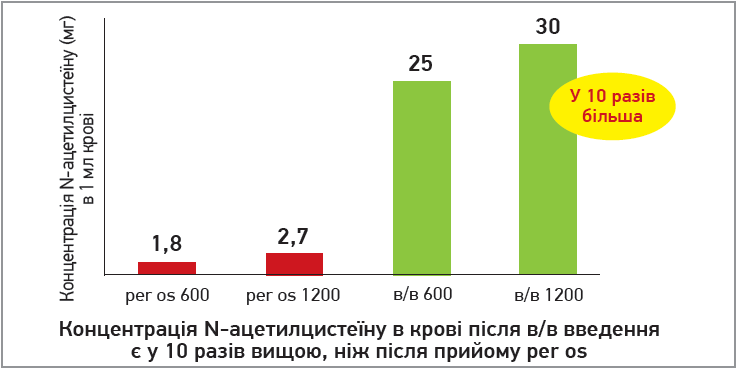
Парентеральні форми ацетилцистеїну за рахунок створення вищої концентрації активної речовини в крові краще нівелюють прояви оксидантного стресу. Так, у дослідженні О. О. Дутова зі співавт. (2020), у якому вивчали фармакокінетичні параметри N-ацетилцистеину за одноразового перорального та внутрішньовенного введення, виявилося, що максимальна концентрація в крові (Cmax) через 1 год після введення була більш ніж у 10 разів вищою при внутрішньовенному введенні порівняно з пероральним (застосовували однакові дози препаратів – 600 або 1200 мг) (рис. 14).
Рис. 14. Максимальна концентрація N-ацетилцистеїну через 1 год після його прийому per os та в/в введення в дозах 600 і 1200 мг в мг на 1 мл крові
Саме підтримання високих концентрацій ацетилцистеїну зможе забезпечити потужний антиоксидантний та протизапальний вплив, який обґрунтовує пневмопротекторний ефект ацетилцистеїну.
Інгаляційний ацетилцистеїн при COVID‑19
В огляді 2021 року група вчених із США та Бразилії розглянула використання інгаляційного ацетилцистеїну у пацієнтів з COVID‑19 як можливість суттєвого збільшення рівня глутатіону. Оксидативний стрес та відсутність глутатіону перешкоджає здатності організму детоксикувати клітинне мікросередовище, підтримувати здорову імунну відповідь і корегувати апоптотичні процеси. Оскільки ацетилцистеїн є прямим субстратом для утворення глутатіону, інгаляції ацитилцистеїну можуть протидіяти оксидантному стресу, запаленню й апоптозу респіраторного епітелію при COVID‑19. В оглядовій роботі професорської спілки зазначено: «Інгаляції ацетилцистеїну, як допоміжна терапія, можуть бути корисними для лікування ранніх стадій COVID‑19, необхідні додаткові дослідження (Lana J. F. еt al., 2021).
Враховуючи позитивні результати використання парентерального ацетилцистеїну при СOVID‑19, створення високих доз ацетилцистеїну за рахунок інгаляцій буде сприяти потужному антиоксидантному ефекту та запобігати передчасному апоптозу респіраторного епітелію.
Важливо, що інгаляційний ацетилцистеїн не має прямого впливу на шлунково-кишковий тракт, що значно знижує ризик діареї, нудоти та болю в епігастрії, який зустрічається при прийомі перорального ацетилцистеїну.
Інгаміст
В Україні на сьогодні зареєстровано єдиний препарат ацетилцистеїну у формі для ін’єкційного, інгаляційного та внутрішньом’язового введення застосування – Інгаміст. Інгаляційно препарат використовується без розведення, з 6-ти років, по 1 ампулі (300 мг) 2 р/добу. Дом’язеве введення проводиться без розведень. При внутрішньовенному застосуванні засіб необхідно вводити повільно (краплинно) в 0,9% розчині натрiю хлориду чи 5% розчині глюкози. Дом’язево та внутрішньовенно дорослим пацієнтам застосовують по 1 ампулі (300 мг) 2 р/добу, хоча в міжнародних дослідженнях використовували препарат і у вищих дозах. Ще одним показанням для призначення ацетилцистеїну є відновлення мукоциліарного кліренсу.
На користь ефективності парентерального застосування ацетилцистеїну при COVID‑19 свідчать і вітчизняні рекомендації. Так, згідно з Постановою Кабінету Міністрів України від 28.10.2020 р. № 1033, парентеральний ацетилцистеїн увійшов до переліку лікарських засобів, необхідних для виконання заходів, спрямованих на запобігання виникненню і поширенню, локалізацію та ліквідацію спалахів, епідемій та пандемій гострої респіраторної хвороби COVID‑19 (Кабінет Міністрів України, 2020б).
Препарати L-аргініну
Одним з головних донаторів азоту, необхідних для синтезу NO, є L-аргінін, молекула якого містить 4 атоми азоту. Додаткові антиоксидантні, протибактеріальні й антивірусні здатності NO поряд з його дезінтоксикаційними властивостями (Wu G. et al., 2021) зробили L-аргінін одним з потенційних засобів для корекції змін з боку серцево-судинної системи у осіб з COVID‑19. Ключовою ланкою патофізіології дефіциту NO та розвитку ендотеліальної дисфункції є зниження рівня амінокислоти Lаргініну, концентрація якої в нормі становить 45-150 мкмоль/л (залежно від віку та дієти) (Boger R. H., 2001).
Аргінін є субстратом для еNOS – ферменту, що каталізує синтез NO в ендотеліоцитах.
! L-аргінін активує гуанілатциклазу та підвищує рівень цГМФ в ендотелії судин, що супроводжується зниженням активації та адгезії лейкоцитів і тромбоцитів до ендотелію судин та зменшенням ризику тромбоутворення.
Фізіологічна дія NO варіює від модуляції судинної системи до регуляції імунних процесів (клітинно-опосередкований імунітет, вплив нейтрофілів на патогенні мікроорганізми, неспецифічний імунний захист) і контролю нейрональних функцій. L-аргінін відновлює вміст NO в легеневій тканині, що зменшує спазм непосмугованої мускулатури бронхів і поліпшує вазомоторну функцію ендотелію легеневих артерій (Gokce N., 2004). L-аргінін ефективно сприяє зниженню артеріального тиску в пацієнтів з артеріальною гіпертензією (Gui S., Jia J., Niu X., 2014).
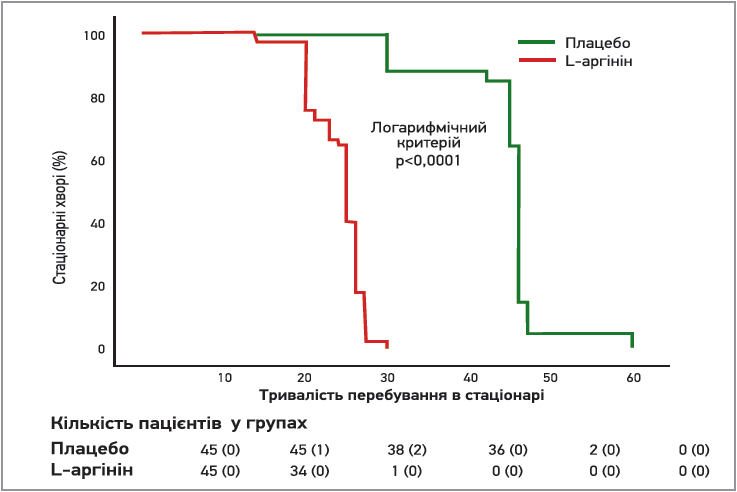
Усі вищезазначені дані щодо властивостей L-аргініну стали підставою для проведення подвійного сліпого рандомізованого плацебо-контрольованого дослідження, в якому госпіталізованим хворим з тяжким перебігом COVID‑19 (n=90) додатково призначали пероральний L-аргінін (1,66 г 2 р/добу) чи плацебо (Fiorentino G. et al., 2021). Як первинну кінцеву точку обрали зниження необхідності в респіраторній підтримці через 10 та 20 діб після лікування; вторинну кінцеву точку склали тривалість перебування в стаціонарі, час до нормалізації кількості лімфоцитів і час отримання негативного результату полімеразної ланцюгової реакції щодо наявності SARS-CoV‑2 у мазках з носоглотки.
Результати:
- на 10-ту добу лікування лікарі відзначили зниження активності респіраторної підтримки у 71,1% пацієнтів з групи L-аргініну та у 44,4% хворих з групи плацебо (р<0,01). На 20-ту добу лікування зазначена достовірна між групова різниця нівелювалася;
- середня тривалість перебування у стаціонарі значно знизилася у хворих, які додатково отримували L-аргінін: вона склала 25 днів в основній групі та 46 діб у групі плацебо (р<0,0001). Внесення поправки на вік, стать пацієнтів, тривалість існування симптомів, наявність супутніх захворювань, рівень D-димеру, прийом противірусних засобів та антикоагулянтів не вплинуло на наведені дані: пероральний прийом L-аргініну суттєво зменшував тривалість стаціонарного лікування (рис. 15).
Рис. 15. Вплив L-аргініну на тривалість стаціонарного лікування хворих на COVID‑19 (Fiorentino G. et al., 2021)
На вітчизняному фармацевтичному ринку добре відомий препарат L-аргініну – Тівортін Аспартат, який є пероральним розчином, що містить L-аргініну аспартат у концентрації 200 мг/мл. Препарат рекомендовано застосовувати внутрішньо під час їжі по 5 мл 3-8 р/добу. Пацієнтам, котрі перенесли гострі прояви COVID‑19, доцільно призначати курсовий прийом Тівортіну Аспартату – до 2 міс (2-3 р/рік). Слід зазначити, що Тівортіну Аспартат не лише покращує стан ендотелію, а й зменшує прояви системного запалення та оксидантного стресу, що відіграють важливу роль у формуванні постковідного синдрому.
Ефективна патогенетична схема «Глісада»
Отже, лікування хворих на COVID‑19 на амбулаторному етапі є досить складним завданням, що потребує всебічного впливу на основні патогенетичні ланки розвитку та прогресування цього захворювання.
Сьогодні ми маємо докази доцільності застосування:
- Будесонід Ізіхейлер® здатний через вплив на рецептори AПФ‑2 інгібувати розмноження вірусу SARS-CoV‑2, зменшувати вірусне навантаження, призводити до зниження рівнів IL‑6 та TNF безпосередньо у легеневій тканині. Згідно з дослідженнями STOIC і PRINCIPLE оптимальною дозою сухопорошкового будесоніду є 800 мкг 2 р/день протягом у середньому 7 днів, хоча згідно практики, так і в самих дослідженнях, період використання може бути збільшений до 14-ти днів;
- Інгаміст – ацетилцистеїн, який при інгаляційному або ін’єкційному застосуванні створює високі концентрації активної речовини в легенях, що забезпечує потужний антиоксидантний захист. Інгаміст рекомендовано застосовувати інгаляційно в дозі 1 ампула 2 р/день без розведень курсом 10 днів;
- Тівортін аспартат у вигляді перорального розчину використовують з метою корекції дисфункції ендотелію, пригнічення надмірної адгезії тромбоцитів та імунотромбозу при COVID‑19. Тівортін аспартат рекомендується застосовувати по 1 мірній ложці 2 р/день курсом до 2 місяців.
Список літератури знаходиться в редакції.