11 лютого, 2023
Проблемні аспекти у терапії поширених урологічних захворювань
За матеріалами конференції
У статті представлено основні напрями профілактики рецидивів раку передміхурової залози у схемі терапії порятунку та перспективи таргетної радіоізотопної терапії у пацієнтів цього профілю. Крім того, розглянуто сучасні можливості лікування хронічного калькульозного простатиту, післяопераційних ректоуринарних нориць, а також роль антихолінергічного навантаження у розвитку декомпенсації сечового міхура.
Ключові слова: рак передміхурової залози, простат-специфічний антиген, радикальна простатектомія, таргетна радіоізотопна терапія, хронічний калькульозний простатит, ректоуринарні нориці, антихолінергічне навантаження.
Конгрес Асоціації урологів України, який відбувся 8-10 вересня, став потужною платформою для презентації новітніх методик діагностики й лікування найбільш поширених урологічних захворювань у чоловіків.
 Один із гостей заходу – доктор філософії, доктор медицини з відділення урології Нідерландського інституту раку P.J. van Leeuwen виступив із доповіддю «Рятівна терапія раку простати», представленою у рамках Європейської школи урології за підтримки Європейської асоціації урології (ЄАУ). Спираючись на рекомендації ЄАУ, він висвітлив особливості терапії порятунку у хворих на рак передміхурової залози (РПЗ).
Один із гостей заходу – доктор філософії, доктор медицини з відділення урології Нідерландського інституту раку P.J. van Leeuwen виступив із доповіддю «Рятівна терапія раку простати», представленою у рамках Європейської школи урології за підтримки Європейської асоціації урології (ЄАУ). Спираючись на рекомендації ЄАУ, він висвітлив особливості терапії порятунку у хворих на рак передміхурової залози (РПЗ).
Спікер зазначив, що одним із найважливіших етапів лікування є виявлення пацієнтів із локальними рецидивами/метастазами після простатектомії або променевої терапії. Основою спостереження має бути моніторинг рівня простат-специфічного антигена (ПСА), підвищення якого майже завжди передує клінічному рецидиву. Утім варто зважати лише на клінічно значущі підвищення рівня ПСА. Оптимальної частоти визначення ПСА після лікування наразі не встановлено. Відповідно до рекомендацій ЄАУ, після радикальної простатектомії та променевої терапії рівень ПСА оцінюють кожні 6 міс протягом трьох років, надалі – щорічно. Іноді виникає потреба у більш частій діагностиці. У чоловіків із пороговим рівнем ПСА <0,01 нг/ мл, визначеним ультрачутливим методом, із 96% ймовірністю не буде рецидиву РПЗ впродовж наступних двох років. Натомість в осіб із рівнем ПСА >0,01 нг/мл, поєднаним із клінічними характеристиками, наприклад рівнем диференціації пухлини за шкалою ISUP (Міжнародного товариства з уропатології) або особливостями краю резекції, можливе прогресування захворювання. Тому протягом перших двох років у таких пацієнтів доцільно визначати рівень ПСА кожні 3 міс. Варто пам’ятати, що 50% рецидивів виникають через три роки після лікування, що може бути підставою для зміни частоти діагностики.
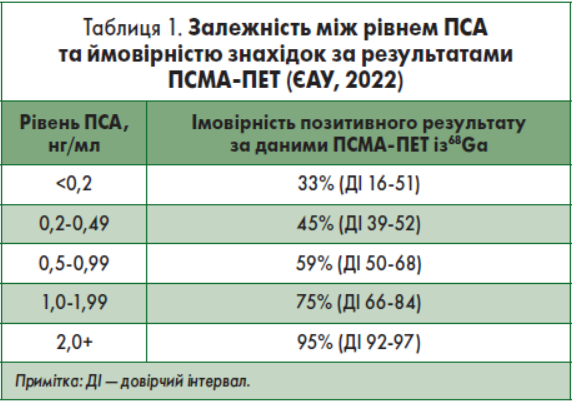
Хворим, які підлягали радикальній простатектомії й мають стійке підвищення рівня ПСА >0,2 нг/мл, показана ПСМА-позитронно-емісійна томографія із визначенням простат-специфічного мембранного антигена (ПСМА-ПЕТ), якщо передбачається, що її результати вплинуть на лікування. При низьких рівнях виконання ПСМА-ПЕТ є малодоцільним, наприклад при ПСА <0,2 нг/мл метастази виявляють лише у 33% випадків. Відповідно, із підвищенням рівня ПСА зростає ймовірність діагностування метастазів поза ямкою простати (табл. 1). Відсутність знахідок за результатами ПСМА-ПЕТ не є підставою для відтермінування променевої терапії порятунку.
Спостереження після променевої терапії має свої особливості. Рівень ПСА знижується повільніше, ніж після радикальної простатектомії (табл. 2, 3). Пороговий рівень ПСА <0,5 нг/мл після променевої терапії асоційований із позитивним прогнозом, хоча оптимальне значення ПСА досі не встановлене. Також відомо про значущий кореляційний зв’язок між підвищенням порогового рівня ПСА на >2 нг/мл (за критеріями Фенікс) і частотою появи метастазів. Визначення за критеріями Фенікс застосовне також у пацієнтів, які отримують гормональну терапію. Негативні знахідки можливі й при нижчому рівні ПСА. За даними проспективного дослідження, співавтором якого виступав доповідач, метастази було виявлено при медіанному рівні ПСА 1,3 нг/мл (Jansen B.H.E. et al., 2021).
У пацієнтів із біохімічним рецидивом після променевої терапії, тобто підвищенням рівня ПСА, застосовуються кілька варіантів діагностики. Хворим, які підлягають локальній терапії порятунку, виконують магнітно-резонансну томографію (МРТ) передміхурової залози, спрямовану на виявлення аномальних ділянок і контроль біопсії (низький рівень рекомендацій). Пацієнтам, які підлягають куративній терапії порятунку, виконують позитронно-емісійну комп’ютерну томографію (КТ) із визначенням ПСМА (ПСМА-ПЕТ-КТ), або ПЕТ-КТ із флуцикловіном, або ПЕТ-КТ із холіном (високий рівень рекомендацій).
Спікер наголосив, що для призначення терапії порятунку не слід чекати високого рівня ПСА або знахідок за даними ПЕТ. Щодо андрогендеприваційної терапії, то вона не показана пацієнтам без метастазів, у яких рівень ПСА подвоюється протягом >12 міс (ЄАУ, 2022).
 Доповідь «Можливості терапії РПЗ 2022» представив завідувач відділу реконструктивної та геріатричної урології ДУ «Інститут урології ім. акад. О.Ф. Возіанова НАМН України», доктор медичних наук, професор Олександр Владиславович Шуляк, у якій розглянув особливості таргетної радіоізотопної терапії (ТРТ) відповідно до рекомендацій Американської асоціації урології (ААУ, 2021, 2022).
Доповідь «Можливості терапії РПЗ 2022» представив завідувач відділу реконструктивної та геріатричної урології ДУ «Інститут урології ім. акад. О.Ф. Возіанова НАМН України», доктор медичних наук, професор Олександр Владиславович Шуляк, у якій розглянув особливості таргетної радіоізотопної терапії (ТРТ) відповідно до рекомендацій Американської асоціації урології (ААУ, 2021, 2022).
Автор розпочав доповідь із питання тераностики (поєднання терапії та діагностики). Зокрема, для тераностики застосовують молекули, які складаються із трьох структурних елементів:
- білковий ліганд, що зв’язується з пухлинними клітинами з певною специфічністю;
- хелатуючий агент, що слугує перемичкою;
- радіонуклід, що забезпечує основну дію препарату.
Із діагностичною метою використовують радіоактивний галій, фтор та мідь. Для терапії можуть застосовувати джерела β-випромінювання (наприклад, лютецій) або α-випромінювання (актиній). Через низьку проникну здатність цих видів випромінювання їх застосування без специфічного ліганду є недоцільним. Але за умови їх безпосередньої доставки до пухлини радіоізотопні препарати можуть забезпечувати достатній клінічний ефект завдяки вираженій дії α- і β-частинок.
За даними дослідження Vision (Sartor S. et al., 2021), таргетна терапія подовжує життя пацієнтам із метастатичним кастраційно-резистентним РПЗ (15,3 міс проти 11,3 міс виживання; відношення ризиків – 0,62). Цікавою особливістю ПСМА є те, що природний ліганд цього антигена не відомий, а отже, його біологічна функція у клітинах передміхурової залози остаточно не з’ясована. Після зв’язування з лігандом він інтерналізується, тобто переміщується з поверхні мембрани всередину клітини, тому ПСМА-таргетні радіоізотопні препарати дуже ефективні. Їх застосування можна вважати новим етапом таргетної терапії. Методологія177Lu-ПСМА-терапії (з лютецієм) стандартизована й відображена у рекомендаціях Європейської асоціації ядерної медицини.
Незважаючи на вищезазначені факти, ТРТ залишається резервним методом лікування. Вона застосовується після проведення стандартних методів лікування, зокрема андрогендеприваційної терапії, нових антиандрогенних препаратів, цитотоксичної терапії (не менше двох курсів) і класичної радіоізотопної терапії (із радієм‑223). Застосування ТРТ можливе й у тих пацієнтів, яким не проводили хіміотерапію через протипоказання до таксанів (ефективність не оцінена у клінічних випробуваннях). Щодо ПСМА-таргетних агентів, то запланована значна кількість досліджень їх застосування, зокрема у поєднанні із доцетакселом, інгібіторами полі(АДФ-рибозо)-полімерази (ПАРП-інгібіторами), ензалутамідом або дистанційною променевою терапією. Потенціал цього виду лікування поки що не встановлений, хоча воно й видається перспективним (ААУ, 2021).
Ризик серцево-судинних захворювань (ССЗ), що виникає під час лікування, можна знизити, дотримуючись принципів ABCDE:
- A: поінформованість про серцево-судинний ризик та прояви ССЗ (awareness), обстеження щодо ССЗ (assessment), застосування препаратів ацетилсаліцилової кислоти за показаннями;
- B: контроль рівня артеріального тиску (blood pressure);
- C: оцінювання рівня холестерину (cholesterol), відмова від куріння (cigarette cessation);
- D: дієта та контроль маси тіла (diet), оцінювання кумулятивної дози антрациклінових препаратів і впливу опромінення на серце (dose), профілактика або лікування цукрового діабету (diabetes);
- E: фізичні навантаження (exercises), електрокардіографія (EKG), ехокардіографія (echoKG).
У пацієнтів із РПЗ можуть виникати когнітивні порушення, які у 50% випадків виявляють ще до початку лікування. До того ж у наукових дослідженнях встановлено зв’язок між застосуванням андрогендеприваційної терапії й виникненням деменції. Тому ще одним напрямком підтримуючої терапії при поширеному РПЗ є профілактика й лікування когнітивних порушень (ААУ, 2022).
Менеджмент поширеного РПЗ вимагає залучення мультидисциплінарних команд: психіатрів, кардіологів, медичних генетиків тощо. Дефіцит таких команд відзначають не лише в Україні, а й у США, де урологи змушені займатися питаннями, що не належать до їхньої компетенції.
 Із доповіддю «Ректоуринарні нориці у хворих після радикальної простатектомії» виступив лікар-уролог відділу відновної урології та новітніх технологій ДУ «Інститут урології ім. акад. О.Ф. Возіанова НАМН України» Євгеній Ігорович Афанас’єв (співавт. Данилець Р.О., Григоренко В.М.).
Із доповіддю «Ректоуринарні нориці у хворих після радикальної простатектомії» виступив лікар-уролог відділу відновної урології та новітніх технологій ДУ «Інститут урології ім. акад. О.Ф. Возіанова НАМН України» Євгеній Ігорович Афанас’єв (співавт. Данилець Р.О., Григоренко В.М.).
Ректоуринарна нориця – це патологічне сполучення між прямою кишкою й/або сечовим міхуром/сечовидільним каналом. Частота виникнення таких нориць після радикальної простатектомії варіює від 0,12 до 9% (Kitamura H., Tsukamoto T., 2011; Choi J.H., Jeon B.G., Choi S.G. et al., 2014). Основною причиною виникнення нориць є інтраопераційне ушкодження прямої кишки. Фактори, що сприяють виникненню ректоуринарних нориць, можуть бути інтраопераційними, наприклад поширений процес РПЗ, променева терапія зони малого таза, або післяопераційними, зокрема урогематома чи цукровий діабет.
Неспецифічними клінічними проявами ректоуринарних нориць є рецидивні інфекції сечового тракту з відповідним інтоксикаційним синдромом, біль у животі та дизуричні явища. До патогномонічних симптомів належать ректурія й/або випорожнення рідкої консистенції (60% випадків), пневматурія (30%) і фекалурія (50%). Остання є несприятливою прогностичною ознакою, що свідчить про великий розмір нориці. У середньому маніфестація нориці відбувається через 9,5 дня після радикальної простатектомії (Chun L., Abbas M.A., 2011).
Для діагностики застосовують цистограму наповнення/ретроградну уретрографію, КТ або МРТ із внутрішньовенним підсиленням, а також ендоскопічні методи. Після встановлення діагнозу важливо виконати відведення сечі (протягом 90 днів) і/або калу (протягом 60-90 днів). За допомогою такого консервативного лікування можна досягти спонтанного закриття нориці. У разі неефективності консервативних методів упродовж 90-180 днів призначають оперативні втручання (табл. 4).
Методи хірургічного втручання поділяють на трансперинеальні (застосовують найчастіше), трансанальні, транссфінктерні та трансабдомінальні. За даними літератури, ефективність хірургічного лікування ректоуринарних нориць коливається від 50 до 100% (Kitamura H., Tsukamoto T., 2011; Hechenbleikner E.M., Buckley J.C., Wick E.C., 2013).
Отже, запорукою успішного лікування нориць є можливості медичного закладу й персональний досвід хірурга.
 Тему «Хронічний калькульозний простатит як андрологічна проблема» висвітлив у своїй доповіді старший науковий співробітник відділу сексопатології та андрології ДУ «Інститут урології ім. акад. О.Ф. Возіанова НАМН України», головний лікар Українського інституту сексології і андрології, кандидат медичних наук Каміль Раїсович Нуріманов.
Тему «Хронічний калькульозний простатит як андрологічна проблема» висвітлив у своїй доповіді старший науковий співробітник відділу сексопатології та андрології ДУ «Інститут урології ім. акад. О.Ф. Возіанова НАМН України», головний лікар Українського інституту сексології і андрології, кандидат медичних наук Каміль Раїсович Нуріманов.
Спікер зазначив, що поширеність простатиту є досить високою (14%) і ризик його виникнення зростає з віком. Для захворювання характерна також сезонність загострень, що частіше виникають взимку (Mehik A. et al., 2000). За наявності хронічного простатиту частота загострень є досить високою – у 27% чоловіків із простатитом реєструють хоча б одне щорічне загострення (Nickel J.C. et al., 2002).
Простатит класифікують за чотирма категоріями (Krieger J.N. et al., 1999):
- I – гострий бактеріальний;
- II – хронічний бактеріальний;
- III – хронічний абактеріальний (90-95% випадків), що включає запальний (А) і незапальний (В);
- IV– хронічний безсимптомний.
За деякими даними (Kim D.S. et al., 2011), кальцинати виявляють у 51,1% здорових чоловіків. При цьому 76,6% кальцинатів діагностують за допомогою трансректального ультразвукового дослідження (Park S.H. et al., 2017). Типову кальцифікацію передміхурової залози відзначають на межі транзиторної та центральної зон (Dell’Atti L., Galosi A.B., Ippolito C., 2016). У своєму складі кальцинати переважно містять фосфати, що відповідає інфекційній природі початкового процесу. Наявність у пацієнта кальцинатів є предиктором низької ефективності α-адреноблокаторів, які призначають при доброякісній гіперплазії передміхурової залози (ДГПЗ) (Kuei C.H., Liao C.H., Chiang B.J., 2016). Щодо асоціації кальцинатів із РПЗ, то одні автори підтверджують цей зв’язок, зокрема для кальцинатів периферичної зони (Smolski M. et al., 2015), а інші – спростовують (Hwang T.K. et al., 2010).
Посилаючись на власний клінічний досвід, автор доповіді зауважив, що у 80% осіб із тяжким простатитом цьому стану передував курс неефективної антибіотикотерапії. Близько третини пацієнтів отримували понад три курси антибіотикотерапії, що ускладнювало їх подальше лікування. Однією із причин неналежного лікування було неповідомлення лікаря про минулі курси антибіотикотерапії.
Діагностику й лікування калькульозного простатиту зручно проводити відповідно до системи UPOINT, що передбачає оцінювання сечових, психосоціальних, органоспецифічних, інфекційних, неврологічних та міофасціальних симптомів. У терапії застосовують комплексний підхід, що включає фармакотерапію, нефармакологічне лікування та інтервенційну медицину. Найбільш ефективними фармакологічними препаратами є антибіотики, α-адреноблокатори й протизапальні засоби. Предиктори ефективності антибіотиків при хронічному простатиті/синдромі хронічного тазового болю (ХП/СХТБ) досі не встановлені (Nickel J.C. et al., 2001). За даними цих авторів, не виявлено переваги на користь культурального й мікроскопічного досліджень секрету передміхурової залози або визначення в ньому антитіл, які виконують при підборі антибіотика. Спікер зазначив, що в багатьох пацієнтів за неефективності першого курсу антибіотикотерапії подальші курси теж виявляються недієвими. Базова терапія ХП/СХТБ, що застосовувалася авторами, не залежала від ступеня больових та дизуричних явищ і передбачала призначення диклофенаку натрію, тамсулозину та спиртового екстракту Serenoa repens. Інші препарати, які показані пацієнтам із ХП: кверцетин, ацетилцистеїн, амітриптилін, дулоксетин, прегабалін, пентозану сульфат, танезумаб, зафірлукаст.
Виділяють багато нефармакологічних методів лікування ХП, зокрема термотерапію, акупунктуру, фізичну активність, електромагнітну терапію. Доцільно застосовувати екстракорпоральну ударно-хвильову терапію, призначаючи по 10 сеансів на курс (стандартно призначають 4 сеанси) із подальшим повторенням курсів. Масаж передміхурової залози зазвичай не рекомендований при калькульозному простатиті, однак в окремих випадках обережне виконання цієї процедури виявляється єдиним методом, що полегшує стан пацієнта.
Хірургічні методики в більшості випадків є терапією відчаю, хоча деякі лікарі рекомендують саме трансуретральне видалення каменів, що зберігає статеву функцію в молодих чоловіків і сприяє лікуванню ДГПЗ у літніх пацієнтів. У дослідженні A. Toth et al. (2018) доведено ефективність ін’єкційної терапії, що передбачала введення сумішей літичних препаратів, антибіотиків, протитрихомонадних засобів і препарату трилону Б. Крім того, поширеним методом лікування ХП є введення ботулотоксину в м’язи промежини або у передміхурову залозу, що чинить антиспастичний і знеболювальний ефекти.
 Доповідь «Роль антихолінергічного навантаження у розвитку декомпенсації сечового міхура» представив асистент кафедри урології із судовою медициною Полтавського державного медичного університету Роман Борисович Савченко (співавт. Саричев Л.П., Саричев Я.В., Пустовойт Г.Л.).
Доповідь «Роль антихолінергічного навантаження у розвитку декомпенсації сечового міхура» представив асистент кафедри урології із судовою медициною Полтавського державного медичного університету Роман Борисович Савченко (співавт. Саричев Л.П., Саричев Я.В., Пустовойт Г.Л.).
Завдяки еволюції лікувальної тактики за останні 30 років оперативні втручання були проведені не більш ніж 10-15% пацієнтам із ДГПЗ (Gravas S., Cornu J.N., Gacci M., 2020). Включення до арсеналу медиків антихолінергічних препаратів покращило якість життя у хворих на ДГПЗ (Burkhard F.C. et al., 2020). Водночас в осіб, які приймали препарати з високопотенційною антихолінергічною активністю (толтеродин, оксибутинін, соліфенацин), виявлено збільшення об’єму залишкової сечі та зниження швидкості сечовипускання (De La Cruz J.F. et al., 2015).
Антихолінергічне навантаження (АХН) – це сумарна дія кількох препаратів із різним ступенем антихолінергічної активності (Durán C.E. et al., 2013; Nishtala P.S. et al., 2016). АХН може виникати й при передозуванні антихолінергічними препаратами, і внаслідок патологічної реакції на терапевтичні дози (Rémillard A.J., 1996). АХН є поширеним явищем в осіб віком >65 років, оскільки вони часто приймають антихолінергічні засоби.
Метою представленого доповідачем дослідження було вивчення ролі АХН у розвитку декомпенсації сечового міхура при ДГПЗ. Авторами був обстежений 381 пацієнт із ДГПЗ після оперативного втручання у стадії субкомпенсації (232 особи) і декомпенсації (149 осіб) сечового міхура, що приймали або не приймали антихолінергічні препарати. Серед осіб, яким застосовували антихолінергічні засоби, бали за Міжнародною шкалою оцінки простатичних симптомів (IPSS) і рівень якості життя виявилися вищими, ніж у пацієнтів, які не приймали таких препаратів. Проте у першої групи пацієнтів відзначався більший об’єм залишкової сечі порівняно з другою групою (на 57,8% у групі субкомпенсації й на 81% у групі декомпенсації).
За результатами дослідження у групах встановлено сильний кореляційний зв’язок між наступними показниками:
- об’єм залишкової сечі до операції та кількість балів за шкалою IPSS через 6 міс після неї (прямий зв’язок);
- об’єм залишкової сечі до операції та рівень якості життя через 6 міс після неї (прямий зв’язок);
- об’єм залишкової сечі до операції та швидкість сечовипускання через 6 міс після неї (зворотний зв’язок, який виявлено у групі декомпенсації).
Отже, дослідники довели, що М-холінолітики зменшують прояви гіперактивного сечового міхура й покращують якість життя у пацієнтів із ДГПЗ, однак антихолінергічне навантаження сприяє декомпенсації міхура й погіршує результати оперативного втручання. Збільшення об’єму залишкової сечі при ДГПЗ виступає предиктором декомпенсації сечового міхура.
Підготувала Анна Сакалош