Язвенный колит: что нового в терминологии, диагностике и лечении?
Автори:
И.Э. Кушнир

Проблема воспалительных заболеваний кишечника (ВЗК) находится в центре внимания мирового научного медицинского сообщества. До настоящего времени четко не установлены этиологические факторы, влияющие на развитие и прогрессирование наиболее часто встречающихся ВЗК – язвенного колита (ЯК) и болезни Крона (БК), отсутствуют эффективные медикаментозные препараты, способные обеспечить глубокую и стойкую ремиссию заболеваний и предупредить развитие осложнений. Продолжается активный поиск надежных диагностических маркеров ВЗК, а также новых молекул для патогенетической терапии данных заболеваний.
В октябре 2016 г. Европейским обществом по изучению болезни Крона и язвенного колита (ЕССО) был принят третий Европейский доказательный консенсус по диагностике и лечению язвенного колита (Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis).
Согласно определению данного Консенсуса, ЯК является хроническим воспалительным заболеванием, которое вызывает постоянное воспаление слизистой оболочки толстой кишки, как правило, без гранулем при биопсии. ЯК поражает прямую кишку и в различной степени ободочную кишку в непрерывном режиме и характеризуется рецидивирующим и прогрессирующим течением. По распространенности поражения различают:
· Е 1 – язвенный проктит – поражение ограниченно областью прямой кишки (т.е. проксимальная граница поражения расположена дистальнее ректосигмоидного перехода);
· Е 2 – левосторонний колит – поражение ограниченно частью толстой кишки, расположенной дистальнее селезеночного угла (аналогичный «дистальному» колиту);
· Е 3 – распространенный колит – поражение распространяется проксимальнее селезеночного угла, вплоть до панколита.
Для определения степени тяжести ЯК рекомендуется использовать модифицированную классификацию Truelove and Witts, согласно которой тяжесть клинического течения заболевания оценивается по клинико-лабораторным показателям (табл. 1). Эта классификация по-прежнему считается золотым стандартом для быстрой идентификации амбулаторных больных, а также пациентов с тяжелой атакой ЯК, нуждающихся в немедленной госпитализации и проведении интенсивной терапии.
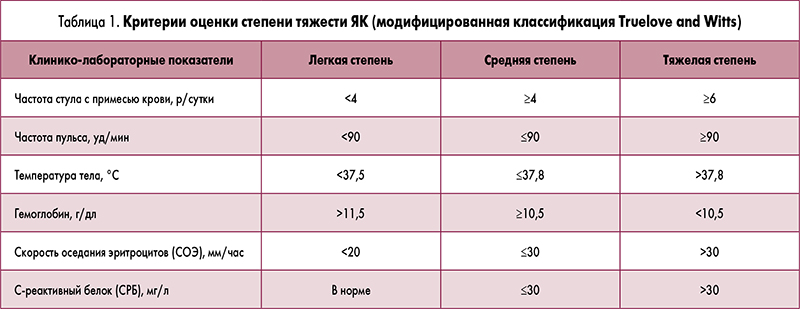
В соответствии с Консенсусом ЕССО и Монреальской классификацией раличают: ремиссию ЯК (S0) и активную фазу заболевания (S1 – легкой, S2 – умеренной и S3 – выраженной степени активности) (табл. 2). Ремиссия определяется как полное отсутствие клинических симптомов (частота стула ≤3 р/сутки без кровотечения) без выявления каких-либо изменений слизистой оболочки при эндоскопии. Отсутствие острого воспалительного инфильтрата, по данным гистологического исследования биоптата слизистой оболочки толстой кишки, является предиктором благоприятного течения заболевания.
Диагностика ЯК
Диагностика ЯК основывается на анализе: совокупности жалоб пациента с подробным расспросом о частоте стула, его консистенции, наличии крови в кале, императивных позывов, ночных дефекаций; анамнестических данных с оценкой перенесенных инфекционных заболеваний, с учетом недавних путешествий, приема лекарственных препаратов, включающих антибиотики, нестероидные противовоспалительные средства, семейной истории воспалительного заболевания кишечника или колоректального рака, привычки курения, а также апендицита в анамнезе. Аппендэктомия, произведенная до наступления взрослого возраста, а также курение могут способствовать уменьшению риска и степени тяжести ЯК, в то время как отказ от курения может предрасполагать к развитию заболевания.
Выраженность симптомов ЯК зависит от степени активности и тяжести течения заболевания. Они включают: кровавый понос, ректальное кровотечение, тенезмы, императивные позывы к дефекации и недержание кала. Пациенты часто жалуются на слабость, повышенную утомляемость и дефекации в ночное время. Увеличение частоты дефекаций, появление боли в животе, потеря аппетита и лихорадка являются признаками тяжелой атаки ЯК. Часто ЯК сопровождается внекишечными проявлениями (системными осложнениями) в виде поражения суставов, кожных покровов, глаз, гепатобилиарной системы, слизистой оболочки ротовой полости. Развитие внекишечных проявлений обусловлено транслокацией из просвета кишки чужеродных, в том числе токсических бактериальных агентов, и активацией иммунных механизмов.
Лабораторная диагностика
Лабораторная диагностика ЯК должна включать развернутый анализ крови, печеночные пробы, определение уровня: мочевины и креатинина плазмы крови, электролитов, витамина D, содержание сывороточного железа, CРБ, а также фекальный кальпротектин. При легкой и умеренной степени тяжести ЯК, как правило, не наблюдается существенных отклонений лабораторных маркеров хронического воспаления от нормальных значений. В клиническом анализе крови могут обнаруживаться признаки анемии и тромбоцитоз как следствие тяжелой и хронической активной воспалительной реакции, повышение количества лейкоцитов и СОЭ, что указывает на тяжесть поражения и возможность инфекционных осложнений. СРБ является объективным критерием оценки тяжести ЯК и фактором, определяющим его исход. У пациентов, получающих парентеральные стероиды, повышенный уровень СРБ >45 мг/л через 48-72 ч после госпитализации в связи с тяжелым колитом и частота стула 3-8 раз в сутки свидетельствуют о высокой вероятности колэктомии. У больных с тотальным колитом через год после начала заболевания уровень СРБ >10 мг/л прогнозирует высокий риск хирургического вмешательства.
Фекальный кальпротектин имеет значение для диагностики и оценки тяжести данного заболевания. В исследованиях продемонстрирована высокая корреляция уровня данного маркера с индексами эндоскопической активности, развитием рецидива заболевания, ответом на лечение. Фекальный кальпротектин может быть использован в качестве предиктора рецидива у пациентов с неактивным ВЗК. Повышение уровня кальпротектина вдвое связано с повышенным риском рецидива (относительный риск (ОР) 2,01; 95% доверительный интервал (ДИ) 1,52-2,65).
Для исключения инфекционной диареи рекомендуется проведение микробиологического исследования образцов кала на наличие токсина Clostridium difficile, амебиаза, сальмонеллеза, шигеллеза, иерсиниоза, лямблиоза, глистной инвазии. При рецидивирующем или рефрактерном к терапии течении ЯК показано определение токсинов А и В Clostridium difficilе в кале и ДНК цитомегаловируса (ЦМВ) методом полимеразной цепной реакции (ПЦР).
Активное изучение молекулярно-генетических аспектов ЯК позволило идентифицировать более 160 подтвержденных генетических полиморфизмов, ассоциированных с предрасположенностью к ЯК. Доказана связь развития заболевания с дефектами системы главного комплекса гистосовместимости (HLA). Также показана ассоциация – рецептора гена IL23R интерлейкина‑23, расположенного на хромосоме 1, гена DLG5 на хромосоме 10, дефектов сигнального пути янус-киназ/синального трансдуктора и активатора транскрипции белка (JAK-STAT), генов множественной лекарственной резистентности (MDR) и Toll-подобного рецептора (TLR) – с ЯК. Недавно были идентифицированы множественные локусы восприимчивости к ЯК, один из которых был в 7q22 и 22q13 интерлейкин‑17 Е-подобного рецептора (IL17REL). Так как ЯК является сложной многофакторной патологией, наличия мутаций в этих генах недостаточно, чтобы вызвать заболевание, и, с другой стороны, отсутствие болезнь-ассоциированных полиморфизмов не гарантирует от его развития. Поэтому использование в клинической практике генетического типирования в диагностических целях не рекомендуется.
Среди серологических биомаркеров ЯК наиболее изученными являются перинуклеарные антинейтрофильные цитоплазматические антитела (p-ANCA) и антитела к Saccharomyces cerevisiae (ASCA). Количество больных с ЯК, у которых обнаруживаются p-ANCA, достигает 65%. Позитивный p-ANCA и негативный ASCA тесты предполагают наличие ЯК. В целом, определение серологических маркеров продемонстрировало высокую точность в дифференциальной диагностике ЯК и БК, однако их чувствительность недостаточно висока, поэтому использовать их нецелесообразно.
В качестве дополнительных методов лабораторной диагностики у пациентов с ЯК необходимо использовать тесты на наличие маркеров вирусных (гепатит В и С, ВИЧ, ЦМВ, Эпштейна-Барр, простого герпеса), грибковых и паразитарных агентов, а также латентного туберкулеза с помощью комплексного анализа истории болезни пациента, рентгенографии грудной клетки и туберкулиновой пробы, поскольку назначение иммуносупрессивной и биологической терапии способствует реактивации оппортунистических вирусных и бактериальных инфекций.
Обязательной процедурой для установления диагноза ЯК и решения вопроса о проведении колэктомии в случае стероидозависимости или стероидорезистентности является эндоскопическое исследование – тотальная колоноскопия с илеоскопией. Для ЯК характерны такие эндоскопические признаки, как непрерывное воспаление, ограниченное слизистой оболочкой, с обязательным вовлечением прямой кишки с последующим проксимальным распространением и наличием четкой демаркации воспаления. К показателям, отражающим степень тяжести ЯК по визуальной оценке толстой кишки, относятся рыхлость слизистой и ее контактная кровоточивость, размытость или отсутствие сосудистого рисунка, а также наличие или отсутствие эрозий и изъязвлений. Для оценки тяжести ЯК по эндоскопическим признакам используется шкала UCEIS. Конечная оценка UCEIS представляет собой сумму всех трех оцениваемых показателей в наиболее пораженной области толстой кишки, видимой при сигмоидоскопии. Эндоскопическими признаками слабого воспаления являются эритема, зернистость слизистой и мелкоточечные кровоизлияния и по крайней мере частичная потеря видимого сосудистого рисунка. Умеренно активный колит характеризуется полной потерей сосудистого рисунка, наличием эрозий, сливных геморрагий, фибринозного налета на стенках и ранимостью слизистых (появлением кровоточивости при легком прикосновении эндоскопа). Для тяжелого колита характерны спонтанные кровотечения и наличие изъязвлений слизистой, слизи и гноя в просвете кишки. Следует отметить, что визуальная оценка изменений слизистой при колоноскопии может недооценивать степень распространенности заболевания по сравнению с гистологическим исследованием, а биопсия необходима для определения степени воспаления толстой кишки, обеспечивая прогностическую информацию и стратификацию риска для контроля за дисплазией. У 20-50% взрослых пациентов с ЯК возможно проксимальное распространение проктита и левостороннего колита.
Биопсия слизистой оболочки толстой кишки проводится при первичной постановке диагноза; сомнениях в правильности ранее установленного диагноза; длительном (более 7-10 лет) анамнезе ЯК (в этом случае проводится ступенчатая биопсия – из каждого отдела толстой кишки – для исключения дисплазии эпителия). Известно, что пациенты с панколитом и левосторонним колитом по мере увеличения длительности заболевания имеют наиболее высокий риск развития рака толстой кишки, в то время как у больных с проктитом риск злокачественной трансформации минимален. Следовательно, пациенты с левосторонним и распространенным колитом нуждаются в эндоскопическом наблюдении с проведением гистологического исследования биоптатов, в то время как больным с язвенным проктитом эндоскопический мониторинг не показан. Гистологическими признаками ЯК являются диффузное нарушение строения собственной пластинки слизистой и крипт, атрофия слизистой, крипт и ворсинок, уменьшение бокаловидных клеток, наличие криптитов и крипт-абсцессов, базальный плазмоцитоз, уменьшение степени воспалительной инфильтрации от прямой кишки в проксимальном направлении.
Особенности лечения ЯК
Выбор терапевтической стратегии и пути введения лекарственных препаратов зависит от распространенности поражения толстой кишки и его локализации, степени тяжести заболевания, наличия внекишечных проявлений, длительности анамнеза, эффективности и безопасности ранее проводимой терапии, а также риска развития осложнений ЯК.
Так, местное лечение в виде суппозиториев и клизм является терапией первой линии при язвенном проктите и левостороннем колите, в то время как комбинированное лечение с использованием препаратов для перорального приема в сочетании с ректальными формами предпочтительно при распространенном колите.
Тактика лечения ЯК зависит от локализации воспалительного процесса и степени тяжести заболевания
Язвенный проктит минимальной и умеренной активности
В качестве препарата для стартовой терапии дистального ЯК предпочтительным является назначение производных 5-аминосалициловой кислоты (5-АСК) – месалазина в виде ректальных свечей в дозе 1г /сут. Месалазин в виде пены или микроклизмы является альтернативой, но суппозитории способны обеспечить более эффективную таргетную доставку лекарственного средства непосредственно к месту воспаления и лучше переносятся пациентами. При недостаточной эффективности монотерапии 5-АСК целесообразна комбинация суппозиториев месалазина с пероральным приемом препарата в виде гранул либо местной терапией стероидами (беклометазона дипропионат 3 мг или будесонид 2 г) в виде ректальных клизм или пены. Два метаанализа показали, что местная терапия 5-АСК является более эффективной, чем местная терапия стероидами для индукции клинико-эндоскопической и гистологической ремиссии. Следовательно, топические стероиды следует назначать пациентам с неадекватным ответом или непереносимостью 5-АСК.
Для лечения рефрактерного проктита используются системные стероиды, иммунодепрессанты и/или биологические препараты.
Левосторонний колит минимальной и умеренной активности
В этом случае оптимальной является комбинированная терапия месалазином в виде ректальных клизм в дозе ≥1 г в 1 р/сут в сочетании с пероральным месалазином ≥2,4 г 1 р/сут. Однократный пероральный прием суточной дозы месалазина в гранулах одинаково эффективен и при режиме дозирования несколько раз в сутки. Монотерапия является менее эффективной. Топический месалазин обладает большей клинической активностью в сравнении со стероидами для местного применения.
В случае отсутствия эффекта от применения месалазина показана терапия системными кортикостероидами (КС). Если симптомы пациента ухудшаются, ректальное кровотечение сохраняется в течение 10-14 дней или устойчивое облегчение всех симптомов не было достигнуто после 40 дней соответствующей терапии 5-ASК, следует начать дополнительную терапию пероральными системными стероидами. Пероральная форма беклометазона дипропионата в дозе 5 мг 1 р/сут имеет аналогичную эффективность и профиль безопасности, как и у преднизолона, у пациентов с активным ЯК минимальной и умеренной активности. Топические стероиды не используются для лечения ЯК, поскольку классический будесонид показал свою неэффективность. Уникальная технология формы выпуска препарата в виде мультиматричной молекулы (будесонид ММХ) при пероральном приеме капсулы обеспечивает равномерное распределение действующего вещества по всей длине толстой кишки. Будесонид MMX в дозе 9 мг 1 р/сут может использоваться у пациентов с непереносимостью или резистентностью к аминосалицилатам.
ЯК минимальной и умеренной активности
Схемы лечения распространенного ЯК минимальной и умеренной активности аналогичны таковым при левостороннем гемиколите. Назначаются 5-АСК в дозе ≥2,4 г 1 р/сут перорально с дополнительным ректальным введением микроклизм месалазина в дозе 1 г 1р/сут. Вся суточная доза орального месалазина может быть принята в один прием. Такой режим так же эффективен, как и кратный прием препарата. Системные КС показаны пациентам с распространенным ЯК умеренной и выраженной активности, а также с минимальной активностью ЯК и нулевым ответом на терапию месалазином. Будесонид не продемонстрировал преимуществ в сравнении с плацебо для достижения клинической ремиссии у больных с тотальным колитом. В исследованиях эффективности терапии препаратом нового поколения будесонид ММХ (в дозе 9 мг 1 р/сут) также не удалось продемонстрировать преимущества по сравнению с плацебо при распространенном колите легкой и умеренной степени тяжести, в отличие от значительной эффективности такой терапии при левостороннем колите.
Левосторонний и распространенный ЯК высокой активности является показанием для госпитализации для проведения интенсивной терапии.
Существует ряд доказательств терапевтического эффекта пробиотиков при добавлении к стандартной терапии для индукции ремиссии ЯК. Обсуждается роль трансплантации фекальной микрофлоры. В общей сложности 81 пациенту было проведено процедуру фекальной трансплантации от нескольких доноров или клизмы с плацебо, 5 дней в неделю в течение 8 недель. Клинико-эндоскопическая ремиссия без назначения стероидов была достигнута у 27% пациентов на 8-й неделе по сравнению с 8% в группе плацебо (р=0,02). Открытые перекрестные исследования подтвердили эти выводы. Полученные результаты обнадеживают и свидетельствуют в пользу концепции использования фекальной трансплантации для индукции ремиссии при активном ЯК. Для оптимизации эффективности и обеспечения безопасности необходимы дальнейшие исследования для стандартизации протокола лечения.
Одним из патогенетических факторов увеличения проницаемости слизистого барьера толстой кишки при ЯК является нарушение барьерных механизмов кишечной слизи, связанное со снижением уровня фосфатидилхолина. В рандомизированном исследовании была проведена оценка безопасности и эффективности кишечнорастворимых гранул фосфатидилхолина, которые содержат по меньшей мере 94% действующего вещества. В это исследование были включены 175 пациентов с 5-АСК-резистентным ЯК с левосторонним или тотальным колитом. Все больные были рандомизированы на четыре группы: одна принимала плацебо и три – различные дозы гранул фосфатидилхолина. Полученные результаты не продемонстрировали достоверных различий в достижении клинической и эндоскопической ремиссии между группой плацебо и объединенными группами пациентов, принимавшими фосфатидилхолин, в то время как различия показателей гистологической ремисии были статистически значимыми (20 и 40,5% соответственно; р=0,016).
Андрографис метельчатый (Andrographis paniculata) является растительным лекарственным средством с ингибирующей активностью в отношении фактора некроза опухоли (ФНО), интерлейкина‑1β (ИЛ‑1β) и ядерного фактора каппа-B. Рандомизированное клиническое испытание (РКИ) оценки его безопасности и эффективности в лечении 224 пациентов с легким и умеренно активным ЯК продемонстрировало улучшение клинической симптоматики и эндоскопическое заживление на 8-й неделе у пациентов, получавших 1800 мг Andrographis paniculata, по сравнению с плацебо (р=0,0183 и р=0,0404 соответственно).
В другом РКИ изучалась эффективность агониста TLR‑9 для ректального введения у 131 пациента с активным ЯК, рандомизированных на 2 группы – экспериментальную и плацебо. Первичной конечной точки, которой являлась ремиссия на 12-й неделе, достигли 44,4 и 46,5% пациентов соответственно. Тем не менее доля пациентов, у которых были достигнуты клиническая ремиссия и уменьшение эндоскопической активности, а также ремиссия на 4-й неделе, была значительно выше в группе пациентов, получавших TLR‑9 агонист.
Интерферон-γ-индуцируемый белок‑10 (IP‑10) регулирует хоуминг иммунных клеток в очаг воспаления в толстой кишке и снижает выживаемость эпителиальных клеток кишечника. В экспериментах на животных моделях ЯК блокада IP‑10 повышала выживаемость клеток крипт и уменьшала активность воспаления. РКИ оценило безопасность и эффективность моноклональных антител против IP‑10 у 252 пациентов с ЯК. Достоверных отличий в достижении ремиссии между экспериментальной группой и группой плацебо не наблюдалось. Однако тенденция к более высокой скорости достижения ремиссии и клинического ответа наблюдалась у пациентов, рандомизированных для применения моноклональных антител, особенно у анти-ФНО-наивных пациентов.
Внутривенные стероиды рекомендованы как терапия первой линии ЯК выраженной активности. Монотерапия с внутривенным введением циклоспорина является альтернативой, особенно в случае серьезных побочных эффектов, вызванных гормональными препаратами. Интенсивная терапия должна обеспечить всех пациентов достаточным объемом внутривенных плазмозаменителей и электролитов для коррекции и предотвращения обезвоживания и электролитного дисбаланса. Гипокалиемия или гипомагниемия может способствовать развитию токсической дилатации толстой кишки, поэтому необходимым является проведение заместительной терапии препаратами калия в дозе не менее 60 ммоль/день. Показано профилактическое подкожное введение низкомолекулярного гепарина для уменьшения риска тромбоэмболии, который увеличивается у пациентов с ВЗК, особенно во время обострения заболевания (но не связаного с другими факторами риска тромбоэмболических осложнений). Важное значение имеет обеспечение нутритивной поддержки, а также питательная поддержка, если пациент истощен. При остром колите энтеральное питание является наиболее приемлемым и связано с меньшим количеством осложнений, чем парентеральное. Обязательной является отмена антихолинергических, антидиарейных, нестероидных противовоспалительных и опиоидных препаратов, которые могут вызвать развитие токсического мегаколона. Показана топическая терапия 5-АСK и КС в случае их переносимости. Необходимо переливание крови, чтобы поддерживать уровень гемоглобина выше 80-100 г/л. Антибиотикотерапия рекомендована только в случае присоединения инфекции или непосредственно перед операцией. Контролируемые испытания орального или внутривенного метронидазола, тобрамицина, ципрофлоксацина или ванкомицина при остром ЯК не показали их преимуществ в дополнение к обычной терапии.
Поскольку инфекция, ассоциированная Clostridium difficile, является наиболее распространенной у больных с тяжелым ЯК и связана с повышенной заболеваемостью и смертностью, показано проведение анализа культуры кала на токсин Clostridium difficile. В случае его обнаружения рекомендовано лечение ванкомицином. Рассматривается также фекальная трасплантация. Иммуносупрессивная терапия должна быть, по возможности, прекращена.
С целью подтверждения диагноза и исключения ЦМВ-инфекции, которая связана со стероидорезистентным течением ЯК и требует соответствующего лечения, показано проведение гибкой ректороманоскопии без предварительной подготовки с биопсией. Ведение больного должен осуществлять гастроэнтеролог совместно с колоректальным хирургом.
В качестве альтернативной терапии в случае гормонорезистентной и/или гормонозависимой формы ЯК используются иммуносупрессоры. Благодаря их использованию у 60-70% гормонозависимых пациентов удается снизить дозу стероидов вплоть до полной отмены. Суточная доза азатиоприна составляет 1,5-2,5 мг/кг. Терапевтический эффект препарата следует ожидать через 3-4 мес от начала приема. Эффективность азатиоприна в достижении ремиссии составляет 60-80%.
При тяжелых формах ЯК, резистентных к стандартной терапии, доказанной эффективностью обладает циклопорин А в дозе 4 мг/кг/сут. По данным L. Sharkey и соавт. (2011), применение циклоспорина в ряде случаев позволит избежать колэктомии у больных с рефрактерной формой ЯК.
Систематический обзор двух рандомизированных плацебо-контролируемых исследований эффективности метотрексата не продемонстрировал преимуществ препарата в индукции ремиссии ЯК по сравнению с плацебо, 6-меркаптопурином и 5-АСК. В настоящее время отсутствуют убедительные доказательства, подтверждающие эффективность использования метотрексата для индукции ремиссии заболевания. Исследование, в котором большее число пациентов получают более высокую дозу метотрексата перорально, требует дополнительных доказательств. В настоящее время проводятся два масштабных плацебо-контролируемых исследования (METEOR и MERIT-UC) для оценки эффективности и безопасности внутримышечного или подкожного введения метотрексата у пациентов с активным ЯК. Их результаты, возможно, предоставят доказательства, подтверждающие значение метотрексата в достижении ремиссии заболевания.
Что касается способности поддержания стойкой клинической ремиссии, иммуносупрессивные агенты, в том числе азатиоприн, 6-меркаптопурин и метотрексат, играют ограниченную роль у больных со среднетяжелой и тяжелой формой ЯК (Тиммер, 2012; Эль-Matary, 2009).
В последние годы активно изучается эффективность новых иммуносупрессоров (микофенолат мофетил, такролимус) для индукции ремиссии рефрактерных колитов. Механизм действия микофенолата мофетила заключается в селективном подавлении фермента инозинмонофосфатдегидрогеназы, ответственной за биосинтез пуриновых оснований. Препарат оказывает выраженный цитостатический эффект на лимфоциты, подавляет их пролиферацию в ответ как на митогенную, так и на аллоспецифическую стимуляцию, угнетает образование антител B-лимфоцитами, уменьшает миграцию лимфоцитов в очаги воспаления, блокирует воздействие мононуклеаров на синтез ДНК и пролиферацию. По данным T. Tan (2009), микофенолат мофетил продемонстрировал высокую эффективность при ВЗК, сопоставимую с азатиоприном, а также возможность его применения у больных с наличием противопоказаний или непереносимостью азатиорина.
Такролимус, относящийся к антибиотикам класса макролидов, является высокоактивным иммуносупрессивным веществом, угнетающим формирование цитотоксических лимфоцитов, которые, в основном, отвечают за отторжение трансплантата, снижают активацию Т-клеток, зависимую от Т-хелперов пролиферацию β-клеток, а также формирование лимфокинов (таких как интерлейкины‑2, -3 и γ- интерферон), экспрессию рецептора интерлейкина‑2. Комплекс, образующийся в результате связывания такролимуса с цитоплазматическим рецептором FK-связывающим белком, ингибирует кальциневрин и тем самым косвенно ингибирует образование цитокинов.
Азатиоприн и 6-меркаптопурин часто используются в сочетании с антагонистами ФНО в случае тяжелых атак ЯК, а также у больных, резистентных к терапии стероидами. Использование антагонистов ФНО связано с повышенным риском развития лимфомы и немеланомного рака кожи у пациентов с ВЗК.
Моноклональные антитела к ФНО, такие как инфликсимаб, голимумаб, Цертолизумаб пегол и адалимумаб, продемонстрировали высокую эффективность в достижении и поддержании ремиссии ЯК. Однако лечение биологическими препаратами связано с развитием серьезных побочных явлений (SAES) с активацией оппортунистической инфекции и гиперчувствительностью (Ford, 2013).
Другой класс биологических препаратов, так называемых селективных ингибиторов молекул адгезии, также изучался в лечении пациентов с ВЗК. В пилотном исследовании получены позитивные результаты однократной инфузии натализумаба, представляющего собой гуманизированные антитела к интегрину-α4, в дозе 3мг/кг больным с высокой активностью ЯК. Наблюдалось значительное снижение индекса активности заболевания на 2 и 4-й неделе после инфузии по сравнению с исходным. У половины больных ко 2-й неделе был достигнут хороший клинический ответ. Средний уровень СРБ через 2 недели после инфузии (6 мг/л) был ниже, чем до лечения (16 мг/л). Cуществуют доказательства того, что натализумаб является эффективным для индукции и поддержания ремиссии при БК (Ghosh, 2003; MacDonald, 2007; Sandborn, 2005; Targan, 2007).
В то же время в процессе клинических испытаний использование натализумаба было связано с рядом серьезных нежелательных эффектов, в том числе с развитием прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) – быстро прогрессирующего демиелинизирующего инфекционного заболевания центральной нервной системы с асимметричным поражением мозга, приводящего к летальным исходам. ПМЛ вызывает активация полиомавируса 2. Носителями данного вируса являются около 80% населения. Реактивация вируса и развитие заболевания происходит только в том случае, когда значительно скомпрометирована иммунная система. В подавляющем большинстве случаев ПМЛ является проявлением синдрома приобретенного иммунодефицита, в остальных случаях развивается после медикаментозной иммуносупрессии. Заболевание проявляется прогрессирующими психическими нарушениями, сопровождающимися очаговыми неврологическими симптомами – моно- или гемипарезами, нарушениями речи, зрения, эпилептическими приступами. Развитие ПМЛ в 1/1000 случаев у пациентов, получивших лечение, привело к ограничению его клинического применения и поиску других препаратов с лучшим профилем безопасности (Bloomgren, 2012).
К таким препаратам можно отнести ведолизумаб – гуманизированное моноклональное антитело, разработанное для избирательного управления миграцией лимфоцитов в кишечнике, в отличие от натализумаба, который блокирует миграцию лимфоцитов в различных органах, включая кишечник, почки, костный и головной мозг (Bickston, 2010). В то время как натализумаб ингибирует как интегрины-α4β1 и -α4β7, ведолизумаб является селективным блокатором интегрина-α4β7, за счет чего предотвращает блокаду лимфоцитов в центральной нервной системе и позволяет избежать риска развития ПМЛ. Данные рандомизированных контролируемых испытаний показывают, что ведолизумаб эффективен для индукции и поддержания ремиссии ЯК.
В частности, в исследовании GEMINI I изучена эффективность и безопасность ведолизумаба для поддержания клинического ответа и ремиссии в течение 52 недель у пациентов с ЯК умеренной и тяжелой степени активности, у которых не был получен ответ хотя бы на одну из предшествующих схем терапии. Критериями включения в исследование был тяжелый и средней степени тяжести ЯК, с оценкой активности, по Mayo, ≥6 и эндоскопическим индексом ≥2, на фоне приема КС, пуриновых антиметаболитов и/или ФНО антагонистов. После 2 индукционных доз ведолизумаба 373 пациента, у которых был получен клинический ответ, были рандомизированы на группы: 1-я получала ведолизумаб 300 мг внутривенно каждые 4 недели, 2-я группа – 300 мг внутривенно каждые 8 недель (2 группа) и 3-я группа – плацебо в течение 46 недель.
Первичной конечной точкой была клиническая ремиссия, определяемая по величине индекса Mayo ≤2 баллов на 52-й неделе. Вторичная конечная точка исследования включала продолжительность клинической и эндоскопической ремиссии на 52-й неделе без приема КС.
В результате исследования, независимо от кратности введения ведолизумаба, у 41,8% пациентов 1-й группы и 45% пациентов 2-й группы была достигнута клиническая ремиссия, в то время как в группе плацебо лишь у 16% удалось достичь улучшения (p<0,001). Продолжительность клинического ответа, оцениваемого на 6-й и 52-й неделе в обеих группах пациентов, принимавших ведолизумаб, достоверно (p<0,001) превышала соответствующие показатели в группе контроля (56,6 и 52,0% против 23,8% соответственно). Эндоскопическая ремиссия к 52-й неделе исследования была достигнута более чем у половины больных обоих групп, принимавших ведолизумаб, в отличие от группы плацебо, в которой заживление слизистой оболочки кишечника отмечалось менее чем у 20% больных. Стероид-независимая ремиссия в течение года сохранялась у 45,2% больных 1-й группы и 31,4% 2-й группы, в то время как в группе плацебо лишь у 13,7% пациентов. Показатели клинической ремиссии и продолжительности клинического ответа также были выше в группе ведолизумаба по сравнению с группой плацебо, независимо от того, получали ли они предшествующую терапию анти-ФНО препаратами.
Ведолизумаб обладает высоким профилем безопасности, сопоставимой с плацебо в отношении риска любого неблагоприятного события (ОР 0,99; 95% ДИ 0,93-1,07) или серьезных побочных эффектов (ОР 1,01; 95% ДИ 0,72-1,42). По данным систематического обзора, в 2 исследованиях, включавших 941 больного, была обнаружена статистически значимая разница в досрочном прекращении участия пациентов в исследовании из-за неблагоприятных событий. Шесть процентов больных, получавших ведолизумаб, досрочно выбыли из исследований по причине неблагоприятных событий по сравнению с 11% пациентов, получавших плацебо (ОР 0,55; 95% ДИ 0,35-0,87). К побочным эффектам, о которых сообщалось во всех исследованиях, относились: ухудшение течения ЯК, головная боль, назофарингит, инфекции верхних дыхательных путей, тошнота и боли в животе.
В настоящее время завершена II фаза клинических испытаний нового биологического препарата Натура-альфа – селективного ингибитора сигнальных молекул транскрипции 3 (STAT3). Рандомизированное двойное слепое плацебо-контролируемое исследование было проведено в 10 центрах США, в котором 70 пациентов, соответствующих критериям умеренной и тяжелой степени ЯК с индексом активности Mayo ≥6, были случайным образом распределены в группу плацебо или 2 группы, получающие разные дозы препарата (по 10 мг/сут и 20 мг/сут). Достоверно доказано преимущество Натура-альфа в достижении клинического улучшения и индукции ремиссии перед плацебо. В двух группах больных, получавших активный препарат, доля пациентов, у которых был достигнут ответ на лечение, превышала 85% в сравнении с результатами в группе плацебо, составившими 36%. Не было выявлено межгрупповых различий с точки зрения безопасности. Частота побочных эффектов STAT3-ингибитора была сопоставима с плацебо. Ни одного случая серьезных нежелательных эффектов, связанных с приемом Натура-альфа, зарегистрировано не было.
Новый класс биологических препаратов, разработанный на основе тофацитиниба, относится к ингибиторам янус-киназы. В двух плацебо-контролируемых исследованиях III фазы (OCTAVE – Oral Clinical Trials for tofAcitinib in ulceratiVE colitis – клинические исследования перорального применения тофацитиниба при ЯК) оценивалась индукция ремиссии при пероральном приеме тофацитиниба в дозировке 10 мг 2 р/день у взрослых пациентов с умеренным и тяжелым ЯК. Всего 598 пациентов в исследовании OCTAVE Induction I и 541 пациент в исследовании OCTAVE Induction II методом случайной выборки были рандомизированы в две группы: получающих тофацитиниб в дозировке 10 мг 2 р/день и плацебо.
Оба исследования достигли первичных конечных точек, оцениваемых по доле пациентов, получающих тофацитиниб и находящихся в стадии ремиссии на 8-й неделе, по сравнению с пациентами, принимающими плацебо. В настоящее время завершилось многоцентровое рандомизированное плацебо-контролируемое исследование III фазы – OCTAVE Sustain, целью которого является изучение эффективности тофацитиниба в поддержании ремиссии ЯК. В исследовании OCTAVE Sustain частота серьезных инфекций была одинаковой во всех трех группах лечения, а частота общей инфекции и инфекции, вызванной Herpes zoster, была выше в группе тофацитиниба, чем в группе плацебо. Во всех трех исследованиях у 5 пациентов, получавших тофацитиниб, и у одного, получавшего плацебо, был выявлен немеланомный рак кожи, а у 5 пациентов, принимавших тофацитиниб, и у тех, кто принимал плацебо, отмечались кардиоваскулярные побочные эффекты. По сравнению с плацебо, тофацитиниб был связан с повышенным уровнем липидов. На основании результатов исследования сделан вывод о том, что у пациентов с умеренно выраженным ЯК тофацитиниб был более эффективным в качестве индукционной и поддерживающей терапии, чем плацебо.
Еще одно недавно проведенное РКИ с использованием ozanimod (модулятора подтипов рецепторов сфингозин‑1-фосфат 1 и 5) показало, что 16% пациентов, которые получали ozanimod в дозировке 1 мг/сут, и 6% больных, получавших плацебо, достигли клинической ремиссии на 8-й неделе (р=0,048). Необходимы масштабные исследования для изучения эффективности и безопасности ozanimod в лечении ЯК умеренной и выраженной степени тяжести.
Поддержание ремиссии
Производные месалазина являются препаратами первой линии для поддерживающей терапии у пациентов с хорошим клиническим ответом на месалазин или стероиды (пероральные или ректальные). Эффективная доза месалазина при пероральном приеме для поддержания ремиссии составляет 2 г/сут. Для ректального лечения поддерживающая доза составляет 3 г в неделю. Азатиоприн в дозе 2,5 мг/кг массы тела рекомендован для терапии: у пациентов с легкой и умеренной активностью заболевания, с ранними или частыми рецидивами при приеме мезаламина в оптимальной дозе или непереносимостью мезалазина; у стероидзависимых пациентов. Пациентам, у которых терапия анти-ФНО (инфликсимаб, адалимумаб) или ведолизумабом была эффективной, целесообразно проведение поддерживающей терапии этим же препаратом с или без азатиоприна.
Знание и практическое использование современных диагностических алгоритмов и инновационных препаратов иммуносупрессивной и биологической терапии (адалимумаба, ведолизумаба), доступных на фармацевтическом рынке Украины, позволят обеспечить индукцию и глубокую ремиссию заболевания, улучшить качество жизни пациентов и снизить риск хирургического лечения ЯК.
Литература
1. Ивашкин В.Т., Шелыгин Ю.А., Абдулганиева Д.И. и соавт. Рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению взрослых больных язвенным колитом // РЖГГК. – 2015. – № 1. – С. 48-65.
2. Кушнир И.Э. Терапевтические стратегии лечения язвенного колита: реалии и перспективы // Сучасна гастроентерологія. – 2016. – № 4 (90). – С. 108-115.
3. Ariyaratnam J., Subramanian V. Association between thiopurine use and nonmelanoma skin cancers in patients with inflammatory bowel disease: a meta-analysis // American Journal of Gastroenterology. – 2014; 109(2):
163-9.
4. Atreya R., Bloom S., Scaldaferri et al. Clinical effects of a topically applied toll-like receptor 9 agonist in active moderate-to-severe ulcerative colitis //
J Crohns Colitis, 2016. – 10. – P. 1294-1302.
5. Bickston S. J., Behm B.W., Tsoulis D. J. at al. Vedolizumab for induction and maintenance of remission in ulcerative colitis // Cochrane Database Syst. Rev, 2014.
6. Chande N., Wang Yo. еt al. Methotrexate for induction of remission in ulce-rative colitis // Cochrane Database Syst. Rev, 2014.
7. Dignass A. et al. Second EUROPEAN evidence-based Consensus on the diagnosis and management of ulcerative colitis: Current management //
J Crohn’s Colitis, Reprinted from: 2012; 6(10): 991-1030.
8. Farkas S., Hornung M., Sattler C., Edtinger L., Steinbauer M., Anthuber M. et al. Blocking MAdCAM‑1 in vivo reduces leukocyte extravasation and reverses chronic inflammation in experimental colitis // International Journal of Colorectal Disease. – 2006; 21(1): 71-8.
9. Feagan B.G., Rutgeerts P., Sands B.E. et al. Vedolizumab maintenance the-rapy for UC: results of GEMINI I, a randomized, placebo-controlled, double-blind, multicenter phase 3 trial. // ACG 2012 Annual Scientific Meeting Abstracts; October 19-24, 2012; Las Vegas, NV. Program 5.
10. Gisbert J.P., Bermejo F., Perez-Calle J.L. et al. Fecal calprotectin and lactoferrin for the prediction of inflammatory bowel disease relapse / Inflamm Bowel Dis. – 2009. – 15. – P. 1190-1198.
11. Gordon G.L ., Zakko S., Murthy U. et al. Once-daily Mesalamine Formulation for Maintenance of Remission in Ulcerative Colitis: A Randomized, Placebo-controlled Clinical Trial. // J Clin Gastroenterol. – 2016. –50 (4.). – P. 318-325.
12. Goyette P., Boucher G., Mallon D. et al. International Inflammatory Bowel Disease Genetics Consortium; Australia and New Zealand IBDGC; Belgium IBD Genetics Consortium; Italian Group for IBD Genetic Consortium; NIDDK Inflammatory Bowel Disease Genetics Consortium; United Kingdom IBDGC; Wellcome Trust Case Control Consortium; Quebec IBD Genetics Consortium High-density mapping of the MHC identifies a shared role for HLA-DRB1*01:03 in inflammatory bowel diseases and heterozygous advantage in ulcerative colitis // Nat Genet. – 2015. – 47. – P. 172-179.
13. Katsanos K.H., Vermeire S., Christodoulou D.K. et al. EC-IBD Study Group Dysplasia and cancer in inflammatory bowel disease 10 years after diagnosis: results of a population-based European collaborative follow-up study Digestion. – 2007. – 75. – P. 113-121.
14. Langner C., Magro F., Driessen A. et al. European Society of Pathology; European Crohn’s and Colitis Foundation The histopathological approach to inflammatory bowel disease: a practice guide // Virchows Arch, 2014. – 464. – P. 511-527.
15. Liu J.Z., van Sommeren S., Huang H. et al. International Multiple Sclerosis Genetics Consortium; International IBD Genetics Consortium. Association analyses identify 38 susceptibility loci for inflammatory bowel disease and highlight shared genetic risk across populations. // Nat Genet. –2015. – 47. – P. 979-986.
16. Magro F., Gionchetti P., Eliakim R. et al. Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis// J Crohns Colitis. – 2017/- DOI
https://doi.org/10.1093/ecco-jcc/jjx008
17. Roberts H., Rai S.N., Pan J. et al. Extraintestinal manifestations of inflammatory bowel disease and the influence of smoking // Digestion. – 2014. – 90. – P. 122-129.
18. Rodgers A.D., Cummins A.G. CRP correlates with clinical score in ulcerative colitis but not in Crohn’s disease // Dig Dis Sci . – 2009. – 52. – P. 2063-2068.
19. Rosenfeld G., Bressler B. et al. Anti-MAdCAM antibody for induction of remission in ulcerative colitis // Cochrane Database Syst. Rev, 2015.
20. Sandborn W.J., Assche G., Reinisch W., Colombel J.F., D’Haens G., Wolf D.C. et al. Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis // Gastroenterology. – 2012. – 142 (2). – P. 257-265.
21. Sandborn W.J., Feagan B.G., Marano C., Zhang H., Strauss R., Johanns J. et al. Subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis // Gastroenterology. – 2014. – 146 (1). – P. 85-95.
22. Sandborn W.J., Colombel J.F., Ghosh S. et al. Eldelumab (Anti-IP‑10) induction therapy for ulcerative colitis: a randomised, placebo-controlled, phase 2b study // J Crohns Colitis. – 2016. – 10. – P. 418-428.
23. Sandborn W.J.Targan S.R., Byers V.S. et al. Andrographis paniculata extract [HMPL‑004] for active ulcerative colitis // Am J Gastroenterol. –2013. –108. – P. 90-98.
24. Schoepfer A.M., Beglinger C., Straumann A. et al. Ulcerative colitis: correlation of the Rachmilewitz endoscopic activity index with fecal calprotectin, clinical activity, C-reactive protein, and blood leukocytes // Inflamm Bowel Dis. – 2009. – 15. – P. 1851-1858.
25. Silverberg M.S. Satsangi J., Ahmad T. et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a working party of the 2005 Montreal World Congress of Gastroenterology // Can J Gastroenterol. – 2005. – 19. – P. 5-36.
26. Wang L., Mencher S., Khurana S.K. et al. Novel STAT3 selective inhibitor Natura-a shows great promise in treating moderate-to-severe UC in a randomized, placebo-controlled, double-blind phase II clinical trial. In: ACG 2012 Annual Scientific Meeting Abstracts; October 19-24, 2012; Las Vegas, NV. Program P392.
27. Sandborn W.J. et al. Tofacitinib as Induction and Maintenance Therapy for Ulcerative Colitis // The New England Journal of Medicine, 2017; DOI:10.1056/NEJMoa1606910.
28. World Gastroenterology Organization, Global Guidelines IBD2015
http://gt-medical.com.ua/wp-content/uploads/2016.
Тематичний номер "Гастроентерологія, Гепатологія, Колопроктологія" № 3 (45) вересень 2017 р.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
12.04.2024
Гастроентерологія
Дієта для покращення репродуктивного здоров’я
Відтворення майбутнього здорової нації – один з найважливіших сенсів існування теперішнього покоління. День боротьби з ожирінням нагадує нам про поширеність цього проблемного явища і важливість попередження його наслідків. Ожиріння може мати вплив на різні аспекти здоров'я, включаючи репродуктивне....
04.04.2024
Гастроентерологія
Роль порушень маркерів запалення, оксидантно-протиоксидантного, протеїназно-інгібіторного гомеостазу, показників холестеринового обміну при остеоартрозі у поєднанні з метаболічним синдромом
Вивчення клініко-патогенетичних особливостей поєднаного перебігу остеоартрозу (ОА) у хворих із метаболічними розладами, які характеризують перебіг метаболічного синдрому (МС), зокрема цукровим діабетом (ЦД) 2 типу, ожирінням (ОЖ), артеріальною гіпертензією (АГ), є актуальним, оскільки це пов’язано з неухильним збільшенням розповсюдженості цього захворювання, недостатньою ефективністю лікування, особливо за коморбідності з іншими захворюваннями, які патогенетично пов’язані з порушеннями метаболічних процесів. ...








