Підвищення ефективності лікування дерматозів, асоційованих із патологією ШКТ, шляхом перорального застосування Escherichia coli Nissle 1917
 Захворювання шлунково-кишкового тракту (ШКТ) часто асоційовані з дерматозами, зокрема з акне, розацеа або себорейним дерматитом, які погіршують якість життя пацієнта. Спільна особливість цих проявів – еритематозний папульозно-пустульозний висип.
Захворювання шлунково-кишкового тракту (ШКТ) часто асоційовані з дерматозами, зокрема з акне, розацеа або себорейним дерматитом, які погіршують якість життя пацієнта. Спільна особливість цих проявів – еритематозний папульозно-пустульозний висип.
Формування поєднаної патології травного тракту і шкіри, взаємозв’язок, на перший погляд, не пов’язаних між собою захворювань можна пояснити ембріональним походженням, структурно-функціональними особливостями та спорідненістю нейрогуморальної та ендокринної регуляції, а також спільними етіологічними чинниками захворювань як шкіри, так і органів травлення. Захворювання ШКТ – одна з найбільш поширених причин індукування та хронізації дерматозів. Це пов’язано з порушенням всмоктувальної та перетравлювальної функцій кишечнику, накопиченням недоокиснених, не повністю перероблених продуктів метаболізму, що не тільки істотно збільшують навантаження на органи виділення, до яких належить шкіра, а й порушують «екологію тіла» індивіда.
ШКТ заселяє велика кількість непатогенних, умовно-патогенних, а іноді й патогенних мікроорганізмів. Кишкова мікробіота продукує біологічно активні речовини, продукти життєдіяльності, які за несприятливих умов порушують місцевий імунний захист слизового шару кишечнику, що призводить до порушення біоценозів, зокрема балансу мікробних популяцій у кишечнику. А це, у свою чергу, активізує вироблення токсинів і ферментів, які, потрапляючи у кров, впливають на імунні клітини і макрофаги та модифікують імунологічну реактивність організму людини.
Такі дерматози часто асоційовані з кишковими інфекціями або порушенням кишкової мікробіоти. Деякі роди чи види бактерій, наприклад бактероїди, фірмікути або біфідобактерії, переважають над іншими, такими як Escherichia coli (E. coli), лактобацили та ентерококи. Стафілококи, протей та кандиди належать до тимчасової мікрофлори. Склад кишкової мікробіоти визначається переважно характером харчування та видом дієти.
Функція мікробіоти останнім часом перебуває в центрі уваги науковців, оскільки вона відповідає не тільки за підтримання фізіологічної імунної відповіді, а й за метаболічні процеси, пов’язані з резистентністю до інсуліну, ожирінням і розвитком жирової хвороби печінки. Існує також припущення, що дисбаланс кишкової мікрофлори може спричиняти дерматози, індуковані надмірною стимуляцією імунної системи.
Наведені дані можуть мати терапевтичне значення, оскільки свідчать про можливість впливу на кишкову мікробіоту з метою її зміни на менш агресивну бактеріальну колонізацію. Одним із прикладів такого впливу є пероральне застосування штаму E. coli Nissle 1917 (EcN). За допомогою спеціальних адгезивних органел (за типом F‑1A, F‑1C і фігурних фімбрій) цей штам має здатність приєднуватися до слизової оболонки товстого кишечнику й створювати мікроколонії, формуючи біоплівки.
Вони також є мобільними через наявність джгутиків, що надає їм перевагу в колонізації товстої кишки. Таким чином, ці бактерії посилюють функції слизового бар’єра шляхом взаємодії з імуномодулюючими та протизапальними механізмами. E. coli Nissle гальмує зростання кількості грамнегативних анаеробних бактерій за рахунок секреції антимікробних речовин (мікроцинів) і сидерофорів, які захоплюють залізо і таким чином запобігають росту певного штаму патогенних мікроорганізмів. Згадана надмірна стимуляція імунної системи через патогенну мікробіоту при дерматозах, асоційованих із захворюваннями кишечнику, може проявлятися підвищенням рівнів цитокінів і хемокінів у крові.
При проникненні ендотоксинів із кишечнику в мікроциркуляторне русло крізь пошкоджений епітеліальний бар’єр відбувається активація каскаду запальних реакцій та модуляція імунокомпетентних клітин. Проявами порушення імунного захисту є:
- зміна загальної кількості Т-лімфоцитів;
- зниження активності Т-хелперів і лізоциму;
- підвищення активності Т-супресорів;
- порушення синтезу імуноглобуліну А (IgA), інтерферону-α (INF-α) та цитокінів;
- підвищення проникності судинного і тканинного бар’єрів для токсичних речовин, патогенної та умовно-патогенної мікрофлори (у подальшому);
- транслокація бактерій у системний кровообіг.
При хронічних дерматозах відзначається дисбаланс у системі лімфоцитів із фенотипом Т-хелпер/індуктор із переважанням субпопуляцій Т-хелперів 2 типу (Th2) і відносним зниженням активності Т-хелперів 1 типу (Th1). Зміщення функціональної активності системи лімфоцитів у бік Th2 супроводжується підвищенням рівня інтерлейкінів (IL-2, IL-4, IL-5, IL-8) та зниженням рівня інтерферону-γ (INF-γ) та IL-10 у сироватці крові. Детальне вивчення цитокінів дозволяє отримати дані про функціональну активність різних видів імунокомпетентних клітин, тяжкість запального процесу, його перехід на системний рівень, а також спрогнозувати його перебіг.
Цитокіни IL-8 і INF-α притягують мононуклеарні клітини до місця запалення з метою знищення патогенів шляхом активації імунної системи. Для проникнення в організм патогенна мікробіота має пройти крізь слизовий бар’єр, який складається з кількох рівнів захисту. Слиз – це перша перешкода на її шляху: він містить IgA, який інактивує вторгнення бактерій, тому пацієнти з дефіцитом IgA схильні до кишкових інфекцій.
У дослідженні ми оцінили роль IL-8, INF-α та IgA у патогенезі дерматозів, асоційованих із захворюваннями кишечнику, і терапевтичний ефект від перорального введення E. coli Nissle у таких випадках.
Матеріали та методи
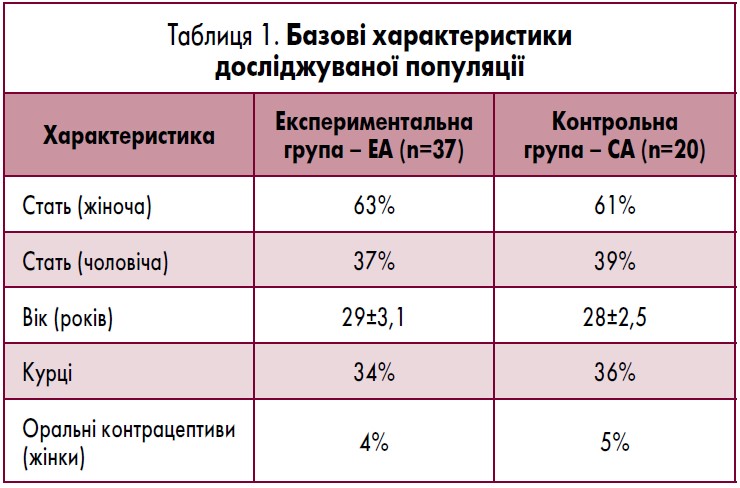
У рандомізованому контрольованому несліпому проспективному клінічному дослідженні взяли участь 82 пацієнти, які мали виражену папульозно-пустульозну екзантему на обличчі. Вони були розділені на дві групи: експериментальну (EA) і контрольну (CA). У період між етапом відбору та першим візитом (інтервал – до 4 тижнів) 4 пацієнти та 21 пацієнт EA і CA груп відповідно були виключені з дослідження. Велику кількість виключених пацієнтів у контрольній групі можна пояснити тим, що вони не брали участь у протоколі активного лікування із застосуванням E. coli Nissle. У результаті відбору в дослідження було включено 37 пацієнтів групи ЕА і 20 – групи СА. Проведено загальний огляд усіх пацієнтів, у тому числі консультацію дерматолога для підтвердження діагнозу дерматозів.
З метою основного лікування хронічного дерматозу дієту з переважанням овочів призначено усім учасникам дослідження. Пацієнтам групи СА дерматолог призначив тільки стандартну місцеву терапію, що включала мазі, які містять тетрациклін, стероїди та ретиноїди (Kremgen® і Lokoid®). Пацієнти групи ЕА отримували комбіноване лікування, яке включало стандартну місцеву терапію дерматозів у комбінації з пероральним введенням E. coli Nissle 1917 – 1 капсула на добу протягом 4 днів, потім 2 капсули на добу протягом наступного місяця. Одна капсула E. coli Nissle 1917 містить 2,5-25×109 колонієутворюючих одиниць (КУО) живих бактерій. Капсули є стійкими до дії шлункового соку і не розчиняються, перш ніж досягнуть термінальних відділів тонкого кишечнику. Пацієнтів поінформували про необхідність зберігати засіб у прохолодному місці. Наступний огляд пацієнтів із дерматозами було проведено через місяць лікування.
Терапевтичний ефект від застосування E. coli Nissle оцінювали за динамікою зменшення дерматологічних проявів захворювання. Ще одним критерієм була суб’єктивна оцінка хворого щодо переносимості та побічних явищ. Якість життя пацієнта визначали за шкалою, яка включала 4 індексні точки: «хороша», «прийнятна», «погіршена» і «неприйнятна». З метою оцінки імунологічної відповіді проводили диференціацію білих клітин крові (БКК), а також за допомогою імунологічного аналізу визначали рівні IL-8 та INF-α.
Для кількісного визначення IgA використовували імунологічний метод. Випорожнення пацієнтів оцінювали за консистенцією, кольором, запахом, вмістом слизу і БКК, а також визначали наявність у них нейтрального жиру, жирних кислот, м’язових волокон і вміст крохмалю. Для кількісної оцінки штамів бактерій використовували стандартні методи.
Етичний дозвіл
Процес лікування був схвалений місцевим етичним комітетом. Усі учасники дослідження були поінформовані про природу дослідження та підписали письмову згоду. Протокол дослідження був затверджений обласним комітетом дослідницької етики.
Статистичний аналіз
Статистичний аналіз проводили за допомогою програмного забезпечення SPSS‑20. Усі дані у цьому дослідженні були виражені як середнє ±SD або у відсотках. Тест Колмогорова – Смирнова використовували для аналізу розподілу даних. Усі значення мали параметричний розподіл. Аналіз варіації застосовували для кількох порівнянь; якщо результати були значущими, то проводився тест Тьюкі. Порівняння пов’язаних значень, а саме даних одного пацієнта до та після лікування, проводилося за допомогою парного t-критерію Стьюдента. Відмінність між групами вважалася значущою при p<0,05.
Результати
Із 123 учасників дослідження з дерматозами 82 пацієнтів мали папульозно-пустульозну екзантему на обличчі. З них 57 пацієнтів віком від 18 до 42 років надали згоду на участь і були включені у дослідження. Тривалість захворювання у них коливалася від 1 до 10 років, а гендерний розподіл був такий: 35 – жінки та 22 – чоловіки. Групу ЕА склали 37 і групу СА – 20 пацієнтів (табл. 1).
У всіх пацієнтів спостерігалися характерні прояви еритеми у поєднанні з папульозно-пустульозними елементами. У 22% хворих діагностовано вугрі, у 36% – папулоподібні розацеа, у 57% – себорейний дерматит. У 10% пацієнтів була уражена вся шкіра обличчя. Що стосується первинної кінцевої точки дослідження, то поліпшення дерматологічних проявів було значно більш вираженим у групі ЕА порівняно з групою СА (p<0,01). Через місяць у 32% пацієнтів групи EA відзначалося відновлення і у 57% – істотне поліпшення (11% – просте поліпшення), тоді як у групі СА лише у 17% пацієнтів виявлено відновлення та у 39% – істотне поліпшення: 32% – просте поліпшення та 12% – без змін (рис. 1).
Рис. 1. Оцінка дерматологічних особливостей у пацієнтів обох груп через 1 міс
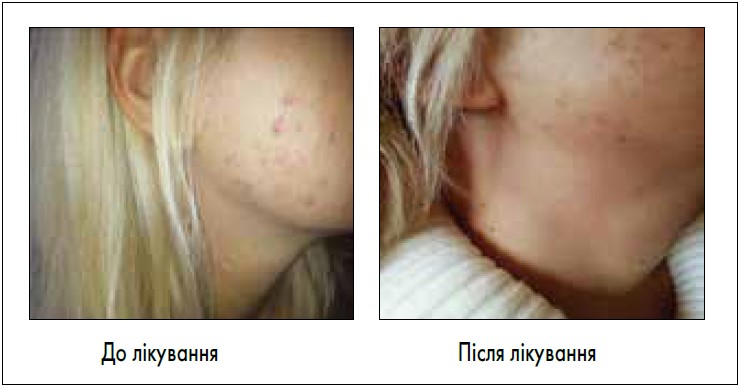
Вираженість проявів запального процесу шкіри обличчя зменшувалася у зворотному порядку їх розвитку. Спочатку зменшилися набряк і припухлість, згодом почали зникати папули та еритеми, формування нових папул і пустул припинилося після зникнення кірок у ділянці ураження та поступового вирівнювання вузлових утворень (рис. 2).
Рис. 2. Пацієнтка групи ЕА до і через місяць після лікування. Клінічний приклад пацієнта, якого лікували E. coli Nissle: помітно зменшилась вираженість папульозно-пустульозної екзантеми (висипу)
Усі пацієнти обох груп переносили лікування дуже добре, несприятливих подій не зареєстровано. Усі пацієнти групи ЕА вказали на поліпшення якості життя: 1,7±0,6 індексних точок (р<0,01). Усі пацієнти групи ЕА оцінили її як «прийнятну» або «хорошу», на відміну від пацієнтів групи СА, які оцінили якість життя так само, як і до лікування, – як «погіршену» (p>0,05). Отже, E. coli Nissle показав високу терапевтичну ефективність разом із хорошою переносимістю та відсутністю серйозних побічних реакцій.
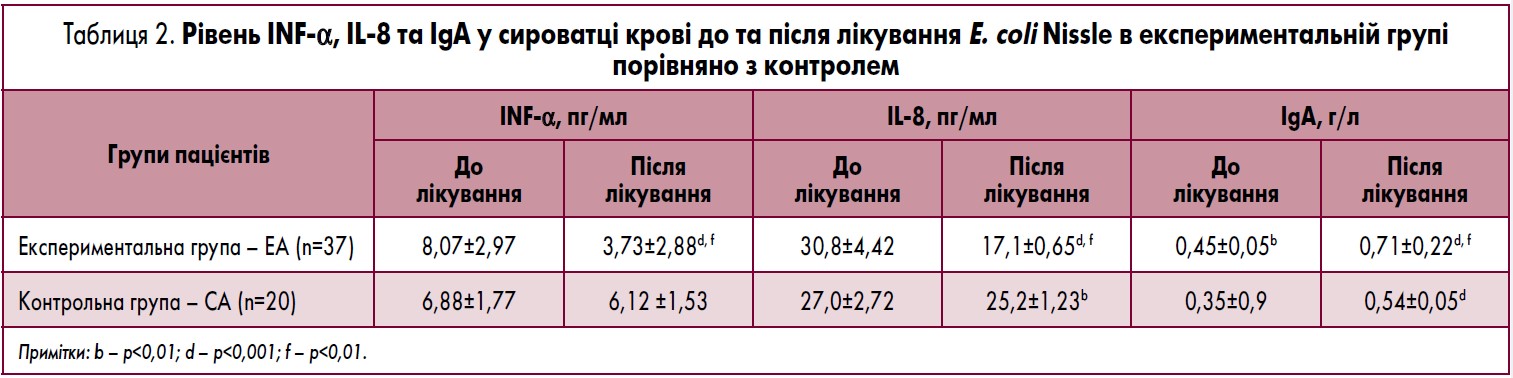
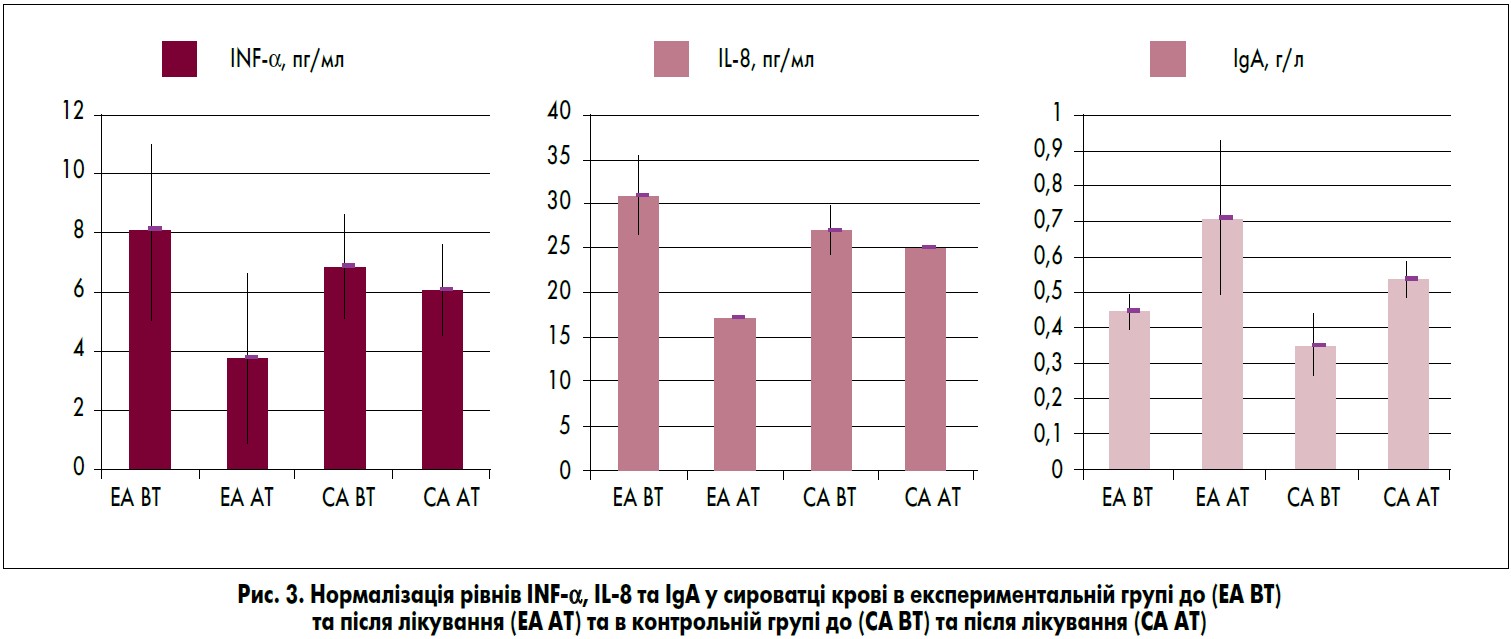
У пацієнтів групи ЕА з підвищеним рівнем INF-α спостерігалася тенденція до його зниження, але різниця між цими показниками не була статистично значущою. Низькі рівні IgA у сироватці крові були спочатку зареєстровані у пацієнтів обох груп. Після лікування нормалізація рівня IgA досягнута тільки у групі EA (табл. 2 і рис. 3).
Так само як і нормалізація рівня IL-8, який був спочатку підвищеним, після лікування досягнута тільки у пацієнтів групи ЕА. Імовірно, це пов’язано з імуномодулюючими властивостями E. coli Nissle 1917, що знижує рівень міграції нових активованих Т-лімфоцитів в епіцентр запалення. Відповідно, лімфоцитоз зник у 78% пацієнтів групи ЕА, тоді як у групі СА – тільки у 42% (табл. 2 і рис. 3).
Що стосується оцінки випорожнень, то у 82% пацієнтів вони спочатку були неоформленими, сірого кольору, липкої консистенції, з сильним запахом і великою кількістю слизу. Після лікування у 71% учасників групи ЕА були нормально сформовані випорожнення типового кольору і запаху з невеликою кількістю слизу.
До лікування мікрофлора випорожнень у пацієнтів обох груп характеризувалася меншим вмістом біфідо- та лактобактерій, разом із тим визначено збільшення кількості потенційно патогенних мікроорганізмів: стафілококів, дріжджів, бактероїдів, протея, цитробактеру і клебсієл (табл. 3). Після терапії із застосуванням E. coli Nissle у культурах випорожнень пацієнтів групи EA визначено збільшення кількості біфідо- і лактобактерій (p<0,01 для обох видів). Зареєстровано істотне зниження кількості стафілококів, дріжджів, бактероїдів, протея, цитробактеру, клебсієл у 59% хворих групи ЕА порівняно з групою СА, у якій змін не виявлено (p<0,01; табл. 3).
Обговорення
Механізми, через які захворювання кишечнику індукують асоційовані з ними дерматози, досі не з’ясовані. У цьому дослідженні ми показали, що дерматози супроводжуються зсувом у бік більш агресивного спектра кишкової мікробіоти. Патогенні мікроорганізми завдяки їх здатності проникати у слизову оболонку активізують імунну систему, внаслідок чого підвищуються рівні IL-8 та INF-α. Це, ймовірно, є причиною індукції дерматозів, оскільки вони притягують мононуклеарні клітини до попередньо утворених уражень шкіри, що призводить до запалення. Вираженість проявів дерматозу істотно зменшується у результаті перорального застосування E. coli Nissle.
Питання про те, чи є низькі рівні IgA, зареєстровані у пацієнтів до лікування, наслідком чи причиною інвазії агресивних бактерій, потребує подальшого вивчення.
Окрім встановлених змін розподілу мікробіоти, біоплівка E. coli Nissle per se може впливати також на консистенцію калу, що можна пояснити її впливом на функції слизового бар’єра. Продукція коротколанцюгових жирних кислот покращує абсорбційні характеристики слизу, зокрема його здатність поглинати воду, що сприяє формуванню більш щільних випорожнень і полегшує їх просування. І, що більш важливо, внаслідок посилення захисних функцій слизового бар’єра збудники не можуть легко проникати крізь нього. Таким чином, застосування E. coli Nissle дозволяє запобігти системній активації імунної системи, яка індукує дерматози, асоційовані з кишковою інфекцією.
Отже, штам E. coli Nissle є ефективним при хронічних дерматозах, асоційованих з кишковою інфекцією. Він характеризується хорошою переносимістю і відсутністю несприятливих подій. Механізм дії E. coli Nissle на кишкову мікробіоту пов’язаний зі зменшенням кількості агресивних бактерій. А це, у свою чергу, покращує імунну відповідь, що характеризується нормалізацією рівнів IgA та IL-8. Тому E. coli Nissle можна включати у схеми лікування пацієнтів із дерматозами, асоційованими з кишковою інфекцією.
Список літератури знаходиться в редакції.
Стаття друкується у скороченні.
Manzhalii E., Hornuss D., Stremmel W. Intestinalborne dermatoses
significantly improved by oral application of Escherichia coli Nissle 1917. World J Gastroenterol 2016; 22(23): 54155421.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 2 (48), травень 2018 р.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
Метаболічноасоційована жирова хвороба печінки (МАЖХП) є однією з найактуальніших проблем сучасної гепатології та внутрішньої медицини в цілому. Стрімке зростання поширеності ожиріння та цукрового діабету (ЦД) 2 типу в популяції призвело до істотного збільшення кількості хворих на МАЖХП, яка охоплює спектр патологічних станів від неускладненого стеатозу до алкогольної хвороби печінки та цирозу, що розвиваються на тлі надлишкового нагромадження ліпідів у гепатоцитах. ...
Інфекція Helicobacter pylori (H. pylori) офіційно визнана інфекційним захворюванням і включена до Міжнародної класифікації хвороб (МКХ) 11-го перегляду, тому рекомендовано лікувати всіх інфікованих пацієнтів. Проте, зважаючи на широкий спектр клінічних проявів, пов’язаних із гастритом, викликаним H. pylori, лишаються специфічні проблеми, які потребують регулярного перегляду для оптимізації лікування. ...
Відтворення майбутнього здорової нації – один з найважливіших сенсів існування теперішнього покоління. День боротьби з ожирінням нагадує нам про поширеність цього проблемного явища і важливість попередження його наслідків. Ожиріння може мати вплив на різні аспекти здоров'я, включаючи репродуктивне....
Вивчення клініко-патогенетичних особливостей поєднаного перебігу остеоартрозу (ОА) у хворих із метаболічними розладами, які характеризують перебіг метаболічного синдрому (МС), зокрема цукровим діабетом (ЦД) 2 типу, ожирінням (ОЖ), артеріальною гіпертензією (АГ), є актуальним, оскільки це пов’язано з неухильним збільшенням розповсюдженості цього захворювання, недостатньою ефективністю лікування, особливо за коморбідності з іншими захворюваннями, які патогенетично пов’язані з порушеннями метаболічних процесів. ...