Место тиазидных и тиазидоподобных диуретиков в лечении пациентов с ХСН
Хроническая сердечная недостаточность (ХСН) является осложнением большинства сердечно-сосудистых заболеваний, не только ограничивающим качество и продолжительность жизни пациентов, но и приводящим к определенным медико-социальным, в том числе экономическим проблемам [30, 31]. Статистические данные свидетельствуют о неуклонном росте распространенности данной патологии в мире [3, 29].
Для любого врача ХСН ассоциируется в первую очередь с наличием отечного синдрома. С избыточным накоплением жидкости связано большинство жалоб пациента (одышка, отеки, сердцебиение, ортопноэ и т.д.). Соответственно, одним из основных принципов терапии ХСН является устранение отечного синдрома, которое достигается путем назначения диуретиков.
Современная база литературных источников, касающихся применения диуретиков при СН, весьма обширна [3, 12, 20, 33]. Несмотря на кажущуюся достаточную изученность данного вопроса, диуретики – самые неисследованные препараты. С одной стороны, их эффективность и необходимость для лечения больных с сердечной декомпенсацией ни у кого не вызывают сомнений, с другой – проведение плацебо-контролируемых исследований с использованием мочегонных препаратов не представляется возможным по этическим мотивам. Так или иначе, диуретики априори относятся к основным и необходимым препаратам для лечения ХСН [26].
Основная цель терапии мочегонными препаратами заключается в том, чтобы достигнуть и поддержать эуволемическое состояние пациента с помощью их наиболее низких доз. При этом доза диуретика должна регулироваться в соответствии с индивидуальными клиническими потребностями в течение длительного периода (табл. 1). Согласно действующим рекомендациям [26] правильно обученные пациенты могут самостоятельно варьировать дозы мочегонных препаратов, основываясь на данных контроля признаков «застоя» и ежедневного измерения массы тела.

Какому диуретику отдать предпочтение в той или иной ситуации, зависит от фармакокинетики, механизма действия и возможных побочных эффектов [7, 9].
Большинство работ посвящено исследованию петлевых диуретиков как наиболее хорошо изученных и преимущественно назначаемых пациентам с ХСН. Важную роль играют и калийсберегающие диуретики (антагонисты минералокортикоидных рецепторов – АМР), однако в настоящее время они рассматриваются в первую очередь как средства модификации клинического прогноза, применяемые в малых дозах [8, 16, 20]. Вызывает обоснованный интерес место тиазидных и тиазидоподобных диуретиков в лечении ХСН, поскольку они также включены в рекомендации по лечению пациентов с ХСН [26]. В то же время в литературе им уделяется намного меньше внимания, нежели вышеуказанным группам диуретических средств.
Первый тиазидный диуретик гидрохлортиазид синтезирован в 1952 году, а в 1956 году он был внедрен в клиническую практику и стал широко использоваться. Несмотря на многолетнее применение тиазидных диуретиков, они не потеряли своей актуальности и сегодня. Эти препараты отличаются по силе диуретического эффекта от петлевых диуретиков, однако занимают достаточно очерченную «нишу» в лечении пациентов с ХСН. В ряде клинических исследований тиазидные диуретики продемонстрировали свою эффективность у больных с тяжелой застойной (декомпенсированной) СН [8] (табл. 2).

В 2009 году международный комитет экспертов предложил оставить тиазидные диуретики в перечне ВОЗ основных лекарственных средств, применяемых при ХСН, поскольку «тиазидные диуретики являются препаратами для эффективного, недорогого и в целом хорошо переносимого лечения» [1]. При этом гидрохлортиазид рассматривается в качестве препарата сравнения для всего класса тиазидных и тиазидоподобных диуретиков. Указано, что другие представители этого класса могут быть использованы как альтернативные препараты, в зависимости от качества, цены и наличия на локальных рынках.
В настоящее время различают тиазидные (гидрохлортиазид, хлортиазид, бендрофлюметиозид, циклопентиазид, метиклотиазид, трихлорметиозид, гидрофлуметиозид, бензтиазид) и тиазидоподобные диуретики (хлорталидон, ксипамид, индапамид). Несмотря на различия фармакокинетических характеристик, все они считаются эффективными в сопоставимых дозах. На сегодняшний день обе вышеуказанные группы препаратов рассматриваются преимущественно как «вспомогательные», для преодоления резистентности к диуретической терапии при ХСН [10, 13, 22, 25, 27].
В течение достаточно длительного периода из этой группы препаратов у пациентов с ХСН в Украине использовался только гидрохлортиазид (как зарегистрированный в нашей стране и экономически доступный). В последние годы на отечественном рынке появился представитель тиазидоподобных диуретиков – ксипамид, который, в отличие от Украины, давно известен и успешно применяется во всем мире [14].
По мишени действия тиазидные и тиазидоподобные диуретики практически не отличаются, однако ввиду некоторых различий фармакодинамических свойств обнаруживают различия в их клинической эффективности.
Особенностью фармакодинамики ксипамида является то, что, воздействуя только на начальный отдел дистального почечного канальца, по выраженности своего диуретического эффекта он сопоставим с петлевыми диуретиками (рис. 1). При этом начало и продолжительность действия соизмеримы с таковыми гидрохлортиазида [11].
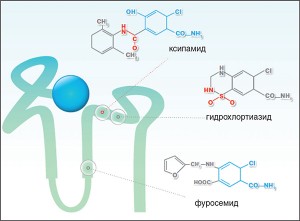 Рис. 1. Химическая структура и мишень действия ксипамида в сравнении с другими диуретиками (J. Greven, 1991)
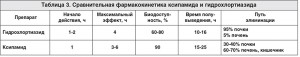
Рис. 1. Химическая структура и мишень действия ксипамида в сравнении с другими диуретиками (J. Greven, 1991)Выгодной особенностью ксипамида является двойной путь его элиминации (табл. 3.), что позволяет использовать препарат даже у пациентов с терминальной почечной недостаточностью. В то время как гидрохлортиазид не эффективен при скорости клубочковой фильтрации (СКФ) <40 мл/мин, ксипамид проявляет свою диуретическую эффективность у больных с величиной СКФ 10-15 мл/мин [11, 14]. При этом на фоне приема ксипамида отмечается пролонгированный диурез без нарушения регуляции по цепи канальцево-гломерулярной обратной связи и развития синдрома рикошета [15].
Исследование, включившее пациентов с отеками кардиального, почечного или печеночного генеза, показало, что ксипамид в дозе 40 мг/сут и фуросемид 40 мг/сут увеличивают среднесуточное выделение мочи на 70 и 75% соответственно [8], тогда как в другом исследовании с участием эдематозных больных применение равных доз ксипамида и фуросемида сопровождалось увеличением объема выведенной мочи на 10 и 13% соответственно [19]. У пациентов с декомпенсированной ХСН назначение ксипамида в дозе 40 мг/сут обеспечивало диурез, соответствовавший таковому на фоне использования фуросемида в дозе 25 мг/сут, причем применение обоих препаратов обеспечивало достижение максимального эффекта на третьи сутки регулярного приема [4].
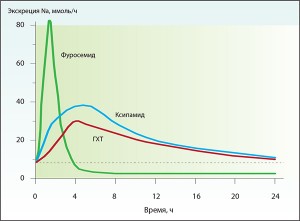
Как известно, выраженность мочегонного эффекта диуретических средств определяется их способностью стимулировать натрийурез. Высокий натрийуретический эффект фуросемида непродолжителен и существенно снижается к 4-му часу от момента приема препарата, после чего возможно наступление «рикошетного» эффекта задержки ионов Na+, перекрывающего достигнутый перед этим натрийурез [11, 16], что может потребовать введения повторной дозы лекарственного средства.
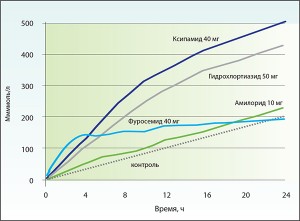
В отличие от фуросемида, у ксипамида и гидрохлортиазида пик натрийуреза не столь значителен, однако продолжительность данного эффекта существенно больше (рис. 2). При этом суммарное выведение натрия в течение суток достоверно выше в сравнении с фуросемидом [14] (рис. 3).
У пациентов с отеками, обусловленными застойной СН, применение ксипамида в дозе 40 мг/сут через день в течение 2 недель приводило к увеличению диуреза, максимум которого достигался в первый и третий дни. Экскреция натрия была самой высокой в первый день, а экскреция калия – на седьмой [2].
При рассмотрении проблемы переносимости диуретической терапии необходимо коснуться соответствующих различий между тиазидными и тиазидоподобными диуретиками. Так, в отличие от тиазидных диуретиков, оказывающих потенциально негативный эффект на углеводный и липидный обмены, тиазидоподобные мочегонные средства в данном аспекте «нейтральны» [32] (табл. 4).

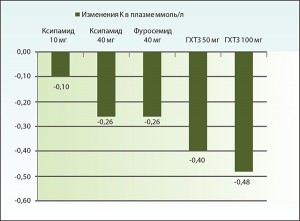
Хорошо известным побочным эффектом тиазидных диуретиков является повышенное выведение калия (рис. 4). В отношении абсолютного количества экскретируемого калия ксипамид в два раза более безопасен в сравнении с гидрохлортиазидом и сопоставим с фуросемидом [14]. Однако равномерное на протяжении суток действие ксипамида за счет длительного периода полувыведения позволяет активизировать процессы его компенсаторного физиологического пополнения из тонкого кишечника по электрохимическому градиенту концентрации [28, 34] и избежать развития осложнений, ассоциированных с гипокалиемией.
В настоящее время тиазидные и тиазидоподобные диуретики продолжают рассматриваться как полезное дополнение к петлевым диуретикам и АМР. Их назначение оправдано с целью преодоления резистентности к диуретической терапии у пациентов с ХСН. Применение комбинации петлевых диуретиков для устранения резистентности к диуретической терапии считается нежелательным [17, 21]. В практической работе следует учитывать, что присоединение к петлевым диуретикам гидрохлортиазида ограничено при клиренсе креатинина <40 мл/мин (что, к сожалению, наблюдается у декомпенсированных пациентов с ХСН в 60-70% случаев).
Резюмируя вышеизложенное, можно отметить, что добавление в схему лечения тиазидных или тиазидоподобных диуретиков является важным элементом стратегии преодоления рефрактерного отечного синдрома при ХСН. В отличие от гипотиазида ксипамид не оказывает существенного влияния на почечную гемодинамику и СКФ и является эффективным средством даже в случаях терминальной почечной недостаточности. 24-часовой натрийуретический эффект ксипамида в дозе 40 мг превышает таковой как при приеме фуросемида 40 мг, так и гидрохлортиазида 50 мг. При этом, в отличие от фуросемида, ксипамид не вызывает развития «рикошетного» эффекта задержки натрия.
Литература
1. 17th Expert Committee on the Selection and Use of Essential Medicines: Review of the available evidence on Thiazides Diuretics in the management of Heart Failure for the who model list of essential medicines. Geneva, 2009.
2. Antonelli S., di Napoli M., Leone G. Ricerche cliniche sulla'ttita diuretica della xipamide // Policlinico – 1979. – 86/1; 34-42.
3. Bleumink G.S. Quantifying the heart failure epidemic: prevalence, incidence rate, lifetime risk and prognosis of heart failure The Rotterdam Study / G.S. Bleumink, A.M. Knetsch, M.C. Sturkenboom, S.M Straus, A. Hofman, J.W. Deckers, J.C. Witteman, B.H. Stricker // Europ. Heart J. – 2004. – Vol. 25(18). – P. 1614-9.
4. Bonaduce D., Ferrara N., Canonico V. et al. Хipamide treatment in congestive heart failure: double-blind trial with furosemide // Curr Ther Res. – 1982. – 31; 293-301.
5. Christ M., Ludwig N., Maisch B. Value of aldosterone receptor blockade in diuretic therapy of patients with chronic heart failure // Herz. – 2002. – 27: 135-49.
6. Costanzo M.R., Johannes R.S., Pine M., Gupta V., Saltzberg M., Hay J. et al. The safety of intravenous diuretics alone versus diuretics plus parenteral vasoactive therapies in hospitalized patients with acutely decompensated heart failure: a propensity score and instrumental variable analysis using the Acutely Decompensated Heart Failure National Registry (ADHERE) database // Am. Heart J. – 2007. – 154: 267-77.
7. Faris R., Flather M., Purcell H., Henein M., Poole-Wilson P., Coats A. Current evidence supporting the role of diuretics in heart failure: a meta analysis of randomised controlled trials // Int. J. Cardiol. – 2002. – 82; 149-58.
8. Fischer R., Lenhartz A. Experience with a new diuretic // Med. Welt. – 1970. – 21; 270-273.
9. Futterman L.G., Lemberg L. Diuretics, the most critical therapy in heart failure, yet often neglected in the literature // Am. J. Crit Care. – 2003. – 12: 376-80.
10. Guntheroth W.G. Decompensated heart failure and diuretic resistance // J. Am. Coll. Cardiol. – 2006. – 48:1059-60.
11. Henness D., Wenig T. Single-dose evaluations of xipamide: a comparison study with furosemide and hydrochlorothiazide // Clinical Therapeutics. – 1979. – 2; 277-286.
12. Iyengar S., Abraham W.T. Diuretics for the treatment of acute decompensated heart failure // Heart Fail. Rev. – 2007. – 12: 125-30.
13. Iyengar S., Abraham W.T. Diuretic resistance in heart failure // Curr. Heart Fail. Rep. – 2006. – 3: 41-5.
14. Knauf H., Mutschler E. Pharmacodynamics and pharmacokinetics of xipamide in patient with normal and impaired kidney function // European Jornal of Clinical Pharmacology – 1984. – 26/4; 513-520.
15. Kult J., Larrat V. Xipamid bei chronihem Nierenversagen: Therapeutische irfahrungen // Nieren – und Hochdruckrankheiren. – 1995. – 24; 1-11.
16. Leary W., Asmal A., Reyes A. Time-courses of the diuretic, natriuretic and kaliuretic effects of xipamide // Current therapeutic Researcher. – 1980. – 27; 16-21.
17. Neuberg G.W, Miller A.B, O'Connor C.M., Belkin R.N., Carson P.E., Cropp A.B. et al. Diuretic resistance predicts mortality in patients with advanced heart failure // Am. Heart J. – 2002. – 144: 31-8.
18. Paul S. Balancing diuretic therapy in heart failure: Loop diuretics, thiazides, and aldosterone antagonists // Congestive Heart Fail. – 2002 – 8: 307-12.
19. Piyasena K., Havard C., Weber J. Xipamide – a potent new diuretic // Current medical research and Opinion. – 1975. – 3; 121-125.
20. Rationale and design of a randomized trial to assess the effects of diuretics in heart failure: Japanese Multicenter Evaluation of Long- vs Short-Acting Diuretics in Congestive Heart Failure (J-MELODIC) // Circ.J. – 2007; 71: 1137-40.
21. Ravnan S.L., Ravnan M.C., Deedwania P.C. Pharmacotherapy in con-gestive heart failure: diuretic resistance and strategies to overcome resistance in patients with congestive heart failure // Congest. Heart Fail. – 2002. – 8: 80-5.
22. Rosenberg J., Gustafsson F., Galatius S., Hildebrandt P.R. Combination therapy with metolazone and loop diuretics in outpatients with refractory heart failure: an observational study and review of the literature // Cardiovasc. Drugs Ther. – 2005. – 19: 301-6.
23. Sica D.A. Pharmacotherapy in congestive heart failure: drug absorption in the management of congestive heart failure: loop diuretics // Congest. Heart Fail – 2003. – 9: 287-92.
24. Spannheimer A., Muller K., Falkenstein P., Reitberger U., Gutzwiller F., Follath F. Long-term diuretic treatment in heart failure: are there differences between furosemide and torasemide? // Schweiz. Rundsch. Med. Prax. – 2002. – 91: 1467-75.
25. Sun W.Y., Reiser I.W., Chou S.Y. Risk factors for acute renal insufficiency induced by diuretics in patients with congestive heart failure // Am. J. Kidney Dis. – 2006. – 47: 798-808.
26. The 2012 ESC Guidelines on Heart Failure. The latest Guidelines feature new evidence on diagnosis, drugs, and devices // European Heart Journal. – 2012 (33). – 1703-17111.
27. Tuma P., Hrdy P. Diuretics in therapy of diuretic resistance by patients with congestive heart failure // Vnitr. Lek. – 2006. – 52: 782-9.
28. Бабский Е.Б. Физиология человека // Медицина. – 1985. – 370-371.
29. Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т. Хроническая сердечная недостаточность. Избранные лекции по кардиологии. – М.: Гэотар-Медиа, 2006. – С. 94-108; 165-192.
30. Воронков Л.Г. Пацієнт із ХСН в Україні: аналіз усієї популяції пацієнтів, обстежених у рамках першого національного зрізового дослідження UNIVERS // Серцева недостатність. – 2012; 1: 8-13.
31. Воронков Л.Г. Хронічна серцева недостатність: практ. посіб. – 2004. – С. 131-134.
32. Мамедов М.Н., Метельская В.А., Перова Н.В. Метаболический синдром: пути реализации атеротромбогенного потенциала // Кардиология. – 2000. – Т. 40. – № 2. – С. 83-89.
33. Несукай Е.Г., Савустьяненко А.В. Сравнение наименьших эффективных пероральных доз торасемида и фуросемида в лечении хронической сердечной недостаточности // Новости медицины и фармации. – 2010. – № 19 (342).
34. Шмидт В., Тевс Г. Физиология человека // Мир. – 1996. – Т. 3;
748-752.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....