Дефіцит йоду та йодна профілактика: огляд та оновлені дані
Йод – необхідний мікроелемент для щитоподібної залози (ЩЗ), де відбувається синтез тиреоїдних гормонів. Тироксин (Т4) є основним гормоном, який безпосередньо синтезується ЩЗ. З іншого боку, трийодтиронін (Т3), фізіологічно активний гормон, або виробляється безпосередньо ЩЗ, або ж утворюється в результаті периферичного дейодування циркулюючого Т4 за допомогою ферменту дейодинази, до складу якого входить селен. Гормони ЩЗ регулюють низку фізіологічних процесів, у тому числі ріст, розвиток, метаболізм і репродуктивну функцію [1].
Синтез гормонів ЩЗ посилюється тиреотропним гормоном (ТТГ) гіпофіза. ТТГ стимулює захоплення йоду та окислення його тироцитами, синтез тиреоглобуліну, утворення сполук йодтироніну та виділення тиреоїдних гормонів залозою [2]. Авідність ЩЗ до йоду та його захоплення посилюються в разі дефіциту цього мікроелементу та пригнічуються через надмірну його кількість.
Дефіцит йоду призводить до недостатнього вироблення Т4. У відповідь на зниження рівня Т4 в крові збільшується продукування ТТГ гіпофізом для відновлення рівня циркулюючого Т4.
Стійко підвищений рівень ТТГ призводить до збільшення ЩЗ (гіперплазії) і формування багатовузлового зоба [2]. Оскільки адаптація для забезпечення організму необхідною кількістю гормонів ЩЗ є недостатньою, дефіцит йоду може призвести до первинного гіпотиреозу.
Природні та штучні джерела
Йод існує в природі у вигляді йодиду та йодату в магматичних породах і ґрунтах. Однак йод може бути вилучений із поверхневих шарів землі та порід, оскільки йодид і йодат добре розчиняються у водній фазі. Таким чином, вони потраплять із дощової води в поверхневі води, моря та океани, зрештою стаючи доступними для споживання тваринами та людьми [14]. Вільний елементарний йод також сублімується в атмосферу безпосередньо з ґрунту та гірських порід через його високу летючість. Під час опадів йод випадає в осад на поверхні землі та стікає в землю та скелі, а потім може поглинатися рослинами.
Овочі не забезпечують потрібну організму кількість йоду в раціоні, тому вегетаріанці зазнають дефіциту йоду навіть у регіонах із достатньою кількістю елементу [15]. М’ясо, молоко, яйця, риба та інші продукти тваринного походження є найважливішими джерелами йоду в харчуванні людини.
Розрахункова середня концентрація йоду в тканинах тварин, крім ЩЗ (тобто в скелетних м’язах), становить приблизно 0,1 мг/кг [16]. Проте вміст йоду в тканинах тварин залежить від його додавання до основного корму [16].
Морепродукти та морська риба є найважливішими джерелами йоду, оскільки морська фауна та флора накопичує велику кількість розчиненого в морській воді йоду. Свіжа та вирощена на фермах риба, порівняно з морською, містить менше йоду. Так, риба з річок чи озер зазвичай має нижчий уміст цього елемента [17, 18].
Споживання йоду різниться залежно від географічних територій, а також в окремих людей у певному географічному регіоні, тому й індивідуальне його споживання щодня відрізняється. Уживання йоду також значною мірою залежить від віку [19-22]. У Німеччині молоко та молочні продукти забезпечують приблизно 35% добової потреби в йоді, інші дві третини – м’ясо і м’ясопродукти, хліб і крупи, риба [19].
У Данії молоко забезпечує понад 30% щоденного споживання йоду, подібний відсоток був зареєстрований у дітей із Швейцарії [20, 21].
У школярів Нідерландів морепродукти є незначним джерелом йоду, оскільки їх вживають лише приблизно раз на місяць [22].
Завдяки аліментарній політиці, яка дає можливість додавати йод до харчових продуктів, в останні десятиліття стали доступні оброблені продукти, що містять значно більше йоду, їх використовують у національних програмах для забезпечення йодної профілактики та протидії клінічним наслідкам дефіциту йоду. Йодування солі для споживання людиною є всесвітньою рекомендованою стратегією.
Йод може потрапляти в організм завдяки постійному споживанню або внаслідок прийому певних ліків, таких як аміодарон, повідон-йод, рентгеноконтрастні засоби на основі йоду та полівітамінні препарати. Наприклад, 200 мг аміодарону (середня добова доза підтримувальної терапії) містить 75 мг йоду, що в 500 разів перевищує рекомендовану добову потребу в цьому елементі. Рентгеноконтрастні засоби на основі йоду містять грами йоду.
Рекомендоване дозування
Щоденне споживання йоду коливається від менш ніж 10 мкг у зjнах із сильним дефіцитом елементу до кількох сотень міліграмів у пацієнтів, які приймають йодовмісні лікарські засоби.
Здебільшого рекомендованою добовою нормою споживання йоду для дорослих і людей похилого віку є 150 мкг йоду.
У вагітних або жінок, що годують груддю, потреба в йоді зростає щонайменше до 200-250 мкг/добу [23]. Потреба в йоді на кілограм маси тіла вища в новонароджених і дітей, якщо порівняти з дорослими, і становить 70-120 мкг у дітей і 40 мкг у новонароджених [24].
Ці рекомендації враховують добовий обмін гормонів ЩЗ у здорових людей із середнім споживанням йоду, пов’язаним із найнижчими референтними значеннями рівня ТТГ, найменшим об’ємом ЩЗ та найнижчою частотою транзиторного гіпотиреозу під час неонатального скринінгу, а також із середньою потребою в левотироксині для відновлення стану еутиреозу в пацієнтів з агенезією ЩЗ або після тиреоїдектомії [23].
Дефіцит йоду
Здорове харчування в регіонах з історичним дефіцитом йоду забезпечує приблизно 50% добової потреби дорослих у цьому елементі, що є недостатнім для адекватного надходження мікроелементів. Це питання є особливо актуальним під час певних станів, таких як вагітність і лактація, коли потреба в йоді зростає майже вдвічі.
Для оцінки щоденного споживання йоду населенням використовували декілька біомаркерів. Так, швидкість виділення йоду із сечею є надійним показником добового споживання йоду, оскільки 90% циркулюючого йоду виводиться через нирки [2]. Найкориснішими лабораторними маркерами йодного статусу в програмі колективного скринінгу є 24-годинна концентрація йоду в сечі та співвідношення вмісту йоду до рівня креатиніну в сечі. Однак одномоментна оцінка концентрації йоду в сечі є кращою для обстежень населення, ніж 24-годинні зразки, оскільки вони є непрактичними [25]. У регіонах із достатнім умістом йоду середня 24-годинна концентрація елементу дорівнює або перевищує 100 г/л, що відповідає щоденному споживанню йоду на рівні не менш ніж 130 мкг.
За даними ВООЗ, йододефіцитні захворювання (ЙДЗ), такі як зоб, гіпотиреоз, порушення інтелекту та репродуктивної функції, зниження виживаності дітей та різного ступеня аномалії росту та розвитку, вражають понад 1 млрд людей в усьому світі [26].
Застосування йодованої солі значно зменшило поширеність дефіциту йоду в багатьох країнах світу з уже наявною його нестачею [23, 27]. Проте приблизно третина світової популяції досі проживає в географічних регіонах, де дефіцит йоду та пов’язані з ним захворювання є ендемічними [28].
Дифузне, або вузлове, збільшення ЩЗ є першим і найпоширенішим патофізіологічним наслідком дефіциту йоду. Як зазначалося вище, дефіцит йоду знижує внутрішньотиреоїдний синтез Т4 з подальшим адаптивним підвищенням у сироватці крові концентрації ТТГ.
За відсутності діагностики підвищення рівня ТТГ впродовж місяців або років є тригером гіперплазії та збільшення ЩЗ. Така адаптивна реакція зазвичай є достатньою для збереження стану еутиреозу впродовж кількох років, коли має місце субклінічний дефіцит йоду.
«Ендемічний» зоб вважають епідеміологічним станом, коли збільшення ЩЗ в популяції діагностовано в більш як 5% дітей шкільного віку [29]. Помірний або тяжкий дефіцит йоду може призвести до розвитку первинного гіпотиреозу, оскільки стимуляція ТТГ і збільшення ЩЗ виявляються недостатніми для підтримання еутиреоїдного стану.
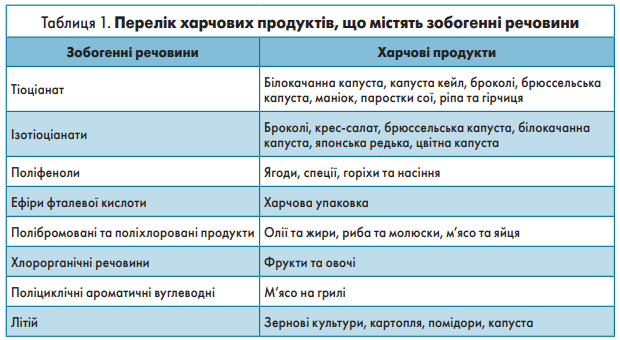
Окрім дефіциту йоду є сполуки, які виявляють у людей зобогенний ефект і можуть спровокувати розвиток захворювань ЩЗ у разі одночасного дефіциту йоду. До таких речовин належать тіоціанати, ізотіоціанати, поліфеноли, фталатні ефіри, поліхлоровані та полібромовані біфеніли, хлорорганічні сполуки, поліциклічні ароматичні вуглеводні та літій (табл. 1) [30-32]. Водночас тіоціанат, ізотіоціанат, перхлорат і літій пригнічують транспорт йодиду за допомогою натрій-йодидного симпортера (NIS). Фенольні сполуки та фталати перешкоджають окисленню й органіфікації йоду, а літій чинить вплив на ферментативний протеоліз тиреоглобуліну і гальмує вивільнення Т4. Полібромовані біфеніли прискорюють метаболізм тиреоїдних гормонів [33].
Збагачення продуктів йодом є терапевтичною стратегією для запобігання збільшенню ЩЗ у пацієнтів, які зазнають хронічного впливу зобогенних речовин, особливо в тих випадках, коли поглинання йоду та його метаболізм порушені (наприклад, перхлоратом, літієм і тіоціанатом) [30].
Дефіцит йоду на ранніх етапах життя може істотно вплинути на розвиток головного мозку. Гормони ЩЗ необхідні для мієлінізації структур центральної нервової системи (ЦНС), яка відбувається до і незабаром після народження. Було з’ясовано, що первинний гіпотиреоз, пов’язаний із дефіцитом йоду, негативно впливає на когнітивні функції з потенційно незворотними наслідками для інтелекту [34, 35].
Адекватне споживання йоду матір’ю на ранніх стадіях вагітності має важливе значення для правильного інтелектуального розвитку дитини незалежно від наявності/відсутності гіпотиреозу.
У повздовжньому дослідженні, проведеному у Великій Британії, коефіцієнт вербального інтелекту, точність читання та розуміння були значно нижчими в дітей, народжених жінками зі співвідношенням рівнів йоду до креатиніну <150 мкг, ніж у жінок зі співвідношенням ≥150 мкг [36].
Дефіцит йоду також асоціюється зі збільшенням частоти викиднів і мертвонароджень, а також вродженими вадами розвитку, у тому числі вродженим гіпотиреозом у дітей (табл. 2) [37, 38].
Вроджений гіпотиреоз може мати два класичні фенотипи: неврологічний і мікседематозний. Перший характеризується інтелектуальними порушеннями і затримкою розвитку, неврологічними дефектами, такими як недорозвинення вушної раковини, що призводить до глухоти, дефектами нової кори головного мозку з подальшими інтелектуальними порушеннями, недорозвиненням смугастого тіла з моторними розладами [39]. У пацієнтів не спостерігають ознаки гіпотиреозу, а поширеність зоба подібна до тієї, що реєструється в загальній популяції. Фенотип гіпотиреозу проявляється у вигляді карликовості із затримкою кісткового та статевого дозрівання, інтелектуальними порушеннями та явним гіпотиреозом. Порушується розвиток, і в пацієнтів зазвичай спостерігають малий об’єм ЩЗ або її атрофію [40]. Неврологічний кретинізм пов’язаний із дефіцитом гормонів ЩЗ на ранніх стадіях ембріонального розвитку, що є наслідком серйозного дефіциту йоду в матері на етапі, коли розвиток залози ще не завершився [41]. Мікседематозний кретинізм асоціюється з недостатністю ЩЗ на пізніх етапах вагітності або в ранньому дитинстві [42]. Чисті форми мікседематозного кретинізму переважають у Центральній Африці, тоді як в інших ендемічних регіонах, таких як Нова Гвінея та деякі країни Південної Америки, описаний лише неврологічний кретинізм. Змішані форми спостерігали в Індії [43]. Є припущення, що специфічний географічний розподіл різних фенотипів може визначатися іншими чинниками, крім дефіциту йоду, такими як спадкові фактори, дієта, багата на тіоціанат, низький уміст селену, цинку, міді, марганцю, заліза та антиоксидантів (наприклад, вітаміну А) [44-46].
Поширеність ендемічного зобу та інших ЙДЗ в більшості європейських країн є надзвичайно низькою, тоді як субклінічний дефіцит йоду в Західній та Центральній Європі залишається широко поширеною медичною проблемою [47]. Однак дефіцит йоду все ще викликає занепокоєння у сфері охорони здоров’я навіть у Європі. По-перше, споживання йоду може бути доволі низьким у певних підгрупах населення, тих, хто дотримується вегетаріанської дієти без споживання йодованої солі або використання добавок, що містять йод та інші мікроелементи (такі як селен і цинк), а також у тих, хто не дотримується дієтичних рекомендацій щодо підвищеної потреби в йоді (наприклад, під час вагітності та лактації) [48, 49]. Нещодавно проведений систематичний огляд національних опитувань і місцевих досліджень підтвердив, що в Європі споживання йоду в деяких осіб є нижчим за рекомендовані рівні, особливо серед дівчат і жінок [50].
Надлишок йоду
У більшості регіонів звичні дієти забезпечують недостатню кількість йоду і тому радше спричинять його дефіцит, ніж надлишок [52]. Але населення деяких регіонів може споживати з раціоном надлишок йоду. Хронічне перевантаження йодом зазвичай добре переноситься, оскільки більшість людей, які зазнали впливу великої його кількості, не мають жодних скарг із боку ЩЗ [53]. Однак хронічне надмірне споживання може збільшувати ризик субклінічного гіпотиреозу та, можливо, зоба через постійну надмірну стимуляцію ТТГ [54].
Гостре отруєння йодом є рідкісною невідкладною ситуацією, що виникає після прийому декількох грамів йодиду. Загальні клінічні прояви: печіння в роті, біль у горлі, лихоманка, нудота, блювання, діарея та, у тяжких випадках, розвиток коми [23]. Надлишок йодиду різко пригнічує синтез гормонів ЩЗ внаслідок описаного ефекту Вольфа–Чайкова. У більшості випадків це захворювання є минущим і зворотним, але воно може стати стійким за певних станів, таких як хронічний автоімунний тиреоїдит [23].
Допустима добова доза йоду становить приблизно 200 мкг для немовлят до 3 років, 250 мкг – для дітей віком 4-6 років, 300 мкг – для дітей віком 7-10 років, 450 мкг – для дітей 11-14 років, 500 мкг – для осіб віком 15-17 років та 600 мкг – для дорослих, у тому числі вагітних або жінок, що годують [26].
Йодна профілактика
У США йодна профілактика була розпочата в 1924 р. в Мічигані, який належить до так званого зобного поясу, групи штатів, в яких ендемічний зоб був дуже поширеним. Для йодної профілактики вперше використали збагачену йодом (йодовану) сіль; концентрація йоду в ній становила 100 мг/кг, що забезпечувало споживання приблизно 500 мкг йоду на добу, оскільки на той час середнє рекомендоване споживання солі становило приблизно 6,5 г на добу.
Споживання йодованої солі відчутно зросло з 1950-х років і відтоді залишалося стабільним на рівні приблизно 50% [57]. Управління із санітарного контролю харчових продуктів та медикаментів США – FDA рекомендує збагачувати сіль у межах 46-76 мг йодиду на кг [58].
Програми йодної профілактики в Європі розпочалися в Швейцарії (1922), Австрії (1923, припинена через кілька років і відновлена на постійній основі в 1963-м) та Нідерландах (1928), які з 1920-х років були визнані ендемічними щодо дефіциту йоду. Через деякий час йодну профілактику запровадили в інших країнах, зокрема в Польщі (1935), Фінляндії (1940), Португалії (1971), Італії (1972), Німеччині (1980) та Іспанії (1982). Споживання йодованої солі було добровільним, але вміст йоду в збагаченій солі зазвичай був недостатнім для профілактики або лікування ендемічного зобу, особливо в помірно ендемічних районах. Уміст йоду в збагаченій солі в Європі значно відрізняється: від 10 мг/кг в Австрії до 60 мг/кг в Іспанії. Різниця ґрунтується на тяжкості дефіциту йоду, політиці щодо дієти та інформаційних кампаніях зі сприяння йодної профілактики [59].
Виробництво йодованої солі було офіційно схвалено законом у 1972 р. в Італії. Після цього йодопрофілактика була розпочата вибірково в ендемічних регіонах, а через 5 років була поширена по всій країні.
З 1990 року універсальні програми зі збагачення йодом забезпечили значний прогрес в усьому світі, зростання кількості країн, які дотримуються обов’язкового йодування солі в межах від 15 до 40 мг/кг. Кількість країн, які досягли адекватного (середня концентрація йоду в сечі 100-199 мкг/л) і більш ніж адекватного (середня концентрація йоду в сечі 200-299 мкг/л) споживання йоду, у наступні десятиліття значно зросла [69].
За оцінками, у 2018 р. 88% населення світу використовували йодовану сіль, причому найбільше споживання спостерігали в Східній Азії та Тихоокеанському регіоні (92%), а найнижче – у Західній і Центральній Африці (78%) [70].
Згідно з Глобальною системою показників йодного харчування за 2021 рік, у дітей шкільного віку досягнуто адекватного споживання йоду в 146 країнах (що визначається як середня концентрація йоду в сечі 100-300 мкг/л), тоді як 26 країн усе ще є ендемічними за легким-помірним дефіцитом йоду [71].
Ризик, пов’язаний із йодною профілактикою та ймовірним передозуванням йоду
Згідно з програмами збагачення йодом у йододефіцитних регіонах, рекомендованим є щоденне споживання 150-200 мкг йоду. Збагачення йодом пов’язане зі збільшенням частоти розвитку спричиненого йодом гіпертиреозу, особливо в людей похилого віку з фоновим багатовузловим зобом. Субклінічний дефіцит йоду зумовлює хронічну стимуляцію, що призводить до фолікулярної гіперплазії, збільшення ЩЗ та розвитку багатовузлового зоба. У природних умовах один або декілька гіперпластичних вузликів можуть набувати автономної активності, тим самим переставши реагувати на нормальну систему регуляції ЩЗ. У разі збагачення йодом його поглинання та синтез гормонів ЩЗ посилюються, особливо в автономних вузлах, що призводить до гіпертиреозу [72]. Цей ефект є короткочасним і зазвичай зникає через кілька тижнів або місяців, проте він може призвести до несприятливих наслідків в осіб із певними захворюваннями (наприклад, у пацієнтів із високим ризиком фібриляції передсердь) [73].
Епідеміологічні дані свідчать, що в осіб із достатнім споживанням йоду спостерігають вищу частоту розвитку автоімунних захворювань ЩЗ, ніж в осіб із субклінічним дефіцитом йоду [74]. З іншого боку, постійне споживання йоду в пацієнтів з автоімунними захворюваннями ЩЗ і дефіцитом цього елементу в минулому може збільшити ризик розвитку гіпотиреозу та зоба, особливо в короткостроковій перспективі [74]. Було висунуто гіпотезу, що вплив йоду може спричинювати автоімунітет ЩЗ шляхом посилення імуногенності тиреоїдних йодованих білків, зокрема тиреоглобуліну [74].
Дефіцит йоду пов’язаний із вищим ризиком фолікулярного раку ЩЗ, тоді як збагачення йодом – знижує його. Однак у країнах, які раніше були визначені як регіони з дефіцитом йоду, йодна профілактика збільшила поширеність папілярного раку ЩЗ [73]. Крім того, було описано позитивний зв’язок між щоденним споживанням йоду і латентним папілярним раком ЩЗ. Дані реєстрів автопсії свідчать, що поширеність цього злоякісного захворювання ЩЗ була особливо значущою у Фінляндії (36%), де споживання йоду було практично оптимальним із 1980-х років [74].
Згідно з класифікацією ВООЗ усі випадки фолікулярного раку ЩЗ з папілярним компонентом визначали як папілярний рак ЩЗ, і це сприяло збільшенню в багатьох країнах співвідношення папілярних і фолікулярних форм раку ЩЗ після зміни класифікації [75]. З іншого боку, варто підкреслити, що більшість випадків неідентифікованого раку були мікрокарциномами (переважно <5 мм). Це епідеміологічне явище не викликає побоювань, оскільки, по-перше, дефіцит йоду є фактором ризику фолікулярного раку ЩЗ, а по-друге, прогноз папілярного раку є зазвичай дещо кращим, ніж у разі пов’язаного з дефіцитом йоду фолікулярного раку ЩЗ.
Висновки
Гормони ЩЗ відіграють ключову роль у регуляції низки функцій в організмі людини, а достатнє споживання йоду має вирішальне значення для підтримання гомеостазу ЩЗ. Дефіцит йоду є епідеміологічною проблемою не лише в країнах із низьким або середнім рівнем доходу, а й із високим, де збагачення йодом набуло загального визнання та поширення і де з часом епідеміологічна ситуація щодо ЙДЗ значно поліпшилася.
Особливості харчування, наприклад вегетаріанська дієта, низьке споживання продуктів, багатих на йод, і відсутність або припинення моніторингу споживання йоду населенням (наприклад, скринінг споживання йоду) можуть бути причинами субклінічного дефіциту йоду та інших ЙДЗ.
Конкретні рекомендації та стратегії щодо споживання йоду (як доповнення) необхідні для категорій людей, в яких уживання лише йодованої солі не забезпечує потреби в цьому елементі.
Йодування харчової солі залишається рекомендованою стратегією для адекватного споживання йоду. Незважаючи на деякі занепокоєння щодо високого ризику появи захворювань, пов’язаних із споживанням йоду (гіпертиреоз, автоімунні захворювання ЩЗ та відносно висока ймовірність розвитку папілярного раку ЩЗ), переваги переважують ризики.
За матеріалами Giuseppe Lisco et al. Iodine Deficiency and Iodine Prophylaxis: An Overview and Update. Nutrients. 2023.
Підготувала Дарина Павленко
Повна версія: https://www.mdpi.com/2072-6643/15/4/1004
Тематичний номер «Діабетологія. Тиреоїдологія. Метаболічні розлади» № 2 (62) 2023 р.
СТАТТІ ЗА ТЕМОЮ Терапія та сімейна медицина
Нещодавні дослідження показали, що прогноз за різних поширених захворювань, ендокринних, автоімунних розладів і навіть прогресування раку пов’язані з концентрацією вітаміну D у плазмі. Завдяки експресії гена 1α-гідроксилази (CYP27B1) клітини імунної системи (В-, Т- та антигенпрезентувальні клітини) здатні продукувати активний метаболіт кальциферол – речовину з імуномодулювальними властивостями. Рецептори до вітаміну D (vitamin D receptor, VDR) експресують на поверхні імунних клітин. Доведено зв’язок між поліморфізмом генів VDR або CYP27B1 і патогенезом автоімунних ендокринних захворювань. Метою огляду є вивчення впливу вітаміну D, наслідків його дефіциту та корисної ролі добавок із ним при деяких ендокринних розладах, які часто спостерігають у клінічній практиці. ...
Збудник COVID‑19, SARS-CoV‑2, з яким людство вперше стикнулося у 2019 р., поширився по всьому світу, заразивши мільйони людей. Сьогодні, через тягар війни та економічної нестабільності, тема COVID‑19 не сприймається так гостро, як ще кілька років тому, хоча насправді вона не втратила своєї актуальності. Саме сучасному стану проблеми COVID‑19 у світі та в Україні була присвячена доповідь директора ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», академіка Національної академії медичних наук України, члена-кореспондента НАН України, віце-президента НАМН України, президента Асоціації ендокринологів України, професора Миколи Дмитровича Тронька під час першого у 2024 р. засідання науково-освітнього проєкту «Школа ендокринолога», яке відбулося 20-24 лютого. ...
Протягом останніх 60 років метформін є найпоширенішим цукрознижувальним засобом і рекомендований як препарат першої лінії для осіб з уперше виявленим цукровим діабетом (ЦД) 2 типу. Сьогодні понад 200 млн осіб із ЦД 2 типу в усьому світі щодня застосовують метформін як монотерапію або в комбінації. Препарат усе частіше використовують для лікування гестаційного ЦД та в пацієнтів із синдромом полікістозних яєчників. ...
Двадцять восьмого лютого 2024 року виповнилося 80 років від дня народження директора ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (далі – Інститут), віцепрезидента НАМН України, академіка НАМН України, члена-кореспондента НАН України, заслуженого діяча науки та техніки, лауреата Державної премії України, доктора медичних наук, професора Миколи Дмитровича Тронька....