Цитиколін підвищує шанси на незалежність пацієнтів після черепно-мозкової травми: систематичний огляд і метааналіз
Черепно-мозкова травма (ЧМТ) у всьому світі набуває епідемічного масштабу. До травм голови схильні як люди похилого віку (здебільшого через падіння), так і молодь; причини таких травм можуть бути різними: дорожньо-транспортні пригоди, напади або нещасні випадки, пов’язані зі спортом і роботою [1, 2]. З початком повномасштабного вторгнення в Україні окремою проблемою постала бойова ЧМТ. Багато пацієнтів після перенесених травм голови набувають різного ступеня інвалідності, тому наслідки ЧМТ пов’язані з величезним тягарем для охорони здоров’я, суспільства та економіки [3].
Вважають, що краще розуміння складної патофізіології травматичного ушкодження нервової тканини допоможе зменшити частоту асоційованих із ЧМТ ускладнень. Зміни цілісності клітинної мембрани, а також порушення ліпідного обміну можуть зумовити загибель клітин після ЧМТ (як це відбувається за ішемічних уражень головного мозку). Важлива роль ліпідів у клітинній сигналізації та фізіології тканин була продемонстрована при багатьох розладах і травмах центральної нервової системи, пов’язаних із порушенням регуляції метаболізму [4]. Фосфоліпіди на основі холіну беруть участь у підтримці структурної цілісності мембран нейронів і гліальних клітин; водночас фосфоліпіди – важливий компонент різних біохімічних шляхів, як-от синтез нейромедіатора ацетилхоліну [4]. Отже, терапевтичний підхід, заснований на захисті та регенерації клітинних мембран, нормалізації метаболізму ліпідів, може виявитися корисним як нейропротекторна стратегія в пацієнтів після перенесеної травми голови. Нейропротекція активно застосовується як підхід до відновлення пацієнтів із ЧМТ серед інших напрямів лікування, як-от контроль за внутрішньочерепним тиском, нейромоніторинг та усунення пароксизмальної симпатичної гіперактивності [5].
Серед нейропротекторних препаратів, що застосовуються для лікування ішемії мозку, слід виокремити цитиколін [6]. Цитиколін (цитидин 5’-дифосфохолін, або CDP-холін) – ендогенна сполука, яка бере участь у біосинтезі фосфатидилхоліну, що є основним ліпідом нейронних мембран. У численних експериментальних роботах показано, що екзогенне введення цитиколіну сприяє синтезу фосфоліпідів, відновленню структури та функції клітинних мембран, що робить його нейропротекторним / нейровідновлювальним засобом у лікуванні розладів, пов’язаних з ішемією мозку [7, 8]. Цитиколін чинить плейотропний вплив на молекулярні події, залучені до патофізіології ішемії та травми головного мозку; широко використовується як нейропротекторне лікування інсульту і травм голови, а також наслідків обох захворювань [8].
Метою роботи колективу дослідників під керівництвом Хуліо Секадеса [9] було оцінити вплив терапії цитиколіном на функціональні результати лікування пацієнтів із ЧМТ (набуття ними незалежності від стороннього догляду) за допомогою систематичного огляду та метааналізу порівняльних досліджень.
Матеріали та методи
Цей систематичний огляд проводився відповідно до методологічних стандартів Кокранівської співпраці [10] і ґрунтувався на протоколі (CRD42021238998), внесеному до Міжнародного реєстру систематичних оглядів PROSPERO (доступ за таким посиланням: https://www.crd.york.ac.uk/PROSPERO [11]). При складанні звіту дотримувалися вказівок щодо належної звітності для систематичного огляду та метааналізу (PRISMA) [12].
До огляду включали рандомізовані контрольовані дослідження (РКД), порівняльні випробування, когортні дослідження пацієнтів чоловічої та жіночої статі будь-якого віку з діагнозом ЧМТ, у яких лікування розпочиналося в перші 24 год після травми і включало цитиколін (незалежно від того, чи порівнювали його з іншим активним лікуванням). Умовою включення дослідження до огляду було надання результатів щодо незалежності чи функціонального результату пацієнтів після ЧМТ. Незалежність визначали як здатність виконувати майже всі дії повсякденного життя без сторонньої допомоги. До випробування залучили пацієнтів з ускладненнями легкої ЧМТ (визначалося як пацієнти з початковим рівнем 13-15 балів за шкалою коми Глазго (GCS) та з деякими ураженнями на комп’ютерній томографії), з ЧМТ середньої тяжкості (GCS 9-12) і з тяжкою ЧМТ (GCS 3-8). Не розглядалися дослідження, в яких брали участь лише хворі з неускладненою легкою ЧМТ.
Пошук досліджень проводили в базах даних OVID-Medline, EMBASE (доступ через OVID), Google Scholar, Кокранівському центральному реєстрі контрольованих досліджень (CENTRAL) і вебсайті ClinicalTrials.gov Національного інституту охорони здоров’я США (від дати заснування до січня 2021 року) з використанням відповідної контрольованої лексики та вільних пошукових термінів. Для оцінки ризику систематичної помилки у включених дослідженнях використовували відповідні інструменти Кокранівської співпраці. Для рандомізованих досліджень застосовували інструмент RoB2 v.7 [13], для нерандомізованих – ROBINS-I [14].
Основним аналізованим показником ефективності була незалежність пацієнтів наприкінці запланованого клінічного дослідження. За наявності аналізували оцінки за Шкалою результатів Глазго / розширеною шкалою результатів Глазго (GOS/GOSe). З випробувань, у яких не проводилося вимірювання GOS/GOSe, брали найповніший показник інвалідності чи незалежності, про який повідомлялося в дослідженні.
Для GOS хорошим результатом вважалися 4 або 5 балів (незалежність), а для GOSe – 7 або 8 балів відповідно. В основному аналізі визначали співвідношення ризиків (RR) для перевірки пропорційних ефектів лікування цитиколіном. У додатковому аналізі визначали відношення шансів (OR) і різницю ризиків (RD). З огляду на очікувано високу різнорідність досліджень, які проводилися впродовж чотирьох десятиліть, в основному аналізі використовували модель випадкових ефектів з метою отримання оцінки 95% довірчого інтервалу (ДІ) для ефектів цитиколіну порівняно з контролем.
Результати
Характеристики досліджень
Первинний пошук надав 2460 публікацій. Ще 96 записів виявлено за допомогою пошуку в бібліографічній базі даних Ferrer. Видалення дубльованих публікацій загалом залишило 2500 посилань. Після перегляду цитат, тез і повних документів (за наявності) було перевірено 96 публікацій. З них 59 описували дослідження на тваринах або були оглядами. Отже, в підсумку 37 повнотекстових клінічних досліджень оцінили на придатність. Серед цих клінічних випробувань лише 11 відповідали критеріям включення до аналізу.
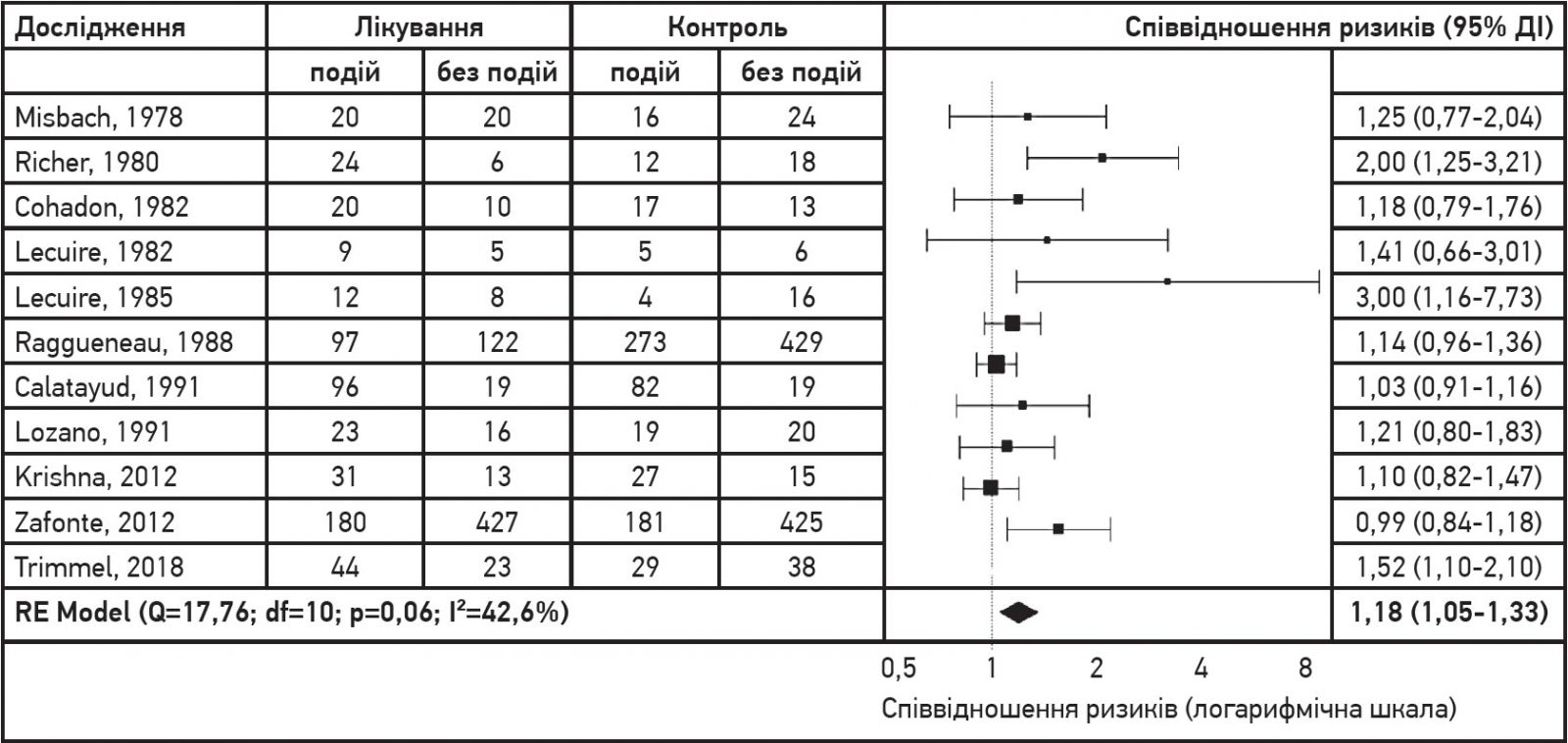
Характеристики досліджень представлено в таблиці. З 11 випробувань 2 були когортними [15, 16], 7 – РКД, у яких порівнювали цитиколін із плацебо чи контрольною групою [17-23], 1 РКД, у якому порівнювали цитиколін із меклофеноксатом [24], ще в 1 РКД порівнювали цитиколін із пірацетамом [25]. У всіх дослідженнях оцінювався вплив цитиколіну на відновлення пацієнтів з ускладненою легкою ЧМТ, середньої тяжкості чи тяжкою ЧМТ. Найстаріше випробування було опубліковано в 1978 році, а останнє дослідження – в 2018 році. Така розбіжність може бути джерелом неоднорідності отриманих результатів через покращення лікування ЧМТ протягом цього періоду, що виправдовує аналіз на основі моделі випадкових ефектів.
|
Таблиця. Характеристики включених до аналізу досліджень, у яких вивчали вплив цитиколіну на функціональні наслідки в пацієнтів із ЧМТ |
||||||
|
Дослідження |
Рік |
n |
Тяжкість ЧМТ |
Контроль |
Доза, спосіб введення |
Оцінюваний результат |
|
Misbach et al. [18] |
1978 |
80 |
від помірної до тяжкої |
плацебо |
300 мг в/в 14 днів |
рівень одужання на 14-й день |
|
Richer et al. [22] |
1980 |
60 |
тяжка |
плацебо |
750 мг в/в або в/м 20 днів |
GOS на 3-й міс |
|
Cohadon et al. [23] |
1982 |
60 |
тяжка |
плацебо |
750 мг в/в або в/м 20 днів |
GOS на 2-й міс |
|
Lecuire et al. [24] |
1982 |
25 |
від помірної до тяжкої |
меклофеноксат |
750 мг в/в 10 днів |
глобальне одужання на 10-й день |
|
Lecuire [25] |
1985 |
40 |
від помірної до тяжкої |
пірацетам |
750 мг в/в 10 днів |
глобальне одужання в 1-й міс |
|
Raggueneau et al. [15] |
1988 |
921 |
тяжка |
контроль |
500-750 в/в 20 днів |
GOS у 1-й міс |
|
Calatayud et al. [19] |
1991 |
216 |
від помірної до тяжкої |
контроль |
3-4 г в/в 4 дні, 2 г п/о 26 днів |
GOS на 3-й міс |
|
Lozano [20] |
1991 |
78 |
від помірної до тяжкої |
контроль |
3-6 г в/в одноразово |
GOS у 1-й міс |
|
Zafonte et al. [17] |
2012 |
1070 |
легка ускладнена, помірна, тяжка |
плацебо |
2 г п/о 90 днів |
GOSе на 6-й міс |
|
Krishna et al. [21] |
2012 |
87 |
від помірної до тяжкої |
плацебо |
2 г п/о 60 днів |
GOS на 90-й день |
|
Trimmel et al. [16] |
2018 |
134 |
тяжка |
контроль |
3 г в/в 21 день |
GOSе на 6-й міс |
До випробування загалом залучили 2771 пацієнта, яким цитиколін застосовувався в дозах від 300 мг до 6 г. Тривалість лікування коливалася від 10 до 90 днів. Препарат вводили внутрішньовенно (в/в) в 6 дослідженнях, в/в або внутрішньом’язово (в/м) – у 2 випробуваннях, в/в із подальшим пероральним прийомом – в 1 дослідженні, лише перорально (п/о) – в 2. В усіх 11 випробуваннях вивчали рівень незалежності пацієнтів, хоча оцінювання проводилося в різний час.
Методологічна якість включених рандомізованих досліджень, за результатами оцінки інструментом RoB2, була досить високою (з низьким ризиком систематичної помилки). Згідно з інструментом оцінки ROBINS-I для нерандомізованих досліджень, 2 випробування, включені до цього метааналізу, мали низький або помірний ризик систематичної помилки. Однією з головних відмінностей між дослідженнями були стандарти лікування ЧМТ, які з часом змінювалися.
Синтез результатів
Оцінки ефекту цитиколіну у вигляді співвідношення ризиків із відповідними довірчими інтервалами представлено на рисунку. Усі результати безпосередньо отримано з оригінальних публікацій. Застосування цитиколіну асоціювалося зі значно вищим рівнем незалежності пацієнтів (RR 1,18; 95% ДІ від 1,05 до 1,33; I2 42,6%). Додатково проведені аналізи OR і RD в обох випадках надали результати, які відповідали отриманому RR (OR 1,56; 95% ДI від 1,15 до 2,12; RD 0,12; 95% ДI від 0,04 до 0,19). Отже, ймовірність сприятливої події (клінічного результату у вигляді незалежності пацієнта) була на 18% вищою за умови застосування цитиколіну. Отриманий показник гетерогенності досліджень I2 був незначним, але значущим (42,6%). Однак оцінки ефекту цитиколіну за моделлю фіксованих ефектів надали схожі результати.
Рис. Результати основного метааналізу на основі моделі випадкових ефектів
Примітка: сумарне співвідношення ризиків (1,18) свідчить про те, що ймовірність клінічного результату у вигляді незалежності пацієнта після ЧМТ була на 18% вищою за умови застосування цитиколіну.
Жоден зі скоригованих аналізів не виявив значущих відмінностей, тому автори не змогли знайти зв’язку між клінічним результатом і дозою цитиколіну чи способом введення препарату.
Значущість впливу цитиколіну на шанси здобуття пацієнтами незалежності зберігалася, коли окремо проаналізували лише результати РКД (RR 1,16; 95% ДІ від 1,01 до 1,33; I2 39,4%). Автори класифікували отримані результати за критеріями GRADE як докази помірної достовірності.
За даними рандомізованих досліджень, не було різниці в рівнях смертності пацієнтів. Тільки в дослідженні Trimmel і співавт. [16] описано значне зниження смертності хворих із тяжкою ЧМТ, які отримували лікування цитиколіном. Окрім того, за результатами жодних із включених досліджень не повідомлено про будь-які серйозні проблеми безпеки, пов’язані з цитиколіном.
Обговорення та висновки
Даний метааналіз показав, що в майже 2800 пацієнтів із ЧМТ у гострій фазі лікування цитиколіном було пов’язане зі значним покращенням рівня незалежності [9]. Результати трактуються як докази помірної достовірності згідно із критеріями GRADE.
З огляду на значний тягар захворювання, пов’язаний із помірною та тяжкою ЧМТ, існує потреба в покращенні підходів до надання допомоги постраждалим пацієнтам. Незважаючи на поліпшення лікування ЧМТ останніми роками, рівень смертності та інвалідизації залишається високим. Запалення, зміни цілісності клітинної мембрани та порушення метаболізму фосфоліпідів залучені до патогенезу ЧМТ. Результати численних досліджень [4, 6] показали, що цитиколін має нейропротекторні та нейровідновлювальні властивості, як-от:
- нормалізація або стабілізація ушкоджених клітинних мембран нейронів (тобто вмісту та функції фосфоліпідів, іонного обміну);
- відновлення деяких ферментативних активностей;
- зменшення утворення шкідливих вільних жирних кислот і вільних радикалів;
- покращення нейротрансмісії та церебрального метаболізму;
- протизапальні й антиоксидантні властивості;
- підвищення цілісності гематоенцефалічного бар’єра;
- прискорене розсмоктування набряку мозку та зменшення об’єму ішемічних уражень;
- пригнічення апоптозу;
- посилення властивостей нейрорепарації та нейропластичності.
Отже, з огляду на його біохімічні, фармакологічні та фармакокінетичні характеристики цитиколін слід розглядати як потенційно корисний препарат для лікування пацієнтів із ЧМТ. Нейропротекторну дію цитиколіну не слід обмежувати хворими із ЧМТ; натомість можна поширити на пацієнтів з іншими неврологічними захворюваннями [8], про що свідчать деякі дослідження, включаючи когнітивні ускладнення, пов’язані з COVID‑19, розсіяний склероз і деменцію [26-28].
Основним обмеженням цього метааналізу була передбачувана неоднорідність включених досліджень [9]. Це стало результатом помітних покращень у веденні пацієнтів із ЧМТ за чотири десятиліття. Старі невеликі випробування можуть переоцінювати розмір ефекту, хоча кількість цих досліджень занадто мала, щоб чинити значний вплив на загальний результат. З іншого боку, цей метааналіз є найбільшим з опублікованих на сьогодні; в ньому аналізувалися рівень незалежності пацієнтів, клінічний результат, який був чітко визначений у включених дослідженнях.
Отже, метааналіз [9] надав нові докази переваг цитиколіну в поєднанні зі стандартом лікування стосовно здобутого рівня незалежності пацієнтів з ускладненою ЧМТ легкого, середнього та тяжкого ступенів. Ця користь не залежить від дози та способу введення цитиколіну.
Експертна думка
Завідувачка кафедри нервових захворювань і нейрохірургії факультету післядипломної освіти Дніпровського державного медичного університету, член-кореспондент НАМН України, доктор медичних наук, професор Людмила Антонівна Дзяк
 – Бойова ЧМТ – пріоритетна та соціально значуща проблема сучасної української медицини. Бойова ЧМТ суттєво відрізняється від побутової травми мирного часу за біомеханізмами, структурою уражень черепа і головного мозку та їхніми наслідками. Вибухи спричиняють ушкодження тіла людини шляхом складної комбінації чинників. Первинне ушкодження є результатом проходження початкової хвилі підвищеного та зниженого тиску через м’які тканини (т. зв. баротравма). Проникні поранення уламками належать до вторинних ушкоджень. Третинне ушкодження виникає унаслідок прискорення та гальмування тіла людини та його зіткнення з іншими об’єктами. Четвертинне ушкодження може бути наслідком термічної травми та вдихання токсичних газів. Найпоширенішими за умов сучасної війни є множинні рани, спричинені фрагментами вибухового пристрою, які зумовлюють ушкодження одразу декількох анатомічних зон. Шляхи поширення вибухової хвилі всередині черепа можуть бути досить складними, а головний мозок реагує на хвилі тиску як неоднорідна маса. Первинна баротравма мозку взагалі маловивчена. Зовнішні ознаки ушкодження, як-от розрив барабанної перетинки, не завжди корелюють з тяжкістю ураження нервових структур. Усе це зумовлює складність бойової ЧМТ як у плані діагностики уражень, так і щодо підходів до лікування та реабілітації.
– Бойова ЧМТ – пріоритетна та соціально значуща проблема сучасної української медицини. Бойова ЧМТ суттєво відрізняється від побутової травми мирного часу за біомеханізмами, структурою уражень черепа і головного мозку та їхніми наслідками. Вибухи спричиняють ушкодження тіла людини шляхом складної комбінації чинників. Первинне ушкодження є результатом проходження початкової хвилі підвищеного та зниженого тиску через м’які тканини (т. зв. баротравма). Проникні поранення уламками належать до вторинних ушкоджень. Третинне ушкодження виникає унаслідок прискорення та гальмування тіла людини та його зіткнення з іншими об’єктами. Четвертинне ушкодження може бути наслідком термічної травми та вдихання токсичних газів. Найпоширенішими за умов сучасної війни є множинні рани, спричинені фрагментами вибухового пристрою, які зумовлюють ушкодження одразу декількох анатомічних зон. Шляхи поширення вибухової хвилі всередині черепа можуть бути досить складними, а головний мозок реагує на хвилі тиску як неоднорідна маса. Первинна баротравма мозку взагалі маловивчена. Зовнішні ознаки ушкодження, як-от розрив барабанної перетинки, не завжди корелюють з тяжкістю ураження нервових структур. Усе це зумовлює складність бойової ЧМТ як у плані діагностики уражень, так і щодо підходів до лікування та реабілітації.
Структурні зміни в нервовій тканині при вибуховій травмі включають ураження мембран, мітохондрій, активних зон аксон-дендритних синапсів, набухання острівців гліальних клітин, розширення міжклітинних просторів, хроматолітичні зміни нейронів та їхній апоптоз, активацію мікроглії, деформацію мієліну. Активація мікроглії й астроцитів спричиняє хронічне запалення та порушення метаболізму, які, своєю чергою, зумовлюють вторинні ушкодження клітинних мембран, мітохондрій, ДНК, дендритів, синапсів нейронів. Наприклад, гіперглікемія, яка виникає протягом декількох хвилин після первинного ушкодження, сприяє утворенню молочної кислоти, метаболічному ацидозу та порушенню метаболізму фосфору, що поглиблює ішемічне ураження тканин головного мозку. Молекули, які сприяють запаленню, зокрема оксид азоту, простагландини, безкисневі радикали, глутамат і цитокіни, руйнують гематоенцефалічний бар’єр, зумовлюють набряк головного мозку.
Незалежно від механізму та обсягу травми перед лікарями постає таке запитання: як захистити нейрони від загибелі? Безумовно, базовими заходами для підтримки життєдіяльності мозку є корекція гемодинаміки, підтримка дихання, моніторування та контроль внутрішньочерепного тиску, корекція глікемії, венозних порушень, усунення набряку мозку. Цитопротекція – важлива складова лікування пацієнтів із ЧМТ, що обґрунтовано впливом на вторинні метаболічні порушення (т. зв. метаболічний хаос). Але серед засобів із заявленими нейропротекторними властивостями незначна кількість має підтверджену клінічну ефективність. До перевірених засобів належить цитиколін, зокрема, представлений в Україні вітчизняним виробником під назвою Нейроксон®. Ефективність цитиколіну добре вивчена при різних захворюваннях та станах у неврології, нейрохіргургії. Уже не перший метааналіз надає переконливі докази ефективності цитиколіну за ЧМТ.
Цитиколін чинить такі ефекти:
- захищає і відновлює клітинні мембрани;
- стимулює холінергічну нейротрансмісію;
- сприяє нейрональному синаптогенезу;
- знижує апоптоз нейронів при ішемії;
- стимулює синтез і гальмує катаболізм мозкових фосфоліпідів;
- захищає від ушкоджень ферменти, які беруть участь в енергетичному обміні мозку;
- збільшує синтез РНК;
- підтримує енергетичний баланс;
- діє синергічно з АТФ.
Доказова база, отримана з контрольованих клінічних досліджень та метааналізів, дозволяє дійти висновку, що призначення препарату Нейроксон® у складі комплексної терапії є доцільним з 1-ї доби в пацієнтів із бойовою ЧМТ.
На відміну від інших цитиколінів, що представлені на ринку України, Нейроксон® – вітчизняний цитиколін, виготовлений із субстанції провідного японського виробника KYOWA HAKKO BIO CO., LTD. Усі форми випуску препарату Нейроксон® мають доведену клінічну ефективність та еквівалентність оригінальному цитиколіну [29-31], що надає впевненості в прогнозованому результаті лікування. Нейроксон® – понад 10 років досвіду та довіри у відновленні мозку.
Список літератури знаходиться в редакції.
Підготував Ігор Петренко
Медична газета «Здоров’я України 21 сторіччя» № 16 (552), 2023 р
СТАТТІ ЗА ТЕМОЮ Неврологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Після десятиліть, а часом і запеклих суперечок про переваги та недоліки застосування глюкокортикоїдів (ГК) досягнута певна конвергенція. Сучасні рекомендації лікування таких захворювань, як ревматоїдний артрит (РА), ревматична поліміалгія (РПМ) та васкуліт великих судин відображають поточний стан консенсусу терапії ГК. Однак залишаються відкритими питання щодо можливості тривалого лікування дуже низькими дозами ГК у пацієнтів із РА, а також успішності пошуку інноваційних ГК (лігандів ГК-рецепторів) із покращеним співвідношенням користь/ризик....
Серед препаратів, які мають велику доказову базу щодо лікування пацієнтів із захворюваннями дихальних шляхів з алергічним компонентом, особливий інтерес становлять антагоністи лейкотрієнових рецепторів (АЛТР). Ці препарати мають хорошу переносимість у дорослих та дітей, а також, на відміну від інгаляційних кортикостероїдів (ІКС), характеризуються високим комплаєнсом, тому посідають чільне місце в лікуванні пацієнтів із респіраторною патологією. У лютому відбувся міждисциплінарний конгрес із міжнародною участю «Життя без алергії International» за участю провідних вітчизняних міжнародних експертів. Слово мав президент Асоціації алергологів України, професор кафедри фтизіатрії та пульмонології Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук Сергій Вікторович Зайков із доповіддю «Місце АЛТР у лікуванні пацієнтів із респіраторною патологією». ...
Розбір клінічного випадку...