24 січня, 2018
Заболевания печени и печеночная дисфункция у больных с сердечной недостаточностью
Тесная связь между сердечной и печеночной дисфункциями изучается врачами разных специальностей на протяжении более чем двух столетий. Тем не менее сложность и особенности этой ассоциации и сейчас вызывают активный интерес ученых, а результаты относительно немногочисленных исследований нередко очень противоречивы, что может объясняться несколькими причинами.
Например, этиология сердечной недостаточности (СН) со временем изменилась. Если раньше СН главным образом была связана с ревматической клапанной болезнью, то сейчас в основном с ишемической кардиомиопатией. Кроме того, исходы СН резко улучшились вследствие эффективности фармакотерапии и широкого проведения трансплантации сердца. Поэтому кардиальный цирроз печени (ЦП), который ранее рассматривался как парадигма ассоциации печени и СН, в настоящее время встречается редко [20].
 В связи с тем что СН является системным хроническим заболеванием, при ее наличии поражается множество органов, включая печень и почки. Особенности сосудистой системы печени и ее высокая метаболическая активность делают ее высоко уязвимой к нарушениям системной гемодинамики и инициируют многие молекулярные и гемодинамические изменения.
В связи с тем что СН является системным хроническим заболеванием, при ее наличии поражается множество органов, включая печень и почки. Особенности сосудистой системы печени и ее высокая метаболическая активность делают ее высоко уязвимой к нарушениям системной гемодинамики и инициируют многие молекулярные и гемодинамические изменения.
Печеночная дисфункция (ПД) часто встречается у пациентов с СН (по данным разных авторов, в 15-65% случаев) и тесно коррелирует с гемодинамическими параметрами [19, 26].
В настоящее время систематизацию сочетанной патологии сердца и печени проводят в зависимости от первичной локализации патологического процесса (табл. 1) [17].
В данном обзоре мы сфокусируемся на основной патологии печени, обусловленной заболеваниями сердечно-сосудистой системы, в первую очередь на застойной гепатопатии (ЗГ) и кардиогенном ишемическом гепатите, а также патологии сердца, сформировавшейся на фоне заболеваний печени (цирротическая кардиомиопатия).
Застойная кардиальная гепатопатия
ЗГ («застойная печень») включает в себя спектр клинических, биохимических, гистологических и гемодинамических нарушений, связанных с хроническим повреждением печени вследствие правожелудочковой/правопредсердной СН или любой другой причины повышения центрального венозного давления, включая бивентрикулярную СН вследствие ишемической болезни сердца или кардиомиопатии, тяжелую легочную гипертензию или легочное сердце, констриктивный перикардит, а также вальвулопатии, такие как митральный стеноз и трикуспидальная регургитация [14, 15]. Это состояние было впервые подробно описано выдающимся гепатологом Шейлой Шерлок в 1951 году [23].
Основными механизмами формирования ЗГ являются переполнение кровью центральных вен и центральной части печеночных долек, развитие в них локальной гипоксии, приводящей к возникновению дистрофических и атрофических изменений, а впоследствии – к некрозу гепатоцитов, синтезу коллагена и развитию фиброза. При этом давление в воротной вене не превышает давления в нижней и верхней полых венах, вследствие чего портокавальные анастомозы развиваются крайне редко [11, 25]. Тяжесть и характеристики повреждения печени зависят от вовлеченных сосудов, выраженности венозного застоя и снижения перфузии. Первое описание «мускатной печени» было сделано Kiernan и Mallory, которые показали центральный застой и очаговый некроз печени, связанные с нарушенной циркуляцией крови в печени [9].
Клинические проявления ЗГ зависят от скорости нарастания СН: если венозный застой в печени развивается быстро, то в клинике будут доминировать жалобы на острые боли в правом подреберье, связанные с растяжением капсулы печени, нередко симулирующие острую хирургическую патологию. Если СН развивается медленно, в течение нескольких месяцев или лет, то ее проявления будут доминировать и маскировать симптоматику ЗГ. Последний вариант встречается значительно чаще, поэтому в подавляющем большинстве случаев ЗГ протекает малосимптомно или асимптомно [11]. В таких случаях пациенты предъявляют жалобы на одышку, ортопноэ и кардиалгии, практически не обращая внимания на тяжесть в правом подреберье и изменение цвета кожных покровов, поскольку желтуха и болевой синдром малоинтенсивны. Объективные признаки ЗГ (увеличенная, плотная и болезненная при пальпации печень с твердым и гладким краем) определяются на фоне расширения яремных вен, появления гепатоюгулярного рефлюкса и симптомов СН.
Отличительной чертой ЗГ является то, что выраженность ее симптоматики варьирует в зависимости от состояния центральной гемодинамики и эффективности лечения основной причины СН. Адекватная терапия СН приводит к быстрому уменьшению размеров печени и нивелированию клинических признаков ЗГ [2]. Еще одна характерная особенность ЗГ состоит в отсутствии признаков портальной гипертензии (варикозное расширение вен пищевода и желудка, «caput medusaе») и так называемых малых признаков цирроза (пальмарная эритема, телеангиэктазии, «лакированный» язык) [25]. При тяжелом или рефрактерном течении СН явления ЗГ прогрессируют, и постепенно развивается кардиальный ЦП, сопровождающийся появлением асцита и спленомегалии. Печень становится плотной, ее край – острым, а размеры остаются постоянными и не зависят от эффективности лечения СН [26].
В большинстве случаев при легкой СН уровни сывороточных трансаминаз (АлАт, АсАт) и билирубина не превышают нормальных показателей, однако при тяжелой СН активность маркеров цитолитического и холестатического синдромов, а также уровень билирубина обычно возрастают. Примерно у 30% пациентов с ЗГ уровень трансаминаз превышает норму в 2-3 раза [6]. Значительное снижение фракции выброса (ФВ) обычно сопровождается существенным повышением уровня сывороточных трансаминаз вследствие вторичной ишемии печени [25]. У части больных отмечается холестатический компонент, отражающийся в повышении уровня γ-глютамилтрансферазы (ГГТ) и щелочной фосфатазы, являющихся независимыми факторами венозного застоя и снижения перфузии.
В частности, повышение уровня ГГТ не только ассоциируется с более тяжелым классом СН, более низкой ФВ и повышением уровня натрийуретического гормона В-типа, но и является независимым предиктором смерти и трансплантации сердца [19]. Гипербилирубинемия для ЗГ не характерна, однако при тяжелой СН может отмечаться небольшое повышение уровня общего и непрямого билирубина, что рассматривается как неблагоприятный прогностический признак [24]. При развитии кардиального цирроза появляется диспротеинемия (снижение концентрации общего белка и альбумина, повышение уровня α2- и γ-глобулинов), в 75% случаев увеличивается протромбиновое время. Характерными признаками асцита, развивающегося вследствие ЗГ и кардиального цирроза, являются высокое содержание белка в асцитической жидкости (>2,5 г/дл) и увеличение значения сывороточно-асцитического градиента альбумина (>1,1 г/дл) [6]. У многих больных, особенно с тяжелой СН, повышается уровень мочевой кислоты, что в настоящее время рассматривается как маркер воспаления, метаболических расстройств, оксидативного стресса, эндотелиальной дисфункции и, возможно, миокардиального повреждения. Гиперурикемия может быть следствием снижения ренальной перфузии и экскреции уратов, она хорошо коррелирует с более высоким давлением в легочной артерии и правом желудочке, а также с клиническими признаками застойной СН [3].
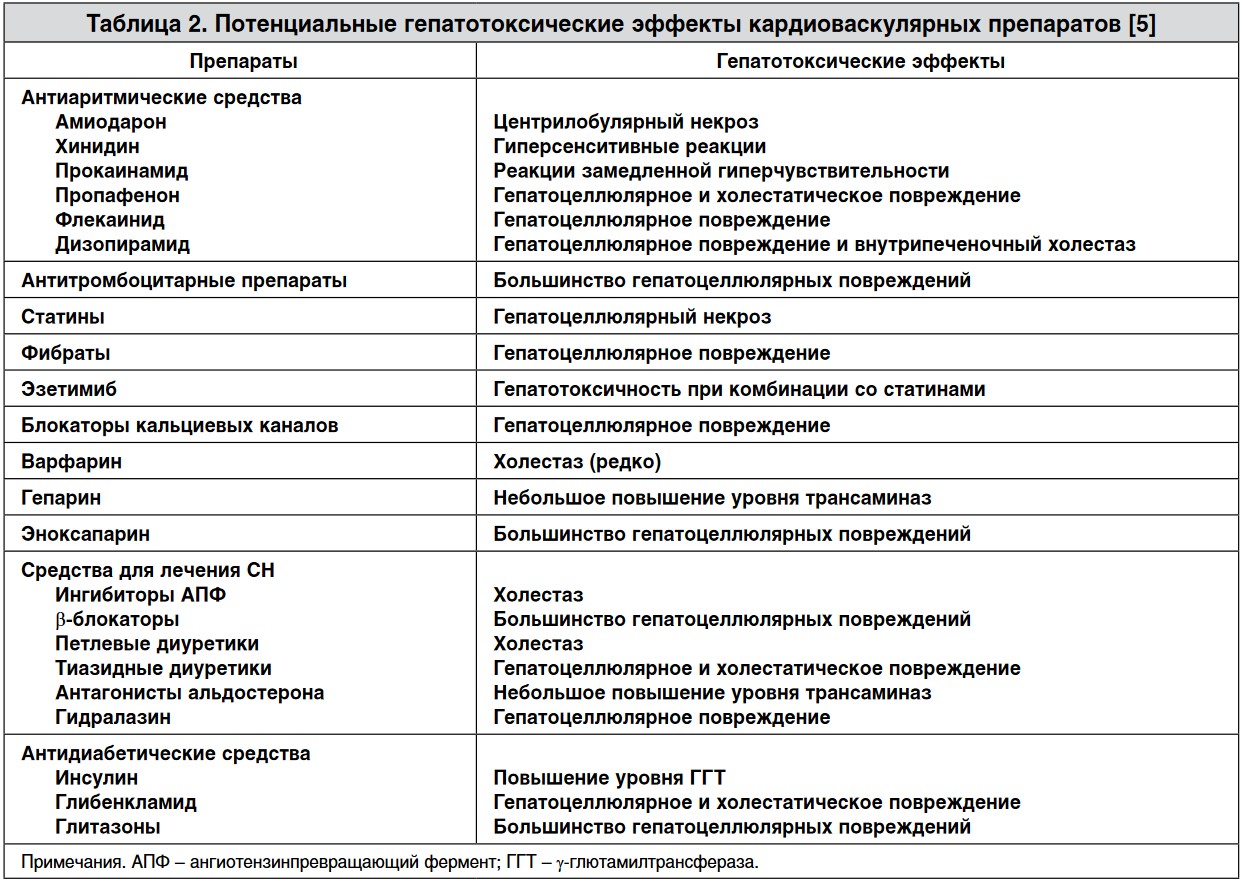
Для подтверждения диагноза ЗГ необходимо исключение других причин повреждения печени, в частности исключение наличия вирусного гепатита В и С при помощи иммуноферментного анализа или полимеразной цепной реакции, а также алкогольной болезни печени, неалкогольной жировой болезни печени / неалкогольного стеатогепатита и медикаментозного повреждения печени. Следует помнить, что многие медикаменты, применяющиеся для лечения кардиоваскулярной патологии, метаболизируются в печени и могут неблагоприятно воздействовать на нее (табл. 2).
Всем больным проводят эхокардиографию и ультразвуковое исследование с допплерографией сосудов печени, при котором хорошо выявляется венозный застой (расширенные печеночные вены, сливающиеся в расширенную нижнюю полую вену), как правило, при отсутствии портальной гипертензии (диаметр портальной вены <13 мм), а также отек стенки желчного пузыря (при развитии кардиального цирроза). Кроме того, допплерография сосудов печени позволяет исключить альтернативные диагнозы, такие как синдром Бадда-Киари.
В тяжелых диагностических случаях для верификации ЗГ проводят лапароскопию, при которой визуализируется увеличенная печень с закругленным краем и утолщенной капсулой, а поверхность печени имеет характерный вид «мускатного ореха» с наличием темно-красных и коричнево-желтых участков [26].
Рутинная биопсия печени не показана, в основном она проводится у кандидатов на трансплантацию сердца при наличии асцита для исключения ЦП. Гистологически ЗГ характеризуется венозным застоем в области синусоид, полнокровием центральных отделов дольки, расширением пространств Диссе, атрофией и некрозом центрилобулярной зоны. Характерным признаком ЗГ является отсутствие патологических изменений на периферии дольки, поскольку венозный застой не достигает этой зоны, а приток артериальной крови из печеночной артерии защищает гепатоциты от повреждения и приводит к их гипертрофии. Также характерной особенностью ЗГ является обратимость венозного полнокровия, а иногда и фиброза при условии адекватного лечения СН [25, 26].
Краеугольным камнем лечения ЗГ является эффективное этиотропное и патогенетическое лечение сопутствующей кардиоваскулярной патологии и легочно-сердечной недостаточности, что сопровождается быстрой регрессией клинических и биохимических проявлений ЗГ, что было впервые описано Jolliffe и соавт. еще в начале 1930-х годов [12]. При назначении ингибиторов АПФ, являющихся препаратами первой линии лечения СН, следует помнить, что они почти все (за исключением лизиноприла), подвергаются метаболизации в печени, а при наличии ЗГ и ПД могут иметь место замедленная трансформация пролекарства в активное вещество и инактивация активного препарата, что требует частого мониторирования дозировки. Это также касается и ингибиторов рецепторов ангиотензина II, за исключением валсартана и ирбесартана, а также большинства неселективных и селективных β-адреноблокаторов [5, 18]. Петлевые диуретики (фуросемид, торасемид) в большинстве случаев эффективно уменьшают венозный застой в печени, способствуя уменьшению и исчезновению асцита и желтухи. Тем не менее эти препараты при ЗГ надо применять с осторожностью во избежание дегидратации, гипотензии и ишемии печени, включая некроз 3-й зоны печеночной дольки. При необходимости применения дигоксина его также нужно назначать осторожно и в низкой дозе, поскольку у больных с ЗГ вероятность проявления его токсических эффектов усиливается.
Антикоагулянты также следует применять крайне осторожно, поскольку у больных с ЗГ повышено протромбиновое время и нередко отмечается повышенная чувствительность к варфарину. При необходимости назначения амиодарона, несмотря на то что он подвергается интенсивной печеночной метаболизации, снижение дозы, как правило, не требуется. Статины сами по себе могут вызывать гипертрансаминаземию, однако они противопоказаны только при повышении уровня АсАт и АлАт более чем в 3 раза [6, 20].
В рефрактерных случаях применяют лапароцентез, однако следует помнить, что он сопровождается потерей белка и способен ухудшить нутритивный статус больных СН, который и без того нарушен. Проведение трансюгулярного внутрипеченочного шунтирования или перитонеально-сосудистого шунтирования у таких больных противопоказано, поскольку всегда приводит к утяжелению класса СН [6].
Пациенты, рефрактерные к медикаментозному лечению, являются кандидатами на трансплантацию сердца или имплантацию вспомогательного устройства в левый желудочек (ЛЖ) [8, 21].
Назначение гепатопротекторов больным ЗГ может быть целесообразным только при выраженном цитолитическом синдроме и развитии кардиального ЦП [20].
Сама по себе ЗГ крайне редко прогрессирует в классическую печеночную недостаточность и является непосредственной причиной смерти. В подавляющем большинстве случаев летальный исход наступает вследствие основной кардиоваскулярной патологии.
В ряде случаев у больных ЗГ может быть целесообразным назначение гепатопротекторов [20].
Гепатопротекторы, влияющие на структуру и функцию клеток гепатоцитов, являются основой патогенетической терапии при патологии печени. Действие гепатопротекторов направлено на восстановление гомеостаза в печени, повышение ее устойчивости к действию патогенных факторов, нормализацию функциональной активности и стимуляцию в печени процессов регенерации. На фармацевтическом рынке в настоящее время присутствует большое количество средств, представляемых как гепатопротекторы, и бытует мнение, что любое из них априори эффективно и безопасно. На самом деле клиническая эффективность многих известных и давно применяющихся гепатопротекторов не доказана. Более того, некоторые из них являются потенциально вредными и способны оказывать гепатотоксический эффект. Особенно это касается гепатопротекторов растительного происхождения и многочисленных широко рекламируемых пищевых добавок.
В отношении многих гепатопротекторов проведены лишь единичные рандомизированные клинические исследования (либо их нет вовсе), причем в этих исследованиях обнаружено отсутствие или слабое влияние таких препаратов на важные параметры (исчезновение виремии, гистологическая картина и выживаемость), несмотря на некоторое снижение активности ферментов печени и улучшение субъективных показателей. Доказанной в различной степени эффективностью обладают такие гепатопротекторы, как урсодезоксихолевая кислота (УДХК), эссенциальные фосфолипиды, препараты аминокислот (адеметионин, орнитина аспартат). Препараты силимарина следует рассматривать как гепатопротекторы с предполагаемой, но недоказанной эффективностью, которые могут применяться при определенных состояниях. Другие растительные гепатопротекторы пока нельзя рекомендовать для широкого применения при хронических заболеваниях печени, поскольку их эффективность не доказана и требует дальнейшего изучения в тщательно спланированных рандомизированных исследованиях.
В терапии заболеваний печени из препаратов, имеющих доказательную базу эффективности и безопасности, большое значение имеет УДХК – гидрофильная нетоксичная третичная желчная кислота, образующаяся под действием бактериальных ферментов из 7-кето-литохолевой кислоты, которая поступает в печень из тонкой кишки.
Механизмы действия УДХК многообразны и пока окончательно не изучены. Накопленные на сегодняшний день экспериментальные и клинические данные свидетельствуют о том, что УДХК оказывает гепатопротекторный, антихолестатический, иммуномодулирующий, гипохолестеринемический, литолитический и антиапоптический эффекты. УДХК применяют при острых и хронических гепатитах различной этиологии, неалкогольном стеатогепатите, первичном билиарном циррозе, гепатопатии беременных, заболеваниях печени, сопровождающихся или вызванных холестазом.
С учетом темы, которая рассматривается в этой статье, интересны данные, свидетельствующие о положительном влиянии УДХК на соотношение сывороточных маркеров фиброгенеза и фибролиза. Так, в исследовании Holoman (2000) на фоне применения УДХК снижалась сывороточная концентрация N-терминального пептида коллагена 3 типа и матриксных металлопротеиназ и одновременно повышался уровень их тканевых ингибиторов. Длительный прием УДХК в дозе 12-15 мг/кг/сут на протяжении 6-12 мес сопровождался достоверным улучшением гистологической картины и биохимических печеночных показателей.
Таким образом, решение о выборе гепатопротектора следует принимать, основываясь на тех же принципах, что и при подборе кардиологических препаратов, то есть на принципах доказательной медицины.
Кардиогенный ишемический гепатит
Кардиогенный ишемический гепатит (КАГ), или «шоковая печень», – гипоксическое повреждение печени, развивающееся при неадекватной ее перфузии и приводящее к некрозу гепатоцитов центрилобулярной зоны [4, 7, 22]. Формирование КАГ возможно только при сочетании нескольких патологических факторов (значительная гипоперфузия, нарушение функционирования сосудистых коллатералей, неспособность печени увеличить потребление кислорода), поскольку особенности кровоснабжения печени изначально препятствуют развитию ее ишемического повреждения. Комбинация указанных факторов имеет место при острой СН, преимущественно правожелудочковой, индуцированной острым инфарктом миокарда, острыми нарушениями ритма, тромбоэмболией легочной артерии, острым легочным сердцем, а также при кровопотере, расслаивающей аневризме аорты, синдроме длительного сдавливания, септическом или ожоговом шоке, тепловом ударе, отравлении углекислым газом и др. Частота развития КАГ у реанимационных больных колеблется от 11 до 22%. В 70% случаев основной причиной КАГ является кардиоваскулярная патология, в 30% – острая дыхательная недостаточность, сепсис и другие более редкие состояния [10].
Диагноз КАГ базируется на трех основных критериях: 1) быстром развитии патологии печени на фоне типичных проявлений кардиогенного или циркуляторного шока; 2) значительном (>20 норм), но быстро обратимом повышении уровня сывороточных трансаминаз; 3) отсутствии других возможных причин повреждения печени [10]. Клинически КАГ манифестирует появлением выраженной одышки, боли в правом подреберье, увеличением печени в размерах. В редких случаях могут отмечаться желтуха, олигурия, признаки печеночной энцефалопатии, вплоть до печеночной комы. Характерные изменения функциональных проб печени появляются через 12-24 ч после острого сердечно-сосудистого события и проявляются резким (в 20 раз и более) повышением уровней АсАт, АлАт и лактатдегидрогеназы, реже – гипербилирубинемией и коагулопатией (удлинение протромбинового времени, снижение уровня фибриногена, тромбоцитопения). При устранении действия провоцирующего фактора показатели возвращаются к норме в течение 5-10 дней [4].
Основной стратегией лечения КАГ является восстановление адекватной перфузии печени путем проведения противошоковых мероприятий, обязательного введения средств, обладающих положительным инотропным эффектом, таких как дофамин. При развитии печеночной энцефалопатии применяют L-аргинин, L-орнитин-L-аспартат, антибиотики. Прогноз при КАГ определяется кардиоваскулярным статусом пациента, поскольку смертность при этом заболевании обусловливается основным заболеванием [4].
Цирротическая кардиомиопатия
Под термином «цирротическая кардиомиопатия» (ЦК) принято понимать снижение сократительной функции сердца, которая отмечается у части больных с ЦП [1]. Первоначальные исследования в начале 1950-х годов зафиксировали существование при циррозе гипердинамического типа гемодинамики, что проявляется в увеличении сердечного выброса и снижении системного сосудистого сопротивления. H.J. Kowalski первым сообщил, что пациенты с циррозом Лаэннека имели аномальную сердечно-сосудистую функцию и удлинение интервала QT [13]. Ранние гистологические исследования продемонстрировали гипертрофию миокарда и его ультраструктурные изменения, включая отек кардиомиоцитов, фиброз, экссудацию, ядерную вакуолизацию и необычную пигментацию.
Размер левого предсердия и ЛЖ у пациентов с ЦП нормальный или несколько увеличен, что связано с гемодинамической дисфункцией [16]. Многие пациенты с ЦП отмечают одышку, задержку жидкости и ограничение физической активности.
Основными механизмами развития ЦК являются хронический алкоголизм и гипердинамический тип гемодинамики. Вследствие злоупотребления алкоголем ухудшается синтез сократительных белков и формирование связи сердечных белков с токсичным ацетальдегидом, что способствует ухудшению сердечной функции. При гипердинамическом типе гемодинамики сердце постоянно перегружено из-за повышенных сердечного выброса и объема циркулирующей крови, что также приводит к нарушению его сократительной функции. Другими потенциальными механизмами ухудшения сердечной функции при ЦП являются повышенная продукция таких кардиодепрессивных субстанций, как эндотоксины, эндотелины, цитокины и желчные кислоты, а также нарушение регуляторной функции β-рецепторов, функционирования мембранных калиевых и кальциевых каналов, активация каннабиоидной системы [1, 16].
Физические упражнения, фармакологический стресс и терапевтические мероприятия способны повлиять на изменение давления в полостях сердца. В частности, у больных ЦП конечно-диастолическое давление увеличивается, а ФВ во время физической нагрузки падает, что указывает на аномальный желудочковый ответ на повышение желудочкового давления наполнения. Аэробные физические нагрузки и максимальная частота сердечных сокращений у большинства пациентов с циррозом должны быть меньшими по сравнению с таковыми у пациентов без цирроза. Аномальная диастолическая функция ЛЖ, вызванная снижением его релаксации, отражается в нарушении наполнения желудочков. Трансмитральный кровоток изменяется, при этом повышается вклад предсердий в позднюю фазу наполнения ЛЖ. Патофизиологической основой диастолической дисфункции при ЦП является повышенная жесткость стенки миокарда, скорее всего, из-за сочетания небольшой гипертрофии миокарда, фиброза и субэндотелиального отека [16].
Основным электрокардиографическим изменением при ЦП является удлинение интервала QT, скорректированного по частоте сердечных сокращений, что отмечается примерно у каждого второго пациента с ЦП и не зависит от его этиологии [1]. У больных алкогольным ЦП удлинение интервала QT связано с повышением риска внезапной сердечной смерти. Удлинение интервала QT при циррозе также ассоциируется с наличием кардиальной автономной дисфункции, в первую очередь со снижением барорецепторной чувствительности, и частично обратимо после трансплантации печени [16].
Специфического лечения ЛЖ-дисфункции, связанной с ЦП, в настоящее время не существует. Поэтому терапия проводится по общим правилам путем ограничения соли, приема диуретиков и снижения постнагрузки. Назначение сердечных гликозидов не способствует существенному улучшению сократительной функции сердца при ЦК, в связи с чем они не рассматриваются как значимые препараты для ее лечения. Следует проявлять особую осторожность во время и после стрессовых событий, в первую очередь хирургических операций, включая трансюгулярное внутрипеченочное шунтирование и трансплантацию печени. Влияние удлиненного интервала QT на смертность больных ЦП является предметом будущих исследований. Принципиально новые методы лечения ЦК, такие как антицитокиновая терапия, также представляют большой интерес [16].
В заключение отметим, что вопросы, обсуждаемые в данной статье, имеют важное клинические значение как для гастроэнтерологов, так и для кардиологов. В частности, гастроэнтерологи, консультирующие больных с «необъяснимым» повышением трансаминаз или так называемыми идиопатическими ЦП, всегда должны помнить о потенциальной роли СН, даже латентно протекающей, и назначать соответствующее кардиологическое обследование. В свою очередь, кардиологи, наблюдающие пациентов с СН, у которых имеется сопутствующая ПД, должны рассматривать последних как группу повышенного риска и лечить более агрессивно. Надеемся, что дальнейшие исследования и более активное выявление ПД при СН поможет улучшить общее понимание патологического процесса, а также результаты лечения и клинические исходы при этом заболевании.
Литература
1. Al.-Hamoudi W., Lee S.S. Cirrhotic cardiomyopathy. Ann. Hepatol. 2006; 5: 132-9.
2. Allen L., Felker G., Pocock S., et al. Liver function abnormalities and outcome in patients with chronic heart failure: data from the Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity(CHARM) program. Eur. J. Heart Failure, 2009; 11 (2): 170-177. doi: 10.1093/eurjhf/hfn031.
3. Amin A., Vakilian F., Maleki M. Serum uric acid levels correlate with filling pressures in systolic heart failure. Congest Heart Fail. 2011; 17: 80-4.
4. Birrer R., Takuda Y., Takara T. Hypoxic hepatopathy: pathophysiology and prognosis. Intern. Med. 2007; 46 (14): 1063-1070. doi: 10.2169/internalmedicine.46.0059.
5. Bhardwaj S.S., Chalasani N.P. Hepatotoxicity of cardiovascular and antidiabetic medications. In: Drug-Induced Liver Disease. 2nd edn. New York, London: Informa Health Care, 2007: 593-631.
6. Cogger V.C., Fraser R., Le Couteur D.G., et al. Liver dysfunction and heart failure. Am. J. Cardiol. 2003; 91: 1399.
7. Denis C., De Kerguennec C., Bernuau J., et al. Acute hypoxic hepatitis (‘liver shock’): still a frequently overlooked cardiological diagnosis. Eur. J. Heart Fail. 2004; 6: 561-5.
8. Dichtl W., Vogel W., Dunst K., et al. Cardiac hepatopathy before and after heart transplantation. Transpl. Int. 2005; 18 (6): 697-702. doi: 10.1111/j.1432-2277.2005.00122.x.
9. Friedman L.S. Congestive Hepathopathy. 2010. Version 17.2. http://www.uptodate.com/css/ amages/ui-icones (accessed Jul 2010).
10. Fuhrmann V., Jager B., Zubkova A., Drolz A. Hypoxic hepatitis – epidemiology, pathophysiology, and clinical management. Wien Klin. Wochenschr. 2010; 122 (5-6): 129-139. doi: 10.1007/s00508-010-1357-6.
11. Giallourakis C., Rosenberg P., Friedman L. The liver in heart failure. Clin. Liver Dis. 2002; 6 (4): 947-967.
12. Jolliffe N. Liver function in congestive heart failure. J. Clin. Invest. 1930; 8 (3): 419-434. doi: 10.1172/JCI100272.
13. Kowalski H.J., Abelmann W.H. The cardiac output at rest in Laennnecs cirrhosis. J. Clin. Invest. 1953; 32: 1025e33.
14. Megalla S., Holtzman D., Aronow W.S., et al. Prediction of cardiac hepatopathy in patients with right heart failure. Med. Sci Monit. 2011; 17 (10): 537-541.
15. Moller S., Dumcke C., Krag A. The heart and the liver. Expert Rev. Gastroenterol & hepatol. 2009; 3 (1): 51-64. doi:10.1586/17474124.3.1.51.
16. Mоller S., Henriksen J.H. Cirrhotic cardiomyopathy. J. Hepatol. 2010; 53: 179-90.
17. Naschitz J., Slobodin G., Lewis R., et al. Heart diseases affecting the liver and liver diseases affecting the heart. Am. Heart J. 2000; 140 (1): 111-120. doi: 10.1067/mhj.2000.107177.
18. Pfeffer M., Swedberg K., Granger C., et al. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme. Lancet, 2003; 362 (9386): 759-766. doi: 10.1016/S0140-6736(03)14282-1.
19. Poelzl G., Eberl C., Achrainer H., et al. Prevalence and prognostic significance of elevated-glutamyltransferase in chronic heart failure. Circ. Heart Fail. 2009; 2: 294-302.
20. Ren X., Oei H.H., Pearlman J.D. Cardiac Cirrhosis and Congestive Hepatopathy Treatment and Management. http://emedicine.medscape.com/article/151792-overview (accessed 20 Aug 2010).
21. Russell S., Rogers J., Milano C., et al. Renal and hepatic function improve in advanced heart failure patients during continuous flow support with HeartMate II left ventricular assist device. Circulation, 2009; 120 (23): 2352-2357. doi: 10.1161.
22. Saner F.H., Heuer M., Meyer M., et al. When the heart kills the liver: acute liver failure in congestive heart failure. Eur. J. Med. Res. 2009; 14 (12): 541-546. doi: 10.1186/2047-783X‑14-12-541.
23. Sherlock S. The liver in heart failure: relation of anatomical, functional, and circulatory changes. Br. Heart J. 1951; 13: 273-293.
24. Shinagava H., Inomata T., Koitabashi T., et al. Increased serum bilirubin levels coincident with heart failure decompensation indicate the need for intravenous inotropic agents. Int. Heart J. 2007; 48: 195-204.
25. Van Deursen V., Damman K., Hillege H., et al. Abnormal liver function in relation to hemodynamic profile in heart failure patients. J. Card. Fail. 2010; 16 (1): 84-90. doi: 10.1016/j.cardfail.2009.08.002.
26. Wong F., Greenbloom S., Blendis L. The liver in heart failure. In: Friedman L., Keeffe E. Handbook of Liver Disease. 2nd ed. Churchill Livingstone, 2004.
Журнал "Серцева недостатність та коморбідні стани" № 3, грудень 2017 р.