14 січня, 2021
Нейроендокринні порушення при COVID‑19 і постковідному синдромі й перспективи застосування препаратів -аміномасляної кислоти
 Наприкінці 2019 р. людство раптово зіштовхнулося із загрозливою проблемою – новою коронавірусною хворобою (COVID‑19), спричиненою тяжким гострим респіраторним синдромом коронавірусу‑2 (SARS-CoV‑2). Цей вірус належить до групи РНК-вірусів і дуже швидко поширюється серед людей, що спричинило глобальну пандемію.
Наприкінці 2019 р. людство раптово зіштовхнулося із загрозливою проблемою – новою коронавірусною хворобою (COVID‑19), спричиненою тяжким гострим респіраторним синдромом коронавірусу‑2 (SARS-CoV‑2). Цей вірус належить до групи РНК-вірусів і дуже швидко поширюється серед людей, що спричинило глобальну пандемію.
Репродукція вірусу SARS-CoV‑2 відбувається в епітеліальних клітинах слизової оболонки верхніх дихальних шляхів, тобто в місці його первинного проникнення в організм людини; супроводжується появою характерних внутрішньоплазматичних включень, що мають рибонуклеїнову кислоту. Уражені клітини здебільшого дегенерують, відбувається їх відторгнення. Водночас спостерігаються проліферація та метаплазія циліндричного епітелію.
Відомо, що патогенність вірусу SARS-CoV‑2 переважно проявляється його нейро- й епітеліотропністю, а також токсичністю, що спричиняє циркуляторні розлади різних органів [6, 12, 13, 17, 20-22, 27, 53, 57]. Насамперед відбувається ураження головного мозку та легень, що супроводжується судинними стазами, мілкими тромбозами і крововиливами, дистрофічними змінами клітин, їхньою дегенерацією й апоптозом [5, 6, 9, 12, 17, 20, 21, 28]. Інтоксикація є типовою клінічною особливістю COVID‑19. Основне місце токсичної дії вірусу SARS-CoV‑2 в організмі – нервова система (центральна та вегетативна), а також кровоносні судини; це призводить до синдрому різних системних і респіраторних симптомів, а також до синдрому дисемінованого внутрішньосудинного згортання (ДВЗ) (лихоманка, втома, слабкість, сухий кашель, утруднене дихання, задуха, які іноді можуть бути критичними), спричиняючи тяжку пневмонію та серцево-дихальну недостатність [6, 21, 39, 41, 54, 61].
Останні дані спостережень клініцистів і наукових досліджень свідчать, що вірус SARS-CoV‑2 проявляє нейротропні властивості та зумовлює неврологічні захворювання й ускладнення [6, 20-23, 31, 34, 36, 39, 60, 61]. Дедалі частіше надходять повідомлення про пацієнтів з COVID‑19, у яких розвивається енцефалопатія та з’являються симптоми, схожі на симптоми в разі синдрому Гійєна-Барре. Беручи до уваги довготривалу глобальну пандемію COVID‑19 та описи неврологічних проявів при SARS-CoV‑2, з’являється потреба надати додаткову й необхідну клініцистам інформацію щодо ураження нервової системи (як центральної, так і периферичної) з пропозицією доцільного лікування та профілактики ускладнень цих порушень і тяжкого перебігу коронавірусної хвороби.
Вважають, що вірус SARS-CoV‑2 проникає у центральну нервову систему (ЦНС) із периферичних нервових закінчень через нервові шляхи. Існують дані про наявність генетичного матеріалу SARS-CoV‑2 та білків у зразках тканин нервової системи. Це свідчить, що вірус може безпосередньо дістатися нервової системи та ушкодити нервові клітини і волокна. Вірус спричиняє перебільшену імунну відповідь, що атакує нервову систему; така ситуація спостерігається в багатьох пацієнтів з тяжким перебігом COVID‑19, у котрих розвивається синдром цитокінового шторму, що є станом гіперзапалення і характеризується фульмінантною гіперцитокінемією, яка зумовлює поліорганну недостатність із загрозою для життя людини [5, 6, 35, 57]. Серед цих цитокінів відзначається підвищення інтерлейкіну‑6 (ІЛ‑6); його рівень позитивно корелює з вираженістю симптомів COVID‑19. Відомо, що ІЛ‑6 – важливий протизапальний медіатор, який потенційно відповідає за активацію імунних клітин мозку та травмування мозкової тканини. Також звертається увага на виправдану гіпотезу, що спайковий протеїн SARS-CoV‑2 має високу спорідненість до рецептора ангіотензинперетворювального ферменту‑2 (АПФ‑2). Рецептори АПФ‑2 експресуються в ендотелії капілярів, включаючи мозок, до яких вірус може отримати доступ через гематоенцефалічний бар’єр і завдати шкоди нервовій системі [6, 23, 35, 55].
Повідомлялося, що гліальні клітини та нейрони головного мозку також експресують рецептори АПФ‑2, що робить їх потенційною мішенню для вірусу SARS-CoV‑2. Оскільки АПФ‑2 мають судинозвужувальні властивості та протизапальну дію, то, можливо, їх залучення в мозок при зараженні SARS-CoV‑2 спричиняє порушення авторегуляції та стрибки артеріального тиску з подальшим розривом артеріальної стінки, що може бути патофізіологічними особливостями внутрішньочерепної кровотечі, яка часто спостерігається при COVID‑19 [55]. Однак нерідко з’являється й ішемічний інсульт у пацієнтів, інфікованих SARS-CoV‑2, який можна пояснити дисфункцією ендотелію та підвищенням згортання крові, про що свідчить збільшення концентрації D-димеру і С-реактивного білка, а також тромбоцитоз. Інша гіпотеза тлумачить, що тяжка гіпоксія, що з’являється внаслідок гострого респіраторного дистрес-синдрому та пневмонії, спричиняє набряк мозку й ішемічний інсульт на тлі згущення крові та тромбоцитозу [6, 11, 12, 15, 17].
Отже, існує декілька гіпотез щодо того, як вірус SARS-CoV‑2 впливає на нервову систему. Це може бути і пряма інвазія SARS-CoV‑2 у нервову систему (центральну та периферичну), що підтверджується наявністю вірусного білка в лікворі деяких пацієнтів з COVID‑19 з розвитком енцефаліту. Також шлях інвазії може бути як ретроградним рухом через нюховий нерв, так і гематогенним шляхом завдяки наявності рецепторів АПФ‑2 в мозку, що може полегшити інтеграцію вірусу через кровообіг мозку. Інший можливий шлях інвазії вірусу SARS-CoV‑2 – через гіперактивацію імунної відповіді на ініціацію гіперзапалення з поліорганною недостатністю, що називається синдромом цитокінового шторму [55]. Однак точний патогенетичний механізм ураження нервової системи та виникнення ускладнень, що впливають на тяжкість перебігу хвороби, з подальшим розвитком постковідного синдрому (ПКС) не до кінця зрозумілий і потребує продовження спостережень та досліджень.
Клініцистами та науковцями надано багато інформації про зв’язок між інфекцією SARS-CoV‑2 та ураженням нервової системи; ця асоціація може відбуватися незалежно від участі дихальної системи. Частіше така ситуація спостерігається в пацієнтів із супутніми захворюваннями та наявністю факторів ризику, з яких насамперед спостерігаються порушення гомеостазу енергії та глюкози [5-7, 15, 32, 41, 48, 49].
Визначено, що вірус SARS-CoV‑2 має беззаперечні неврологічні ефекти. Однак досі остаточно не з’ясовано, як насправді відбувається ураження нервової системи та якими є механізми дегенерації нервових клітин. Найімовірніше, що новий коронавірус безпосередньо атакує нервову систему; це підтверджено проведеними дослідженнями, які надають докази, що SARS-CoV‑2 може проникати в нервові клітини та мозок [6, 9, 12, 15, 19, 20-23, 28, 51]. Залишається питання щодо того, чи відбувається це регулярно, або лише в найтяжчих випадках, або на тлі хронічних захворювань. Однак відомо, що як у пацієнтів молодого віку, так і у хворих старшого віку можуть проявлятися симптоми ураження нервової системи з однаковою інтенсивністю.
Експертами з COVID‑19 відзначається, що в той час, як імунна система починає працювати з перевантаженням, з’являється імовірність появи негативно прогресуючих наслідків, що змушує імунні клітини діставатися мозку й зумовлювати автоімунний процес, додатковий апоптоз і загибель нейронів зі шкодою для здоров’я людини та з розвитком тяжких неврологічних ускладнень, зокрема хвороби Альцгеймера чи Паркінсона, дисемінованого енцефаломієліту або ішемічного інсульту тощо [5, 8-10, 21, 23, 29].
Багато симптомів, що характерні інфікуванню вірусом SARS-CoV‑2, пов’язані з ураженням нервової системи [5, 6, 8-10, 21, 23, 29, 51, 57, 58, 59, 61]. Неврологічні прояви COVID‑19 можна умовно розподілити на симптоми ураження ЦНС і периферичної нервової системи (ПНС). До проявів ураження ЦНС належать скарги на головний біль (часто дуже сильний), підвищену втомлюваність, «мозковий туман» і періодичне короткочасне запаморочення, зміни психічного стану та когнітивних функцій, порушення сну (безсоння вночі й сонливість удень), а також дезорієнтацію. Ураження ПНС проявляється аносмією і гіпогевзією, болем у горлі, м’язах і суглобах, міофасціальними болями, гіперестезією шкіри, вираженою слабкістю, а в деяких чоловіків, інфікованих вірусом SARS-CoV‑2, спостерігався біль у яєчках і внутрішніх ділянках стегон. Сильний кашель, що частково спричиняється сенсорними нервовими клітинами в легенях, також є проявом ураження ПНС. Деякі пацієнти мають серйозні проблеми з болями, що схожі на невропатію. В тяжких випадках прояву COVID‑19 іноді спостерігалися судоми, мляві парапарези, інсульти, енцефаліт, кортикоспинальна слабкість, а також кома чи тяжка депресія із суїцидальними спробами. Неврологічні симптоми можуть проявлятися від декількох тижнів до місяців після зараження [6, 9, 21, 23, 28, 41, 49, 57], причому неврологічні прояви можуть з’являтися незалежно від ураження дихальної системи [6].
Деякі неврологічні симптоми у хворих на COVID‑19 є менш серйозними, але здаються більш незрозумілими; один з них – «мозковий туман». Навіть після того, як зникають основні симптоми хвороби, пацієнти з COVID‑19 можуть скаржитися на втрату пам’яті, періодичну сплутаність свідомості, зниження когнітивних функцій, порушення сну [21, 23, 41, 49]. У багатьох хворих (незалежно від тяжкості перебігу хвороби) після зникнення усіх проявів коронавірусної хвороби та підтвердження негативних результатів лабораторних досліджень на SARS-CoV‑2 протягом кількох місяців зберігаються синдром «хронічної втоми» і «мозковий туман», який лікарі та науковці описали як ПКС. ПКС – це сукупність симптомів і синдромів, характерних для структурних уражень ЦНС і ПНС. Насамперед при ПКС відбувається ураження ЦНС і гіпоталамо-гіпофізарної системи з порушенням центрів терморегуляції, насичення й голоду, регуляції гомеостазу енергії та глюкози під впливом інсуліну і контрінсулярних гормонів, а також залученням системи нейропептидних нейронів (NPY) в дугоподібному ядрі гіпоталамуса. Ці ушкодження головного мозку та порушення нейроендокринної системи безпосередньо пов’язані зі структурними й функціональними ушкодженнями астроцитів з порушенням метаболізму глутаміну та нейротрансмісії γ-аміномасляної кислоти (ГАМК) – основного гальмівного нейромедіатора ЦНС. Можливо, в деяких людей, інфікованих вірусом SARS-CoV‑2, відбувається довготривала персистенція вірусу, що не виявляється лабораторно (особливо в тих, котрі мають супутню хронічну патологію). На тлі довготривалої персистенції вірусу SARS-CoV‑2 розвивається стан хронічного стресу з гіпоталамічною дисфункцією (ГД) по осям «гіпоталамус-гіпофіз-надниркові залози» та «гіпоталамус-гіпофіз-статеві залози» із пригніченням гіпоталамічних стрес-лімітуючих систем [3]. Фактично в пацієнтів із ПКС розвиваються неврологічні форми ГД.
Клінічні прояви ПКС характеризуються синдромом «хронічної втоми» (стадія виснаження при дистресі: виснаження синтезу гормонів надниркових і статевих залоз, зниження функції щитоподібної залози, міокардит, порушення центру терморегуляції в гіпоталамусі, виснаження ГАМК-ергічної регуляції), вираженою слабкістю і втомлюваністю, головними болями, які не відповідають ознакам інтоксикації, фіброміалгії, субфебрилітету, що не коригується жарознижувальними та знеболювальними препаратами (часто – вестибулярні порушення, запаморочення, симптом «мозкового туману», погіршення пам’яті, порушення когнітивних функцій і сну, задишка, біль у ділянці серця й спини, порушення менструальної функції у жінок, іноді – передчасне переривання вагітності, еректильна дисфункція в чоловіків). ПКС також проявляється симптомами тромбоваскуліту (запалення ендотелію мілких судин, що супроводжуються їх тромбозами та крововиливами – ДВЗ): біль по ходу судин, пастозність ніг і обличчя, парестезії кінцівок, посттромбофлеботичний синдром. Загалом клінічна картина ПКС нагадує клініку антифосфоліпідного синдрому.
Виявлено, що вірусу SARS-CoV‑2 не обов’язково проникати в глибину нейронів, аби спричинити вищезазначені симптоми. Здебільшого ефекти, що пов’язані з больовим синдромом, можуть з’являтися в результаті атаки на сенсорні нейрони, нерви, котрі проходять від спинного мозку по всьому тілу людини для передання інформації із зовнішнього середовища чи із внутрішніх процесів в організмі до ЦНС. Надалі все це впливає на порушення синтезу нейромедіаторів (насамперед за рахунок накопичення глутамату) та зниження ГАМК, які регулюють роботу нейроендокринної системи та зумовлюють гормональний дисбаланс з порушенням переважно вуглеводного обміну й терморегуляції [15, 45, 59]. Своєю чергою, саме ця дисфункція нейроендокринної системи впливає на тяжкість перебігу коронавірусної хвороби та її ускладнень, а також на вираженість ПКС і його специфічних проявів [31, 40, 46, 56].
Відомо, що коли сенсорні нейрони заражаються вірусом, це може мати довготривалі наслідки, навіть якщо вірус не залишається в клітинах. Необов’язково, щоб нейрони інфікувалися, оскільки в інфікованих пацієнтів виявляли велику кількість сигнальних молекул імунної системи – цитокінів, які можуть безпосередньо взаємодіяти з рецепторами нейронів і зумовлювати невропатичний біль. Вірусні частини, що взаємодіють з нейронами, можуть спричинити автоімунну атаку на нерви та нервові клітини, внаслідок чого розвивається цитокіновий шторм [23, 35].
З’ясувалося, що коронавірус може зумовити загрозливу загибель нейронів у пацієнтів, які перехворіли на COVID‑19 навіть у легкій формі. На основі медичних випадків учені знайшли нові наслідки зараження SARS-CoV‑2 для мозку, причому як у пацієнтів з тяжкою формою захворювання, так і в безсимптомних хворих. Результати досліджень довели, що вірус сприяє значним змінам у структурі кори головного мозку та в ділянках, які відповідають за пам’ять, увагу й здатність розмовляти. На основі цього з’явилося припущення, що COVID‑19 може спровокувати розвиток хвороби Альцгеймера чи Паркінсона [6, 9, 10, 36].
Протягом наукових і клінічних досліджень з’ясувалося, що насамперед коронавірус уражає астроцити, які саме забезпечують зв’язок між нейронами клітин. У групі обстежених пацієнтів виявилися люди, котрі вилікувалися від COVID‑19 більше 2 місяців тому, однак повторно звернулися до медиків зі скаргами на сильний головний біль, сонливість, погіршення пам’яті, запаморочення, судоми, при цьому раніше ці хворі ніколи не мали схожих скарг [6]. Клініцисти та науковці підкреслили, що факт порушень головного мозку в тяжких хворих є прогнозованим, тоді як поява дегенеративних захворювань ЦНС у пацієнтів, які перенесли хворобу безсимптомно чи в легкій формі й лікувалися без госпіталізації, здається дивною.
Що саме відбувається з нервовою системою при COVID‑19? Відповідь на це запитання допоможе покращити лікування коронавірусної хвороби та запобігти її тяжкому перебігу, ускладненням й розвитку ПКС.
Понад 30% пацієнтів з COVID‑19, які мають неврологічні та навіть психоневрологічні симптоми [5, 8, 10, 24, 31, 33, 37, 40, 57], зрештою демонструють прояви енцефаліту різного ступеня [50, 51, 53, 58]. Більше ніж у половини із цих пацієнтів неврологічні симптоми проявляються навіть через 3 місяці від початку захворювання, а також тоді, коли вірус більше не виявляється [5, 6, 8, 21-23]. Це свідчить про значне ураження нервової системи.
Вірус SARS-CoV‑2 може інфікувати майже третину клітин головного мозку, більшість з яких є астроцитами [23]. Одна з найсерйозніших змін, яку спричиняє інфекція SARS-CoV‑2 в астроцитах, – зниження концентрації пірувату та лактату, які необхідні для функціонування циклу Кребса. Припускають, що інфіковані астроцити відволікають піруват на продукцію лактату, оскільки він не змінюється в кондиціонованому середовищі астроцитів, та експортують його для збереження метаболізму нейронів. Проміжні продукти метаболізму глутаміну (глутамат і ГАМК) зменшуються в астроцитах, інфікованих SARS-CoV‑2; це дає змогу припустити, що глутаміноліз використовується як альтернативне джерело вуглецю для забезпечення оксидативного метаболізму астроцитів. Важливо відзначити, що астроцит-похідний глутамін необхідний для нейронального синтезу нейротрансмітерів глутамату та ГАМК [6, 7, 16, 17, 56, 61].
Відомо, що астроцити мають життєво важливу роль в обміні («переробці») нейротрансмітерів як вирішальному процесі підтримання синаптичної передачі та збудження нейронів. Це дуже важливо для глутаматергічних синапсів, оскільки правильне поглинання глутамату астроглією запобігає ексайтотоксичності, отже, апоптозу та загибелі нейронів [5-7, 9, 11, 15, 17, 61], при цьому глутамінсинтетаза перетворює глутамат у глутамін, який згодом може бути переданий назад у нейрони; в такий спосіб глутамат-глутаміновий цикл замикається. Це властиво і для ГАМК-ергічних синапсів, у яких нейротрансмітер ГАМК поглинається астроцитами та перетворюється спочатку в глутамат, потім – у глутамін [19]. Саме астроцити відповідають за підтримку рівня глутамату в головному мозку. Отже, очікується, що зміни в метаболізмі глутаміну в астроцитах, порушують функцію нейронів (впливаючи на синаптичну функцію та пластичність), враховуючи важливість поєднання астроцитів і нейронів.
Виявлено, що SARS-CoV‑2 зумовлює секреторний фенотип в астроцитах, що спричиняє посилення апоптозу нейронів. Частково загибель нейронів може пояснити зміна товщини кори головного мозку, яка була виявлена у хворих на COVID‑19 (як у госпіталізованих з тяжкою формою, так і у пацієнтів з легкими респіраторними симптомами). Важливо зазначити, що деякі з цих змін товщини кортикального шару корелювали із симптомами тривоги та порушення когнітивних функцій [6, 8-11, 39, 40].
Описані зміни в астроцитах при інфікуванні SARS-CoV‑2 та порушення метаболізму глутаміну в них зумовлюють порушення синтезу нейромедіаторів у ЦНС, а також їхню взаємодію з нейроендокринною системою. Насамперед відбувається зниження ГАМК – основного нейромедіатора, що впливає на гомеостаз і ендокринну регуляцію [11, 23, 24, 30, 33, 55]. Виснаження ГАМК відбувається внаслідок активації ГАМК-трансамінази, що спричиняє надмірне збудження та психоемоційний неспокій із порушенням балансу системи «збудження-гальмування».
Основна фізіологічна роль ГАМК – забезпечення стабільної рівноваги між збуджувальними та гальмувальними системами, нормалізація сну й забезпечення мозку енергією, а також його стійкість до гіпоксії, інших шкідливих впливів, у т.ч. і до дії вірусів та інших стресорів. За зниження рівня ГАМК порушується рівновага збуджуваних і гальмівних нейронів, що зумовлює дисонанс нейротрансмісії, порушення балансу нейроендокринної регуляції, отже, ГД. Обмежувати активність стрес-системи та цитокіновий шторм, а також надмірну збудливу реакцію на центральному й периферичному рівнях регуляції здатні стрес-лімітуючі системи. До основних центральних стрес-лімітуючих систем належать:
1) ГАМК-ергічна (система нейронів, які продукують ГАМК; має гальмівну дію на нейрони головного та спинного мозку);
2) опіоїдергічна (об᾽єднує нейрони в гіпоталамусі та секреторні клітини в гіпофізі, які продукують опіоїдні пептиди й мають гальмівну дію).
При інтеграції вірусу SARS-CoV‑2 в ЦНС відбуваються збій стрес-лімітуючих систем (насамперед ГАМК-ергічної системи), а також розвиток дистресу, що проявляється у вигляді вегетативного пароксизму з порушенням центру симпатичної та парасимпатичної нервових систем й з подальшим порушенням когнітивного і психоемоційного стану, терморегуляції, емоційного контролю, тонусу судин, отже, спостерігається гормональний дисбаланс з порушенням зворотного зв’язку між центральними й периферичними ендокринними залозами та клітинами-мішенями. Все це обумовлює маніфестацію ГД з порушенням переважно вуглеводного, електролітного й енергетичного обмінів, що зумовлює нейросудинні порушення та ковідний тромбоваскуліт. Як наслідок хронічного виснаження ГАМК і тромбоваскуліту розвивається ПКС, який проявляється здебільшого неврологічними симптомами ураження ЦНС і ПНС, а також клінікою синдрому хронічної втоми з ендокринопатіями [33, 41, 53]. Ендокринопатія має ознаки порушення вуглеводного обміну, а також розвитку цукрового діабету, дисфункції щитоподібної залози та репродуктивної системи, адже відомо, що ГАМК опосередковано впливає на транспорт і утилізацію глюкози, дихальну активність тканин і окисне фосфорилювання [6, 7, 9-11, 61].
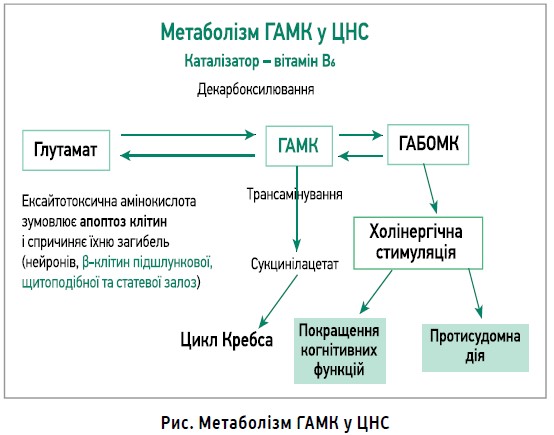 Також при зниженні синтезу ГАМК накопичується глутамат, який сприяє апоптозу клітин з подальшим розвитком автоімунних процесів, зокрема в щитоподібній, підшлунковій і статевих залозах (рис.) [24, 27, 34, 39, 45].
Також при зниженні синтезу ГАМК накопичується глутамат, який сприяє апоптозу клітин з подальшим розвитком автоімунних процесів, зокрема в щитоподібній, підшлунковій і статевих залозах (рис.) [24, 27, 34, 39, 45].
За допомогою рандомізованих досліджень у різних країнах світу було встановлено, що:
- ГАМК у ЦНС: урівноважує процеси збудження і гальмування в головному мозку;
- ГАМК у гіпоталамусі: нормалізує добовий ритм гормонів і секрецію пролактину, кортиколіберину, ЛГ, ФСГ, отже, нормалізує синтез андрогенів у надниркових залозах, а також підвищує синтез мелатоніну;
- ГАМК у підшлунковій залозі:
- у β-клітинах індукує деполяризацію мембрани та посилює секрецію інсуліну;
- в α-клітинах індукує мембранну гіперполяризацію та інгібує секрецію глюкагону;
- позитивно впливає на виживання і регенерацію β-клітин, що зумовлює збільшення їхньої маси в підшлунковій залозі;
- пригнічує інсуліт;
- ГАМК запобігає апоптозу клітин ендокринних залоз: β-клітин у підшлунковій залозі, тироцитів щитоподібної залози, репродуктивних клітин статевих залоз;
- ГАМК пригнічує продукцію системних запальних цитокінів (дуже важливо при інвазії вірусу SARS-CoV‑2).
Із блокуванням синтезу ГАМК тісно пов’язані показники рівня мелатоніну, що супроводжуються певними клінічними проявами ГД, особливо порушеннями вуглеводного обміну, сну та когнітивних і емоційних реакцій у молодих людей [1, 3-6, 18, 19, 22, 44], а також дисфункцією статевих залоз.
Отже, на тлі низького рівня ГАМК у ЦНС знижуються синтез і секреція мелатоніну та його метаболітів; це зумовлює депресію та «синдром низького рівня мелатоніну»: посилюються негативні наслідки окисних процесів і накопичення вільних радикалів (утворюються за окислення ліпідів), що спричиняє передчасне старіння; знижується гормональний вплив на тимус і щитоподібну залозу, отже, й на імунну систему; це зумовлює зниження активності Т-лімфоцитів і фагоцитів (маніфестує інтервенція вірусу SARS-CoV‑2); не забезпечується антистресовий ефект у відповідь на дію стресорів – підвищується тривожний стан, з’являються негативні емоції; порушуються сон і циркадний ритм гормонів; спостерігається функціональна диспепсія.
Збалансоване регулювання гомеостазу енергії та глюкози за допомогою інсуліну та контрінсулярних гормонів із залученням системи NPY в дугоподібному ядрі гіпоталамуса є головним фактором багатьох важливих фізіологічних процесів і нормальної функції мозку. Однією з головних цілей інсуліну в головному мозку є саме NPY, які пригнічуються його дією та впливом на них ГАМК. Зокрема, нейрони NPY – критичні контролери центральної дії інсуліну й апетиту задля відстеження енергетичного гомеостазу та регуляції обміну глюкози [32].
Порушення вуглеводного обміну при COVID‑19 характеризується низьким рівнем поглинання глюкози периферичними тканинами та клітинами під дією інсуліну, оскільки на тлі гормонального дисбалансу й порушення «зворотного зв’язку» гормональної регуляції часто розвивається інсулінорезистентність (ІР); саме так з’являється гіперглікемія. Під ІР розуміють зниження чутливості чи реактивності до метаболічної дії інсуліну [3, 4]. Встановлено, що глікемія ≥7 ммоль/л є предиктором негативного прогнозу тяжкого перебігу COVID‑19 [15, 32].
Високі концентрації глюкози зменшують розширення судин і збільшують їхню проникність при первинних реакціях запалення на тлі COVID‑19 (можливо, завдяки активації протеїнкінази С, що сприяє судинній дистонії мозку, тромбоваскуліту та розвитку енцефаліту й інсульту).
Гіперглікемія може пригнічувати противірусну імунну відповідь, збільшуючи тяжкість перебігу вірусної інфекції. Підвищення концентрації глюкози в крові зменшує дегрануляцію нейтрофілів, хемотаксис і фагоцитарну активність, погіршує активацію комплементу та пригнічує проліферативну реакцію лімфоцитів [5, 23, 38, 40, 41]. Гіперглікемія значно знижує активність як нейтрофілів, так і макрофагів, що сприяє інфікуванню людини. Пацієнти з високою концентрацією глюкози, інфіковані SARS-CoV‑2, мають низький уміст периферичних CD4-, CD8 T-клітин і високий рівень прозапальних Th17, CD4 T-клітин, а також підвищений рівень цитокінів. Припускається, що тяжчий перебіг захворювання в осіб з інвазією SARS-CoV‑2 та супутньою гіперглікемією найімовірніше зумовлений порушенням регульованої імунної відповіді, яке спричиняє тяжку патологію і критичні ускладнення. Однак можливим є пригнічення ГАМК; зниження синтезу мелатоніну (корелятивно) теж зменшує активність Т-лімфоцитів і фагоцитів, тобто відбувається зниження активності Т-клітинного імунітету та стійкості до інвазії вірусу SARS-CoV‑2 і його ускладнень, а також зменшує протипухлинний захист і стимулює канцерогенез (описані випадки маніфестації онкологічних процесів у інфікованих SARS-CoV‑2).
Отже, гіперглікемія – важливий предиктор розвитку ускладнень і негативного кінцевого результату перебігу коронавірусної хвороби.
Фактично вірус SARS-CoV‑2 є стресором для організму; у відповідь на його проникнення розвивається стан дистресу [1, 3].
Розрізняють послідовні 3 стадії розвитку дистресу при маніфестації ГД:
- стадія тривоги (шок – протишок);
- стадія резистентності;
- стадія виснаження (кататоксичний стан).
Згідно з нашими спостереженнями при COVID‑19 3-стадійна послідовність розвитку ГД змінюється; стадія резистентності практично відсутня. У пацієнтів ми спостерігаємо стадію тривоги (шок – протишок), яка часто відбувається з гіпертензією, гіпертермією, підвищеним тонусом м’язів, підвищенням внутрішньочерепного тиску та сильним головним болем, вестибулярними порушеннями й запамороченням, ознаками цитокінового шторму та тромбоваскуліту, посилюється ліполіз і глюконеогенез, що спричиняє гіперглікемію і гіперінсулінемію.
Після першої стадії дистресу та дуже нетривалої стадії резистентності (або за її відсутності) проявляється стадія виснаження, яка характеризується катаболічними процесами і гіподинамією; температура тіла знижується до гіпотермії, розвивається імунодепресія, з’являються болі в суглобах (артрити), часто наявні ознаки автоімунного тироїдиту з дисфункцією щитоподібної залози; прогресують астенія й депресія, спостерігаються патологія шлунково-кишкового тракту, порушення толерантності до вуглеводів або цукровий діабет інсулінонезалежний (2 типу), дисменорея в жінок та еректильна дисфункція в чоловіків (тобто це є ознаками, що властиві ПКС). Оскільки все це відбувається як наслідок зниження синтезу ГАМК, отже, й мелатоніну на тлі імунодепресії зі зниженням активності Т-клітинного імунітету, то прогнозовано можна очікувати в таких пацієнтів у подальшому порушення репродуктивної функції та появу онкологічних процесів.
На всіх стадіях розвитку дистресу за ГД спостерігається пригнічення синтезу ГАМК, що зумовлює дисбаланс нейромедіаторної регуляції синтезу гормонів у гіпоталамусі та порушення системи «зворотного зв’язку» між гіпоталамо-гіпофізарною системою і периферичними ендокринними залозами, а також клітинами-мішенями з порушенням рецепторної чутливості до гормонів [1, 3, 44]. Насамперед порушується регуляція в системі гіпоталамус-гіпофіз-надниркові залози.
ГД з порушенням секреції та добового ритму гормонів спричиняє також дисбаланс центрів терморегуляції, сну, насичення й голоду, а також прогресування ендокринопатії загалом, що обтяжує перебіг коронавірусної хвороби з розвитком критичних ускладнень [22, 34, 36, 61].
З огляду на зазначене можна дійти висновку, що клінічні прояви та тяжкість перебігу хвороби на тлі інфікування вірусом SARS-CoV‑2 обумовлені виснаженням ГАМК у ЦНС з порушенням метаболізму глутаміну в астроцитах, зниженням синтезу мелатоніну та порушенням регулювання гомеостазу енергії і глюкози за допомогою інсуліну, а також системи нейронів NPY гіпоталамуса. Це надає патогенетичні підстави для доцільності застосування препаратів ГАМК у комплексній терапії COVID‑19 та запобігання його тяжкому перебігу з розвитком критичних неврологічних ускладнень і летальності.
Отже, факти специфічності ускладнень й наслідків коронавірусної хвороби потребують пошуку нових додаткових методів лікування та запобігання розвитку ускладнень нервової, дихальної та серцево-судинної систем, а також критичного стану при COVID‑19 із подальшим розвитком ПКС. Зокрема, розглядається можливість використовувати ліки, що запобігатимуть негативному впливу вірусу SARS-CoV‑2 на астроцити та порушення метаболізму глутаміну, а також на синтез мелатоніну й порушення регулювання гомеостазу енергії та глюкози [2, 6, 11, 32, 49].
Одним із перспективних векторів метаболічного захисту мозку та загалом нервової системи від ішемії й окислювального стресу на тлі інвазії вірусу SARS-CoV‑2 є вплив на системи нейротрансмітерів і нейромодуляторів, а також забезпечення нормалізації співвідношення процесів збудження й гальмування нейротрансмісії. Як один з основних нейромедіаторів регулювання функцій мозку та гіпоталамо-гіпофізарної системи ГАМК має важливу роль у захисті мозку й нейроендокринної системи при COVID‑19. У звіті Всесвітньої організації охорони здоров’я з наукових досліджень за 2019 р. було зазначено, що ГАМК – новий перспективний терапевтичний засіб для регуляції функції острівцевих β-клітин, гомеостазу глюкози й автоімунітету.
На сьогодні є багато фармакологічних препаратів, що містять ГАМК; їх часто називають ноотропами. Однак, ураховуючи особливості ушкодження центральної та вегетативної нервових систем із залученням до патологічного процесу гіпоталамо-гіпофізарної системи при інфікуванні SARS-CoV‑2, одним з найперспективніших фармакологічних препаратів у лікуванні нейроендокринних порушень можна вважати Гамалате В6.
Гамалате В6 – стрес-лімітуючий комплекс з унікальною комбінацією компонентів, які регулюють процеси збудження та знімають стрес, відновлюють структуру і функцію астроцитів, а також урівноважують процеси збудження-гальмування в ЦНС і (безпосередньо чи опосередковано) впливають на відновлення дії нейротрансмісії, гіпоталамо-гіпофізарну систему та гомеостаз енергії й глюкози.
Активні компоненти Гамалате В6: ГАМК, γ-аміно-β-оксимасляна кислота (ГАБОМК), магнію глутамату гідробромід (МГБ) і піридоксин (вітамін В6).
- ГАМК поповнює дефіцит ендогенної ГАМК, завдяки чому може зменшувати тривожність і напругу, покращувати когнітивні функції, концентрацію уваги та пам’ять, сприяти позитивній реакції на стресори, пригнічувати продукцію системних запальних цитокінів, попереджати апоптоз клітин ендокринних залоз (тиреоцитів, β-клітин підшлункової залози, статевих залоз), нормалізувати синтез пролактину, кортиколіберину й адренокортикотропного гормона (КРГ-АКТГ), мелатоніну, ЛГ і ФСГ, глюкокортикоїдів та андрогенів надниркових залоз, а також відновлювати циркадний ритм гормонів.
- МГБ у своїй структурі містить глутамінову кислоту та з’єднання магнію з бромом у формі хелату. Завдяки останньому МГГ діє як частковий (парціальний) агоніст L-глутамату і спричиняє зменшення стимуляції та м’який седативний ефект. Це відрізняє його від транквілізаторів (бензодіазепіни, барбітурати), які мають пряму інгібуючу дію, що пов’язана з високим рівнем побічних ефектів, які не властиві для МГГ. Проведені дослідження показали антиконвульсантну активність МГГ, позитивний ефект при розладах сну, нейровегетативних змінах та поведінкових розладах у дітей.
- Вітамін В6 (піридоксину гідрохлорид) є кофактором синтезу ГАМК і нейромедіаторів дофаміну й серотоніну, бере участь у синтезі ГАМК із глутамінової кислоти, підвищує енергетичний потенціал нервових клітин, покращує енергообмін нейронів.
- ГАБОМК – природний метаболіт мозку (активніший за ГАМК у 5-19 раз); має виражену протисудомну дію, може покращувати когнітивні функції, нормалізувати сон і зменшувати недостатність ендогенної ГАМК.
Терапевтична дія компонентів Гамалате В6 пов’язана зі здатністю стимулювати окисно-відновлювальні реакції, що активують метаболічні процеси та підвищують стійкість мозку до гіпоксії [3, 9, 15, 18, 24, 26, 30, 42, 56]. Крім того, компоненти препарату мають мембраностабілізувальні властивості, завдяки чому можуть регулює синтез фосфоліпідів і білків, а також чинить антиоксидантну й антигіпоксичну дію на тканини та клітини організму людини.
Препарат Гамалате В6 у різних клінічних дослідженнях продемонстрував свою ефективність щодо лікування головного болю напруги та фіброміалгій (часто спостерігаються в пацієнтів з COVID‑19), незважаючи на наявність чи відсутність тривожного стану або депресії [1, 3, 9]. Крім того, Гамалате В6 може нормалізує метаболізм глутаміну, отже, й структуру і функцію астроцитів, усувати нейровегетативні та нейроендокринні порушення, нормалізувати сон, зменшувати симптоми тривожності й депресії, а також сприяти послабленню або зникненню головного болю.
На нашу думку, комплексний препарат Гамалате В6 має обґрунтовану доцільність для призначення пацієнтам з COVID‑19, оскільки в них (майже в усіх) спостерігаються сильні головні болі. Лікуючи хворих, інфікованих SARS-CoV‑2 (незважаючи на наявність або відсутність ендокринної патології), ми призначали Гамалате В6. Препарат у дозі 4-6 таблеток/добу приймали 23 пацієнти з лабораторно підтвердженим діагнозом COVID‑19 (віком від 16 до 74 років), з яких 5 мали гіпотиреоз, 7 – цукровий діабет 2 типу, 2 – цукровий діабет 1 типу; дисфункцію гіпоталамуса мали 8 хворих, у 2 пацієнтів ендокринної патології не виявлено. Безумовно, за такої незначної вибірки зарано (а також непрофесійно) робити висновки, але в усіх пролікованих нами пацієнтів через 22-38 год зникав головний біль, а фіброміалгії значно послаблювалися через 52-70 год і остаточно зникали через 90-134 год від початку застосування Гамалате В6 (незалежно від нозологічної форми ендокринної патології). Крім того, всі пацієнти на тлі прийому Гамалате В6 перехворіли коронавірусною хворобою в легкій формі без тяжких ускладнень з відносно швидким одужанням. Отже, це спостереження свідчить про доцільність подальшого вивчення застосування препарату Гамалате В6 в пацієнтів, інфікованих SARS-CoV‑2, особливо на тлі ендокринної патології.
Теоретична при інфікуванні SARS-CoV‑2 виснажується синтез ГАМК і відбуваються порушення метаболізму глутаміну, що може зумовлює структурні й функціональні деградації астроцитів. Надалі розвивається ГД з порушенням транспорту й утилізації глюкози та появою ІР, що спричиняє гіперглікемію та цереброваскулярні порушення, а також лікворно-венозну дисциркуляцію. Отже, з’являється порушення тонусу судин з їх звуженням і підвищенням проникності навіть уже в разі первинних реакцій запалення й активації протеїнкінази С.
Крім нейротропної дії, імовірним патогенетичним аспектом дії препарату Гамалате В6 є покращення мікроциркуляції в головному мозку за рахунок оптимізації пасажу еритроцитів через судини мікроциркуляторного русла та пригнічення агрегації тромбоцитів. На тлі курсового прийому Гамалате В6 може підвищуватися швидкість кровотоку та знижуватися периферичний опір в екстракраніальних судинах каротидного басейну.
Гострі вірусні інфекції (зокрема COVID‑19), цукровий діабет, артеріальна гіпертензія, ГД, гіпотиреоз є предикторами зниження реологічних показників крові. В таких пацієнтів знижена здатність еритроцитів до деформації та підвищена їх в᾽язкість, що зумовлює порушення кровообігу в капілярах і зниження тонусу судинної стінки (особливо за наявності цитокінового шторму). За таких патологічних станів аномальні еритроцити мають тригерну роль у розвитку ангіопатії. Загалом це спричиняє зниження коефіцієнта дифузійної доставки кисню до тканин і клітин.
Клініцисти відзначили посилення позитивного впливу на відновлення гемодинаміки та мікроциркуляції зі зменшенням ризику розвитку тромбоваскуліту, цереброваскулярних порушень і лікворно-венозної дисциркуляції та ПКС за одночасного застосування препарату Гамалате В6 і препаратів біофлавоноїду гідросміну. Гідросмін має високу біодоступність, посилює деформованість еритроцитів, отже, змінює розподіл регіонарного кровотоку та покращує мікроциркуляцію, що зумовлює достатню оксигенацію тканин, а тому знижує їх гіпоксію, покращує веномоторний тонус і лімфатичний відтік; це спричиняє зменшення набряку периферичних тканин.
Гамалате В6 має низьку токсичність, тому ймовірність інтоксикації не передбачена. При застосуванні у високих дозах можливі диспептичні розлади, що зникають при корекції дози; не виключена поява алергічних реакцій.
Висновки
На нашу думку, клінічні прояви та тяжкість перебігу коронавірусної хвороби на тлі інфікування вірусом SARS-CoV‑2 зумовлені виснаженням ГАМК у ЦНС із порушенням метаболізму глутаміну в астроцитах та їхньою структурною й функціональною деградацією, зниженням синтезу мелатоніну, порушенням регулювання гомеостазу енергії та глюкози за допомогою інсуліну, а також системи нейронів NPY гіпоталамуса, що спричиняє нейроендокринну патологію й розвиток ПКС. Це надає підстави для застосування препаратів ГАМК, зокрема Гамалате В6, у комплексній терапії COVID‑19. Потенційні позитивні ефекти цього препарату відкривають додаткові можливості ведення пацієнтів із COVID‑19, особливо хворих з ендокринопатією.
Список літератури знаходиться в редакції.



