22 квітня, 2023
Лікування та профілактика гіпербілірубінемії у новонароджених: гайдлайн Американської академії педіатрії 2022 року
Хоча ядерна жовтяниця зустрічається рідко, її вплив на дитину та родину може бути руйнівним. Клініцисти, що надають допомогу новонародженим, повинні розуміти важливість стратегії запобігання появі ядерної жовтяниці, викладеній у цій настанові. Впровадження систем для забезпечення послідовного застосування цих рекомендацій на терміні вагітності 35 тижнів і більше у відділеннях матері та дитини, лікарнях і клініках первинної медичної допомоги має вирішальне значення для успіху. Ця настанова підкреслює можливості первинної профілактики (наприклад, лікування для запобігання розвитку ізоімунної гемолітичної хвороби, адекватна підтримка грудного вигодовування), необхідність отримання точного анамнезу і фізикального обстеження для визначення наявності гіпербілірубінемії та факторів ризику нейротоксичності гіпербілірубінемії, важливість прогнозування ризику майбутньої гіпербілірубінемії, включаючи вимірювання загального білірубіну сироватки крові (ЗБС) та транскутанну білірубінометрію (TкБ) перед випискою, а також важливість подальшого спостереження після виписки. Настанова містить показання і підходи до фототерапії та ескалації допомоги, а також критерії, які допомагають визначити, коли лікування та моніторинг можна безпечно припинити. Клініцисти повинні розуміти обґрунтування рекомендацій, використовувати своє клінічне судження та, коли це доречно, спільно приймати рішення.
За даними Американської академії педіатрії (AAП), понад 80% малюків після народження мають певний ступінь жовтяниці. Ретельний нагляд за всіма новонародженими та відповідне лікування надзвичайно важливі, оскільки високі концентрації білірубіну можуть викликати гостру білірубінову енцефалопатію та ядерну жовтяницю і стати причиною інвалідизації в майбутньому. У вересні 2022 року ААП опублікувала настанову, яка оновлює та замінює клінічні рекомендації 2004 року щодо лікування і профілактики гіпербілірубінемії у новонароджених із терміном гестації ≥35 тижнів. Пропонуємо до уваги читачів переклад основних тез із цього документа. З повною версією настанови можна ознайомитися на сайті ААП.
Профілактика гіпербілірубінемії
Профілактика гіпербілірубінемії, пов’язаної з ізоімунною гемолітичною хворобою
Профілактика гіпербілірубінемії починається під час вагітності з виявлення та лікування жінок, у яких є ризик розвитку антитіл до антигенів еритроцитів, що може призвести до гемолітичної хвороби новонароджених (тобто ізоімунної гемолітичної хвороби). Якщо мати не проходила скринінг на наявність антиеритроцитарних антитіл під час вагітності, обстеження та лікування слід провести незабаром після пологів (рис.1). Американський коледж акушерів і гінекологів рекомендує жінкам під час вагітності пройти тестування для визначення групи крові ABO та Rh (D) типу, а також отримати аналіз на антитіла, щоб визначити потребу в Rh (D) імуноглобуліні (RhIG) й оцінити ризик виникнення ізоімунного захворювання.
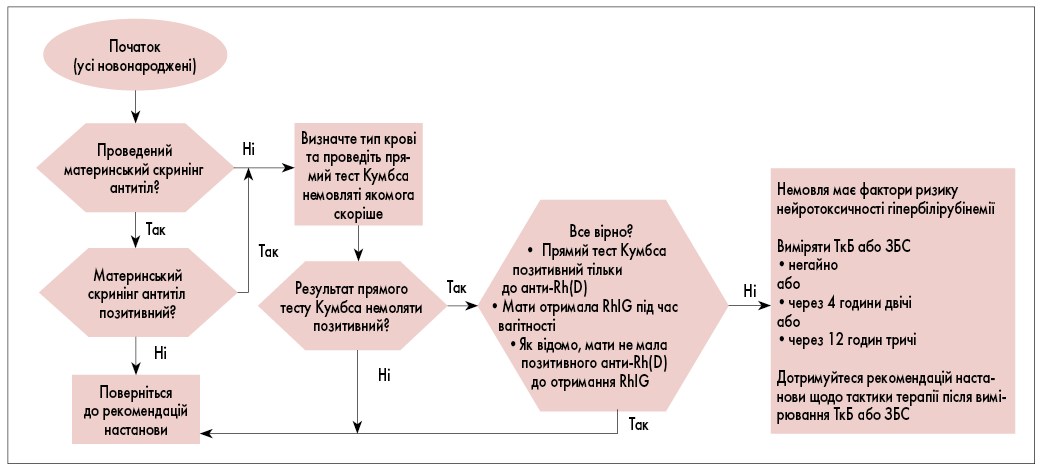 Рис. 1. Підхід до ідентифікації новонароджених з материнськими антиеритроцитарними антитілами та раннього лікування (K. Vats, 2019)
Рис. 1. Підхід до ідентифікації новонароджених з материнськими антиеритроцитарними антитілами та раннього лікування (K. Vats, 2019)
! Якщо аналіз на виявлення материнських антитіл позитивний або результат невідомий через те, що мати не проходила пренатальний скринінг на антитіла, немовляті слід зробити прямий антиглобуліновий тест (прямий тест Кумбса) і якнайшвидше визначити групу крові, використовуючи пуповинну кров або кров із периферичної вени (рівень якості сукупних доказів В).
Прямий тест Кумбса допомагає ідентифікувати дітей із ризиком гіпербілірубінемії, спричиненої гемолізом. У разі отримання негативного результату немовлята не потребують спеціального догляду. Матері, які отримували RhIG, можуть мати позитивний скринінг антитіл на анти-Rh(D), а немовлята, народжені жінками, яким було введено RhIG, можуть мати позитивний результат прямого теста Кумбса, але, як правило, не гемоліз. Якщо відомо, що прямий антиглобуліновий тест у новонародженого позитивний лише на анти-Rh(D), оскільки мати отримала RhIG під час цієї вагітності, і відомо, що мати не мала Rh(D)-антитіл до отримання RhIG, за немовлям можна спостерігати як за негативним за прямим тестом Кумбса.
Якщо група крові матері резус-негативна, слід визначити Rh-тип немовляти, щоб оцінити необхідність введення RhIG матері. Якщо материнська кров має значення І(0) Rh(D)-позитивна, а тест на материнські антитіла негативний, перевірка пуповинної крові для визначення групи крові немовляти та/або прямий антиглобуліновий тест залишається на розсуд клініциста. Визначення групи крові новонародженого або прямого теста Кумбса не є обов’язковими, якщо спостереження за рівнем білірубіну та оцінка ризику відповідають цій практичній настанові та організовано відповідне подальше спостереження після виписки.
Забезпечення підтримки грудного вигодовування
Виключно грудне вигодовування та гіпербілірубінемія тісно пов’язані. Недостатнє споживання молока може призвести до так званої жовтяниці грудного вигодовування, яка зазвичай досягає піку на 3-5-ий день після народження. Цей тип жовтяниці, особливо при надмірному вираженні, майже завжди пов’язаний із недостатнім споживанням молока, а не з грудним вигодовуванням як таким. Тому правильніше описати цей стан як «гіпербілірубінемію субоптимального споживання». Грудне вигодовування менше 8 разів на день асоціюється з вищим рівнем загального білірубіну сироватки (ЗБС), адже низький рівень споживання молока та низька калорійність сприяють зменшенню частоти випорожнень та посиленню кишково-печінкової циркуляції білірубіну. На відміну від субоптимального споживання, гіпербілірубінемія, яка зберігається при достатньому споживанні грудного молока та збільшенні маси тіла, називається жовтяницею грудного молока. Цей тип некон’югованої гіпербілірубінемії може зберігатися до 3 місяців і майже завжди не є патологічним. Результати одного з досліджень продемонстрували, що через 28 днів після народження у 34% немовлят, які перебували переважно на грудному вигодовуванні, концентрація білірубіну за допомогою ТкБ була ≥85 мкмоль/л (переклад референсних значень адаптований, мг/дл × 17,1=мкмоль/л), 9% малюків мали концентрацію ≥171 мкмоль/л і у 1% концентрація була ≥220 мкмоль/л.
AAП рекомендує впровадження практики догляду за вагітними, які сприяють комплексній, заснованій на доказах та орієнтованій на сім’ю, підтримці грудного вигодовування. Лікарі повинні сприяти підтримці грудного вигодовування протягом першої години після народження з частим годуванням на вимогу в подальшому. Ознаки адекватності смоктання включають достатню кількість сечі та перехідний характер випорожнень, фізіологічну втрату маси тіла, відсутність дискомфорту у матері та чутне ковтання з наступним збільшенням об’єму молока матері. Немовлят, які знаходяться на грудному вигодовуванні та отримують достатню кількість рідини, не потрібно догодовувати дитячими сумішами.
! Не слід приймати пероральні добавки з водою або декстрозою для запобігання гіпербілірубінемії або з метою зниження концентрації білірубіну (рівень доказів B).
Рішення про тимчасове догодовування донорським грудним молоком або дитячою сумішшю слід приймати спільно з батьками немовляти після обговорення ризиків і переваг.
Оцінка та моніторинг гіпербілірубінемії
Виявлення факторів ризику
Немовлята з факторами ризику гіпербілірубінемії (табл. 1) потребують більш ретельного спостереження. Визначення факторів ризику вимагає обстеження немовляти, оцінки лабораторних даних і отримання сімейного анамнезу захворювань крові або неонатальної жовтяниці.
Дефіцит глюкозо-6-фосфатдегідрогенази (G6PD) - Х-зчеплена рецесивна ензимопатія, що знижує захист від окислювального стресу, сьогодні визнана однією з найважливіших причин розвитку небезпечної гіпербілірубінемії, що призводить до ядерної жовтяниці у США і в усьому світі. Виявлення новонароджених із дефіцитом G6PD є проблемою. Більшість уражених немовлят не мають позитивного сімейного анамнезу. Генетичне походження від популяції, в якій цей стан поширений (наприклад, країни Африки на південь від Сахари, Близького Сходу, Середземномор’я, Аравійського півострова та Південно-Східної Азії), може бути корисним для прогнозування ризику.
Існують клінічні події, які повинні викликати підозру дефіциту G6PD. Новонароджені з дефіцитом G6PD частіше отримують фототерапію перед випискою з лікарні, ймовірно, через збільшення виробництва білірубіну та зниження кон’югації, і мають більший ризик повторної госпіталізації та повторного лікування. Важка гіпербілірубінемія або атиповий розвиток гіпербілірубінемії, наприклад підвищений ЗБС у немовлят на штучному вигодовуванні або жовтяниця з пізнім початком, підвищують ймовірність дефіциту G6PD.
У немовлят із дефіцитом G6PD може розвинутися раптове та екстремальне збільшення ЗБС, яке може бути важко передбачити або запобігти йому. Навіть після того, що виглядає як гостра гемолітична подія, лабораторних досліджень може бути недостатньо або взагалі не бути для підтвердження гемолізу. Важливо, щоб клініцисти знали, що вимірювання активності G6PD під час або незабаром після гемолітичної події чи після обмінного переливання може призвести до помилково нормального результату. Якщо існує серйозна підозра на дефіцит G6PD, але вимірювання активності G6PD є нормальним чи близьким до норми, активність G6PD слід виміряти щонайменше через 3 місяці.
Визначення потреби в лікуванні
Незважаючи на значні лабораторні відмінності у вимірюваннях, практично всі дослідження лікування базуються на рівнях ЗБС, виміряних у клінічних лабораторіях.
! Використовуйте показник ЗБС як остаточний тест для прийняття рішень щодо фототерапії та ескалаціїї лікування (обмінне переливання крові; рівень доказів X).
Рішення про початок фототерапії або ескалації лікування приймається з урахуванням терміну вагітності, відповідності рівня ЗБС до часу після народження та факторів ризику нейротоксичності білірубіну, включаючи клінічну нестабільність або сепсис (табл. 2). Наявність факторів ризику нейротоксичності гіпербілірубінемії знижує поріг для лікування фототерапією та рівень, на якому необхідно посилити лікування. Незважаючи на те, що ацидемія може вказувати на клінічну нестабільність, недостатньо доказів для визначення конкретного порогу рівня рН для підвищення ризику нейротоксичності.
Малий гестаційний вік та ізоімунна гемолітична хвороба є факторами ризику розвитку значної гіпербілірубінемії й факторами нейротоксичності білірубіну. Хоча незрозуміло, чи гемоліз, спричинений іншими факторами, ніж ізоімунізація, також підвищує ризик нейротоксичності білірубіну. Розумно припустити, що так. Підвищити ризик нейротоксичності може низький рівень сироваткового альбуміну внаслідок збільшення доступності незв’язаного білірубіну (тобто білірубіну, не зв’язаного з альбуміном). Ця настанова визначає концентрацію альбуміну <30,0 г/л фактором ризику нейротоксичності гіпербілірубінемії (табл. 2). Хоча у комітету недостатньо даних, щоб рекомендувати визначення концентрації альбуміну в усіх новонароджених, вимірювання альбуміну рекомендується як частина ескалації терапії.
Візуальна оцінка концентрації ЗБС
Якщо немовля взагалі не має жовтяниці або візуальна оцінка білірубіну клініцистом становить <68 мкмоль/л, дуже малоймовірно, що рівень ЗБС буде сягати ≥205 мкмоль/л. Візуальна оцінка зазвичай використовується для прийняття рішень щодо отримання показників ТкБ або ЗБС у доношених амбулаторних пацієнтів віком 3 або більше днів. Для цих пацієнтів пороги лікування достатньо високі, отже, визначення більш легких ступенів жовтяниці не є важливим.
! Усіх немовлят слід візуально перевіряти на наявність жовтяниці принаймні кожні 12 годин після пологів до виписки. ЗБС або ТкБ у немовлят, які мають жовтяницю, слід виміряти якнайшвидше – раніше, ніж через 24 години після народження (рівень доказів X).
Хоча жовтяниця до 24 годин від народження може не мати визначеної причини, її наявність свідчить, швидше за все, про гемолітичний процес. Рекомендації щодо візуальної оцінки не замінюють необхідності провести принаймні 1 скринінг ЗБС або TкБ. Візуальна оцінка може бути доповненням до вимірювання.
Черезшкірне вимірювання білірубіну
Рівень ЗБС можна оцінити на основі вимірювань за допомогою ТкБ. Хоча вимірювання ТкБ безпосередньо не оцінює рівень білірубіну, воно є дійсним та надійним, якщо використовувати його як скринінговий тест для виявлення немовлят, яким потрібне вимірювання ЗБС. Таким чином, використання TкБ може зменшити кількість заборів крові.
Існує хороша кореляція між показниками TкБ і концентрацією ЗБС. Рівень ЗБС зазвичай знаходиться в межах 51 мкмоль/л від ТкБ у новонароджених із показниками ТкБ <256 мкмоль/л.
! ТкБ або ЗБС слід вимірювати між 24 і 48 годинами після народження або перед випискою, якщо це не відбувається раніше (рівень доказів C).
! ЗБС слід вимірювати, якщо ТкБ перевищує або знаходиться в межах 51 мкмоль/л від порогового значення лікування фототерапією або якщо ТкБ становить ≥256 мкмоль/л (рівень доказів C).
! Якщо доступно більше ніж 1 вимірювання TкБ або ЗБС, швидкість збільшення може бути використана для ідентифікації немовлят із вищим ризиком подальшої гіпербілірубінемії. Швидкий приріст білірубіну (≥5,1 мкмоль/л на годину в перші 24 години після народження або ≥3,4 мкмоль/л на годину після цього) свідчить про гемоліз. У такому випадку виконайте прямий тест Кубса, якщо цього не було зроблено раніше (рівень доказів D).
! Якщо неможливо організувати належне спостереження за немовлям, якому рекомендовано амбулаторне контрольне вимірювання рівня білірубіну, виписка може бути відкладена (рівень доказів D).
Серед немовлят, у яких концентрація ЗБС нижча від порогу фототерапії, потенційна потреба в фототерапії або ескалації лікування в майбутньому зростає залежно від того, чим ближче рівень ЗБС до порогу фототерапії. Однак, як тільки було задокументовано спонтанне зниження ТкБ або ЗБС (тобто не пов’язане з фототерапією) протягом принаймні 6 годин, ризик подальшої гіпербілірубінемії є низьким і немає необхідності проводити додаткові вимірювання білірубіну, якщо немає інших тривожних ознак, як наприклад, загострення жовтяниці або гостре захворювання.
Оцінка підвищених концентрацій прямого або кон’югованого білірубіну
Спільна рекомендація Північноамериканського та Європейського товариств педіатричної гастроентерології, гепатології та харчування визначає пряму концентрацію білірубіну в сироватці крові >17,1 мкмоль/л як аномальну, тоді як для кон’югованого білірубіну використовується порогове значення ≥5,1 мкмоль/л. Оскільки поширеність атрезії жовчовивідних шляхів низька (приблизно 1:14 000), а це порогове значення становить лише приблизно 95-й процентиль, майже всі (>99%) немовлята, які мають однократне підвищення концентрації прямого або кон’югованого білірубіну, не мають жовчної атрезії. Позитивне прогностичне значення для атрезії жовчних шляхів та інших причин патологічного холестазу може бути визначено за допомогою повторного вимірювання протягом 2 тижнів.
Підвищення концентрації прямого або кон’югованого білірубіну вказує на можливість патологічного холестазу, який потребує подальшого обстеження. Концентрація прямого білірубіну >20% від загального більше не вважається необхідною для діагностики холестазу. Важливо також враховувати інші причини неонатальної прямої гіпербілірубінемії, окрім атрезії жовчних шляхів, які потребують раннього лікування. До них відносяться інфекції сечовивідних шляхів, ізоімунна гемолітична хвороба, сепсис і деякі вроджені порушення метаболізму.
! Для немовлят на грудному вигодовуванні, які все ще мають жовтяницю у віці від 3 до 4 тижнів, і для немовлят на штучному вигодовуванні, які все ще мають жовтяницю у віці 2 тижнів, слід виміряти концентрацію загального та прямого (або кон’югованого) білірубіну, для того щоб виявити можливий патологічний холестаз (рівень доказів X).
При виникненні тривалої жовтяниці клініцистам також слід переглянути результати скринінгу новонароджених, оскільки деякі захворювання, виявлені під час скринінгу (наприклад, галактоземія, гіпотиреоз, тирозинемія), можуть призвести до стійкої жовтяниці.
Лікування гіпербілірубінемії
Забезпечення фототерапії
Ефективність фототерапії залежить від її інтенсивності та площі тіла немовляти, яка піддається фототерапії. На жаль, не існує стандартного методу проведення фототерапії, а обладнання для цієї процедури суттєво відрізняється. Загальний підхід полягає в тому, щоб забезпечити інтенсивну фототерапію якомога більшій площі тіла немовляти. Для інтенсивної фототерапії потрібне синє світлодіодне світло вузького спектру з опроміненням щонайменше 30 мкВт/см2 на нм при довжині хвилі близько 475 нм. Світло за межами діапазону від 460 до 490 нм створює непотрібне тепло та потенційно шкідливу довжину хвиль. Перевага інтенсивної фототерапії полягає в тому, що вона може швидко знизити ЗБС і скоротити тривалість лікування.
Основна мета фототерапії – зменшити подальше підвищення концентрації ЗБС, що може призвести до ескалації терапії, включаючи обмінне переливання крові. Рекомендовані порогові значення для фототерапії значно нижчі від тих, при яких виникає явна гостра нейротоксичність білірубіну або ядерна жовтяниця. Фототерапія не повинна використовуватися виключно з метою запобігання несприятливим подіям розвитку нервової системи, оскільки літературні дані про зв’язок незначних аномалій з білірубіном є суперечливими. Немає жодних доказів того, що фототерапія покращує або запобігає будь-якому з цих результатів, але є деякі докази того, що фототерапія може призвести до невеликого збільшення ризику подальшої дитячої епілепсії. Автори вважають, що користь від фототерапії перевищує невеликий потенційний ризик епілепсії, коли ЗБС дорівнює або значно вище порогового значення для фототерапії.
Автори також визначили, що нові докази того, що нейротоксичність білірубіну не виникає, доки концентрації значно не перевищать порогові значення обмінного переливання 2004 року, виправдовують підвищення порогових значень лікування фототерапією на вузький діапазон.
Як було показано, прямий вплив сонячного світла знижує концентрацію ЗБС, проте практичні труднощі, пов’язані з безпечним перебуванням немовлят на сонці, перешкоджають використанню сонячного світла як надійного терапевтичного засобу, а отже, не рекомендується. Незважаючи на те, що відфільтроване сонячне світло безпечно використовувалося в умовах обмежених ресурсів, де фототерапія недоступна, ці рекомендації не були розроблені для використання в таких умовах.
! Інтенсивна фототерапія рекомендована при порогових значеннях ЗБС на основі номограм відповідно до гестаційного віку, факторів ризику нейротоксичності гіпербілірубінемії та віку немовляти в годинах (рівень доказів X).
Порогові значення фототерапії за гестаційним віком і віком у годинах для немовлят, у яких немає визнаних факторів ризику нейротоксичності гіпербілірубінемії, окрім гестаційного віку, базуються на експертній думці, а не на переконливих доказах того, коли потенційні переваги фототерапії перевищують потенційну шкоду. Використовуйте концентрацію ЗБС; не віднімайте білірубін прямої реакції або кон’югований білірубін із ЗБС. Зауважте, що немовлята віком <24 години із ЗБС на рівні або вище порога фототерапії, ймовірно, мають гемолітичний процес і повинні бути оцінені на наявність гемолітичної хвороби.
Клініцист та сім’я дитини можуть вибрати лікування на нижчих рівнях, виходячи з індивідуальних обставин і переваг. Наприклад, можна розпочати фототерапію на підпороговому рівні під час перебування у стаціонарі після народження, щоб зменшити ризик повторної госпіталізації, якщо абсолютний рівень або швидкість підвищення ЗБС свідчить про те, що існує висока ймовірність перевищення порогу терапії. За можливості фототерапію слід проводити в кімнаті спільного перебування матері і дитини.
! Для вже виписаних новонароджених, у яких потім розвинулася гіпербілірубінемія з рівнем ЗБС, що перевищує порогове значення для фототерапії, лікування за допомогою домашнього світлодіодного пристрою для фототерапії замість повторної госпіталізації може бути варіантом (рівень доказів D).
Переривання фототерапії для грудного вигодовування не впливає на загальну ефективність фототерапії, якщо вона використовується належним чином. Ці переривання слід звести до мінімуму, якщо концентрація білірубіну наближається до межі ескалації терапії.
Незважаючи на те, що грудне вигодовування та жіноче молоко мають багато переваг, короткочасне використання молочної суміші може спряти більш швидкому зниженню концентрації ЗБС та зменшити ризик повторної госпіталізації для фототерапії. Хоча доступних даних недостатньо, догодовування з використанням зцідженого молока матері може мати такі ж переваги, як і додавання дитячої суміші без потенційних проблем, пов’язаних із сумішшю. Використання внутрішньовенних рідин не рекомендується, якщо немає ознак дегідратації, яку неможливо скорегувати ентеральним шляхом. Потенційне використання суміші, зцідженого молока матері або донорського молока можна розглядати як альтернативу повторній госпіталізації для фототерапії у немовляти на грудному вигодовуванні, яке було виписане, але має надмірну втрату маси тіла та концентрація білірубіну наближається до порогу фототерапії.
Тривала непряма гіпербілірубінемія
Немовлята віком 7 днів і старше зі стійким підвищеням ЗБС у межах 34 мкмоль/л від порогу фототерапії можуть мати тривалу непряму гіпербілірубінемію. Більшість цих немовлят мають жовтяницю грудного молока, але інші причини включають гемолітичну хворобу, гіпотиреоз, позасудинну кров, стеноз пілоричного відділу з синдромом Жильбера та синдром Криглера – Найяра. Деякі дослідження вказують, що тривалий вплив непрямої гіпербілірубінемії може бути пов’язаний із підвищеним ризиком нейротоксичності, хоча інші дослідження не підтвердили цей зв’язок.
Спостереження за немовлятами, які отримують фототерапію
Під час госпіталізаціїї немовлят ЗБС слід виміряти протягом 12 годин після початку фототерапії. Час вимірювання після початку фототерапії та частота моніторингу ЗБС під час фототерапії залежать від віку дитини, наявності факторів ризику нейротоксичності гіпербілірубінемії, концентрації ЗБС і траєкторії кривої приросту ЗБС (рівень доказів X).
! Якщо у немовлят після виписки ЗБС щодня збільшується, а різниця між ЗБС і порогом фототерапії зменшується або ЗБС на ≥17,1 мкмоль/л перевищує порогове значення фототерапії, їх слід госпіталізувати для стаціонарної фототерапії (рівень доказів X).
Для немовлят, яким потрібна фототерапія, слід виміряти концентрацію гемоглобіну, гематокрит або зробити повний аналіз крові, щоб оцінити наявність анемії та визначити базовий рівень у разі розвитку наступної анемії. Оцініть причини гіпербілірубінемії шляхом визначення прямого тесту Кумбса у немовляти, чия мати мала позитивний скринінг на антитіла, має І(0) групу крові незалежно від статусу Rh(D) або має Rh(D)-. Активність G6PD слід вимірювати у будь-якого немовляти із жовтяницею невідомої причини, в якого ЗБС підвищується, незважаючи на інтенсивну фототерапію, або у немовляти із раптовим підвищенням ЗБС після початкового зниження, або у тих, хто потребує ескалації терапії (рівень доказів X).
Припинення фототерапії
Рішення припинити фототерапію повинно ґрунтуватися на балансі між бажанням мінімізувати вплив фототерапії та розлучення матерів і немовлят із бажанням уникнути повторного підвищення ЗБС після фототерапії. Рикошетна гіпербілірубінемія визначається як концентрація ЗБС, яка досягає порогу фототерапії для віку немовляти протягом 72-96 годин після припинення фототерапії. Немовлята, які отримують фототерапію під час госпіталізації при народженні, мають набагато більше шансів отримати рикошетну гіпербілірубінемію, ніж ті, чиє лікування фототерапією вперше відбулося під час повторної госпіталізації. Фактори ризику рикошетної гіпербілірубінемії включають малий післяпологовий вік (<48 годин) на початку фототерапії, гемолітичну хворобу, термін вагітності <38 тижнів і рівень ЗБС на момент припинення фототерапії вищий відносно порогу фототерапії.
! Припинення фототерапії можливе, якщо ЗБС знизився принаймні на 34,2 мкмоль/л нижче порогового значення, визначеного для години життя немовляти. Триваліший період фототерапії є варіантом, якщо існують фактори ризику рикошету гіпербілірубінемії (рівень доказів C).
Спостереження після фототерапії
Час проведення контрольного аналізу білірубіну після припинення фототерапії має ґрунтуватися на ризику рикошету гіпербілірубінемії. За винятком особливих обставин, описаних у рекомендації, має пройти принаймні 12 годин, а краще 24 години, щоб концентрація білірубіну підтвердила наявність рикошетної гіпербілірубінемії. Лікувати рикошетну гіпербілірубінемію слід відповідно до попередніх рекомендацій щодо початку фототерапії.
Повторне вимірювання білірубіну після фототерапії базується на ризику рикошету гіпербілірубінемії.
- Немовлятам, які перевищили поріг фототерапії під час госпіталізації та потребували фототерапії в перші 48 годин життя; мали позитивний прямий тест Кумбса; тим, хто мав підтверджену або підозрювану гемолітичну хворобу, слід виміряти ЗБС через 6-12 годин після припинення фототерапії та повторити вимірювання білірубіну на наступний день після припинення фототерапії.
- Усім іншим немовлятам, які перевищили поріг фототерапії під час госпіталізації, слід виміряти рівень білірубіну на наступний день після припинення фототерапії.
- Немовлятам, які отримували фототерапію під час госпіталізації і які пізніше були повторно госпіталізовані через перевищення порогу фототерапії, слід виміряти рівень білірубіну на наступний день після припинення фототерапії.
- Немовлятам, які перевищили поріг фототерапії після виписки, але не отримували фототерапію під час госпіталізації після пологів, і немовлятам, які отримували фототерапію вдома і рівень ЗБС у них перевищив поріг фототерапії, слід виміряти рівень білірубіну через 1-2 дні після припинення фототерапії або провести клінічне спостереження через 1-2 дні після фототерапії, щоб визначити, чи потрібно проводити вимірювання білірубіну. Фактори ризику рикошету гіпербілірубінемії, які слід враховувати при цьому визначенні, включають рівень ЗБС на момент припинення фототерапії відповідно до порогу фототерапії, гестаційний вік <38 тижнів, адекватність вигодовування та збільшення маси тіла, а також інші фактори ризику гіпербілірубінемії та нейротоксичності гіпербілірубінемії.
! Якщо з моменту припинення фототерапії минуло щонайменше 24 години, замість ЗБС можна виміряти TкБ (рівень доказів Х).
Ескалація догляду та забезпечення обмінного переливання
Ескалація допомоги та інтенсивна терапія потрібна немовлятам із підвищеною або швидко зростаючою концентрацією білірубіну, щоб запобігти необхідності обмінного переливання крові та, можливо, появі ядерної жовтяниці. Алгоритм, представлений на рис. 2, описує підхід до ескалації допомоги.
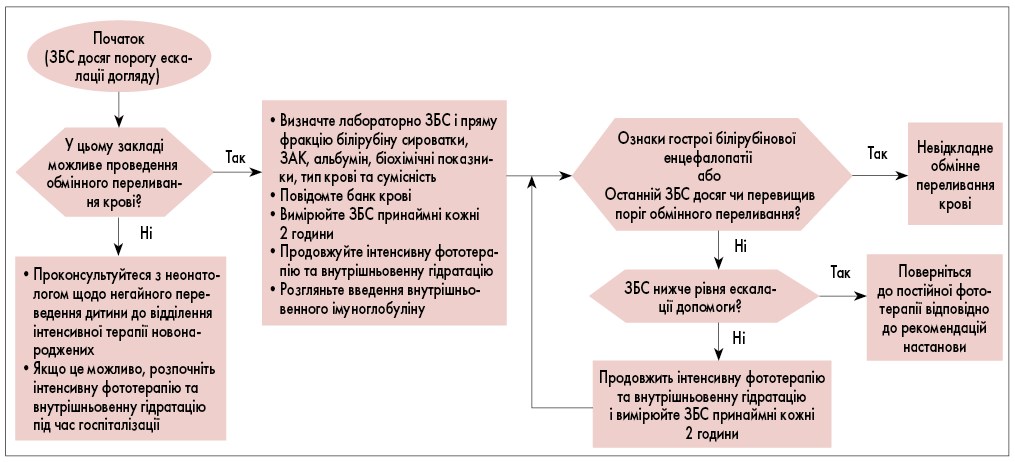 Рис. 2. Підхід до ескалації догляду. Поріг ескалації допомоги становить 2 мг/дл нижче порогу обмінного переливання
Рис. 2. Підхід до ескалації догляду. Поріг ескалації допомоги становить 2 мг/дл нижче порогу обмінного переливання
! Коли рівень ЗБС немовляти досягає або перевищує порогове значення ескалації догляду, визначене як 34,2 мкмоль/л нижче порогу обмінного переливання, лікування слід посилити (рівень доказів X).
Потреба ескалації терапії є невідкладною медичною допомогою. Період ескалації догляду починається з моменту, коли результат ЗБС дитини вперше вимагає початку інтенсивного догляду, і закінчується, коли рівень ЗБС стає нижчим за порогове значення ескалації догляду. Оптимально ці немовлята мають перебувати у відділенні інтенсивної терапії новонароджених. Якщо немовля перебуває в установі, де немає можливостей для екстреного обмінного переливання крові, слід проконсультуватися з неонатологом щодо термінового переведення до відділення інтенсивної терапії, де можна провести обмінне переливання. Якщо можливо, інтенсивну фототерапію та внутрішньовенну гідратацію слід розпочати якомога скоріше під час госпіталізації.
! Немовлят, які потребують посиленого догляду, слід обстежити на ЗБС і білірубін прямої реакції, зробити повний загальний аналіз крові, аналіз на сироватковий альбумін, біохімічний аналіз сироватки, тип і перехресну відповідність (рівень доказів X).
! Немовлята, що потребують посиленого догляду, повинні отримувати внутрішньовенну гідратацію та екстрену інтенсивну фототерапію. Необхідно проконсультуватися з неонатологом щодо термінового переведення до відділення інтенсивної терапії, де є можливість провести обмінне переливання (рівень доказів C).
! Внутрішньовенний імуноглобулін (дозування від 0,5 до 1 г/кг) протягом 2 годин можна вводити немовлятам, в яких визначено ізоімунну гемолітичну хворобу (тобто позитивний прямий тест Кумбса), в яких рівень ЗБС досягає або перевищує пороговий рівень допомоги. Дозу можна повторити через 12 годин (рівень доказів C).
Ефективність введення внутрішньовенного імуноглобуліну для запобігання необхідності обмінного переливання крові невідома. Спостережні дослідження свідчать про зв’язок між терапією імуноглобуліном і некротичним ентероколітом. Фактори, які слід враховувати при визначенні об’єму терапїї, включають реакцію на фототерапію, швидкість збільшення ЗБС і можливість забезпечення своєчасного обмінного переливання. Усіх аспектів вказівок щодо ескалації лікування слід продовжувати дотримуватися, якщо використовується внутрішньовенний імуноглобулін.
! Немовлятам з ознаками середньої або прогресуючої стадії гострої білірубінової енцефалопатії (гіпертонус, вигин, ретроколіс, опістотонус, пронизливий крик або повторне апное) необхідно провести термінове обмінне переливання крові (рівень доказів C).
! Якщо ЗБС дорівнює або перевищує порогове значення обмінного переливання, немовляті необхідно провести термінове обмінне переливання. Якщо під час підготовки до обмінного переливання, ще до йогопочатку, концентрація ЗБС є нижчою від порогу обмінного переливання, а у немовляти немає ознак середньої або розвиненої стадії гострої білірубінової енцефалопатії, обмінне переливання можна відкласти, але продовжити інтенсивну фототерапію та контролювати ЗБС кожні 2 години, доки рівень не стане нижчим порога ескалації допомоги (рівень доказів C, рекомендація).
Перехресно зіставлені промиті еритроцити, поєднані із розмороженою свіжозамороженою плазмою дорослих до гематокриту приблизно 40%, є кращими для обмінного переливання. Додаткова свіжозаморожена плазма, що містить альбумін, підтримуючи гематокрит близько 40%, посилить виведення білірубіну.
Співвідношення білірубіну до альбуміну можна використовувати в поєднанні з рівнем ЗБС для визначення необхідності обмінного переливання. Лікувальний поріг співвідношення білірубіну до альбуміну для обмінного переливання крові визначається як ЗБС (виміряний у мг/дл), поділений на сироватковий альбумін (виміряний у г/дл). На додаток до критеріїв, описаних вище, обмінне переливання може розглядатися при співвідношенні білірубіну до альбуміну:
- ≥8,0, якщо термін вагітності становить ≥38 тижнів вагітності та немає факторів ризику нейротоксичності гіпербілірубінемії
- або
- ≥7,2, якщо термін вагітності становить ≥38 тижнів вагітності та існує принаймні 1 фактор ризику нейротоксичності гіпербілірубінемії
- або
- ≥7,2, якщо гестаційний вік становить від 35 до 37 тижнів без фактору ризику нейротоксичності гіпербілірубінемії
- або
- ≥6,8, якщо гестаційний вік становить від 35 до 37 тижнів та існує принаймні 1 фактор ризику нейротоксичності гіпербілірубінемії.
Спостереження після виписки
Терміни подальшого спостереження після виписки
Настанова 2004 р. і подальше роз’яснення 2009 р. рекомендували оцінювати ризик розвитку клінічно значущої гіпербілірубінемії на основі номограми з використанням постнатального віку в годинах і концентрації білірубіну в поєднанні з наявністю або відсутністю факторів ризику гіпербілірубінемії для визначення необхідності моніторингу. Ці рекомендації щодо подальшого спостереження використовували попередню номограму ризику, яка не враховувала гестаційний вік і фактори ризику нейротоксичності гіпербілірубінемії та була створена з досліджуваної популяції, яка виключала немовлят із позитивним результатом прямого тесту Кумбса.
Ця настанова рекомендує використовувати різницю між концентрацією білірубіну та порогом фототерапії на момент вимірювання для визначення інтервалу між випискою та подальшим спостереженням і необхідністю додаткових вимірювань ЗБС або TкБ. Алгоритм дій представлений на рис. 3. Цей підхід включає як гестаційний вік, так і інші фактори ризику нейротоксичності гіпербілірубінемії в процесі прийняття рішень.
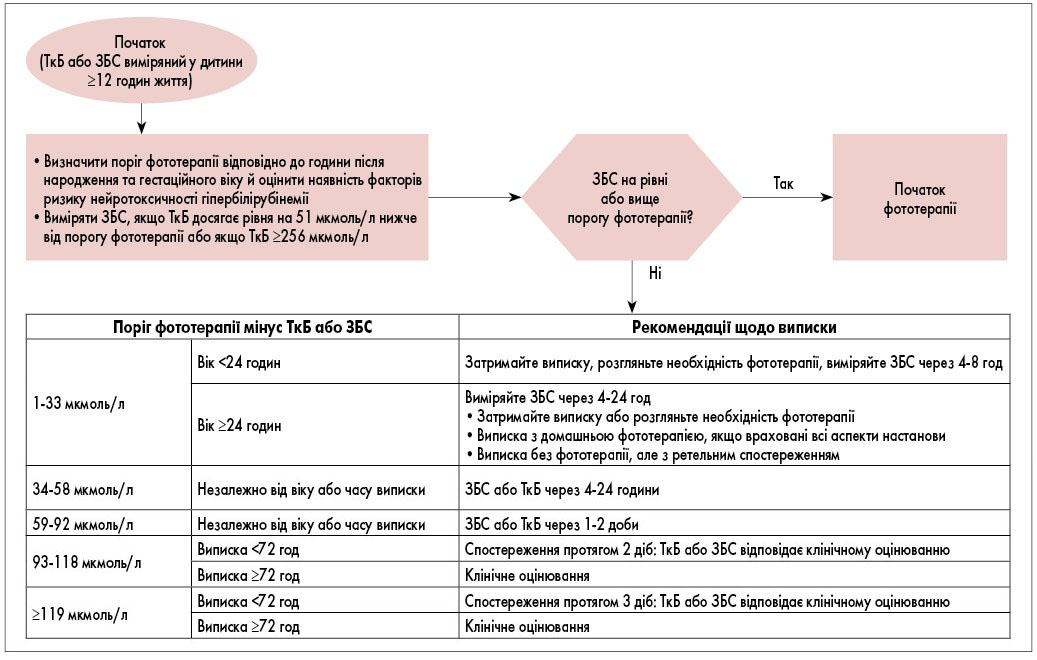 Рис. 3. Алгоритм дій під час госпіталізації немовлят після народження для визначення тактики подальшого спостереження за немовлятами, які не отримували фототерапію після виписки
Рис. 3. Алгоритм дій під час госпіталізації немовлят після народження для визначення тактики подальшого спостереження за немовлятами, які не отримували фототерапію після виписки
Ці рекомендації щодо подальшого спостереження базуються лише на лікуванні гіпербілірубінемії. Інші міркування, які можуть впливати на терміни спостереження, включають гестаційний та постнатальний вік, оцінку грудного вигодовування, втрату маси тіла після народження та оцінку благополуччя немовляти і батьків.
! Починаючи принаймні через 12 годин після народження, якщо розглядається виписка, різницю між концентрацією білірубіну, виміряною найближче до виписки, і порогом фототерапії під час вимірювання білірубіну слід використовувати для визначення тактики подальшого спостереження (рівень доказів C).
Недостатньо інформації для надання вказівок після виписки на основі TкБ або ЗБС, виміряних до 12 годин після народження. Будь-якому немовляті, виписаному до 12-годинного віку, необхідно провести контрольне визначення білірубіну у віці від 24 до 48 годин.
! Перед випискою всі сім’ї повинні отримати інформацію про неонатальну жовтяницю. Батькам слід надати письмову пам’ятку для полегшення догляду після виписки, включно з датою, часом і місцем контрольного огляду, а також, якщо необхідно, рекомендаціями щодо наступного вимірювання ТкБ або ЗБС. Інформацію про госпіталізацію при народженні, включно з останніми показниками TкБ або ЗБС і віком, в якому вони були виміряні, а також результат прямого тесту Кумбса (якщо такий є) слід передати лікарю первинної ланки медичної допомоги, який спостерігатиме за немовлям у подальшому. Якщо невідомо, хто проводитиме подальший догляд, цю інформацію також слід надати сім’ям (рівень доказів X).
Реферативний огляд статті Guideline Revision: Management of Hyperbilirubinemia in the Newborn Infant 35 or More Weeks of Gestation. Kemper A.R., Newman T.B., Slaughter J.L. et al. Pediatrics. 2022 Sep 1; 150 (3): e2022058859.
Підготувала Ольга Загора
Тематичний номер «Педіатрія» № 1 (67) 2023 р.




