2 грудня, 2021
Профілактика серцево-судинних захворювань у клінічній практиці
На сьогодні захворюваність та смертність від атеросклеротичних серцево-судинних захворювань (ССЗ) демонструють тенденцію до зниження у багатьох країнах Європи, проте досі залишаються вельми значущими. Існує нагальна потреба у корекції способу життя в загальній популяції, а фактори ризику атеросклеротичних ССЗ (АССЗ) часто погано піддаються лікуванню. Запобігання розвитку кардіоваскулярних подій шляхом зниження ймовірності ССЗ, зокрема чинників ризику, є важливим. Цільова група із профілактики ССЗ у клінічній практиці сумісно з експертами Європейського товариства кардіологів (ESC) та 12 міжнародних медичних спільнот за участю Європейської асоціації профілактичної кардіології (EAPC) розробили рекомендації щодо запобігання виникненню АССЗ. Мета цього документа – допомогти клініцистам при виборі та реалізації профілактичних, діагностичних чи терапевтичних стратегій та прийнятті спільного рішення з пацієнтом на основі його індивідуальних особливостей. Пропонуємо до вашої уваги основні положення рекомендацій.
Визначення факторів ризику ССЗ
Оцінка залежно від клінічних умов
Обґрунтування
Основними причинними та модифікованими факторами ризику АССЗ є аполіпопротеїн В – білок плазми крові, що входить до складу ліпопротеїнів низької щільності (ЛПНЩ), високий артеріальний тиск (АТ), куріння та цукровий діабет (ЦД). Важливим чинником ризику АССЗ також є ожиріння. Крім того, на оцінку ризиків, клінічне ведення окремих осіб та груп населення впливають стать і гендерна ідентичність. Підтверджено складність зв’язку між цими аспектами та ССЗ, а також психічним здоров’ям.
Визначення категорій пацієнтів, які отримають найбільшу користь від контролю факторів ризику АССЗ, – ключовий елемент при запровадженні профілактичних заходів. Вік є основним фактором серцево-судинного (СС) ризику, тож розподіл ризику за віковими групами важливий. Жінки ˂50 років та чоловіки ˂40 років майже завжди характеризуються низьким 10-річним СС-ризиком, але можуть мати несприятливі модифіковані чинники ризику, на тлі яких довгострокова ймовірність розвитку ССЗ різко зростає. І навпаки, у чоловіків ˃65 років та жінок ˃75 років майже завжди відзначають високий 10-річний ризик ССЗ.
Ймовірність ССЗ також слід оцінювати в осіб із ЦД 2-го типу та хворих на встановлене АССЗ. Визначення СС-ризику протягом життя у різних групах пацієнтів дозволяє оцінити довгострокову користь таких профілактичних заходів, як відмова від куріння, зниження рівня ліпідів та контроль АТ.
На даний час підтверджено важливість поетапного підходу до інтенсифікації лікування ССЗ. Він починається зі встановлення цілей профілактики для всієї популяції, незалежно від СС-ризику. Потім проводять стратифікацію СС-ризику та обговорюють потенційні переваги з пацієнтом. Якщо лікування розпочате, слід оцінити його ефективність і розглядати подальшу інтенсифікацію терапії для досягнення мети щодо контролю факторів ризику в усіх пацієнтів залежно від їхніх індивідуальних особливостей.
Рекомендації
Проведення систематичної глобальної оцінки ризику ССЗ рекомендоване особам із будь-яким основним фактором СС-ризику, як-от передчасні ССЗ у сімейному анамнезі, сімейна гіперхолестеринемія та чинники ризику ССЗ – куріння, артеріальна гіпертензія (АГ), ЦД, підвищений рівень ліпідів, ожиріння або супутні захворювання, що збільшують імовірність ССЗ (І, С). Систематичне визначення ризику ССЗ у чоловіків віком до 40 років та жінок до 50 років без відомих факторів СС-ризику виконувати недоцільно (ІІІ, С).
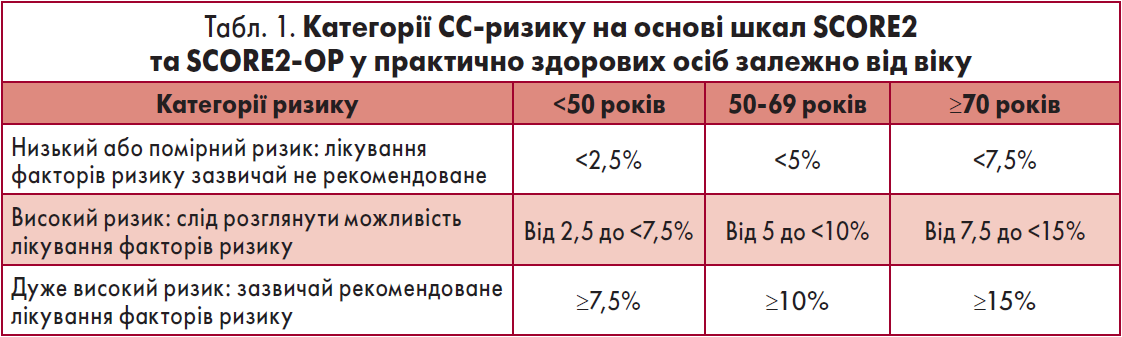
У практично здорових осіб віком <70 років без встановлених АССЗ, ЦД, хронічної хвороби нирок (ХХН), генетичних/рідкісних порушень ліпідів або АТ рекомендовано оцінити 10-річний фатальний та нефатальний ризик ССЗ, пов’язаний з інфарктом міокарда (ІМ) та інсультом, за допомогою шкали SCORE2 (І, В). У людей віком ≥70 років за відсутності вказаних вище чинників слід визначити 10-річний фатальний і нефатальний ризик ССЗ за допомогою інструмента SCORE2-OP, який використовують у представників старших вікових груп (І, В). Пацієнтів зі встановленими ССЗ та/або ЦД та/або нирковою недостатністю середнього чи тяжкого ступеня та/або генетичними чи рідкісними порушеннями ліпідів/АТ варто розглядати як групи високого або дуже високого ризику виникнення ССЗ (І, А).
Категорії CC-ризику на основі шкал SCORE2 та SCORE2-OP у практично здорових осіб відповідно до віку наведені у таблиці 1.
Поетапний підхід до інтенсифікації лікування, спрямований на посилений контроль факторів ризику, рекомендований для осіб із високим або дуже високим СС-ризиком, а також хворих на встановлені АССЗ та/або ЦД, з урахуванням імовірності СС-подій, переваг контролю чинників і модифікаторів ризику, супутніх захворювань та уподобань пацієнтів (І, В). Лікування факторів ризику АССЗ є доцільним у людей без ЦД, ХХН, генетичних/рідкісних порушень ліпідів або АТ, які відносяться до групи дуже високого ризику: ≥7,5; ≥10 та ≥15% за шкалою SCORE2 у віці до 50, 50‑69 і ≥70 років відповідно (І, С).
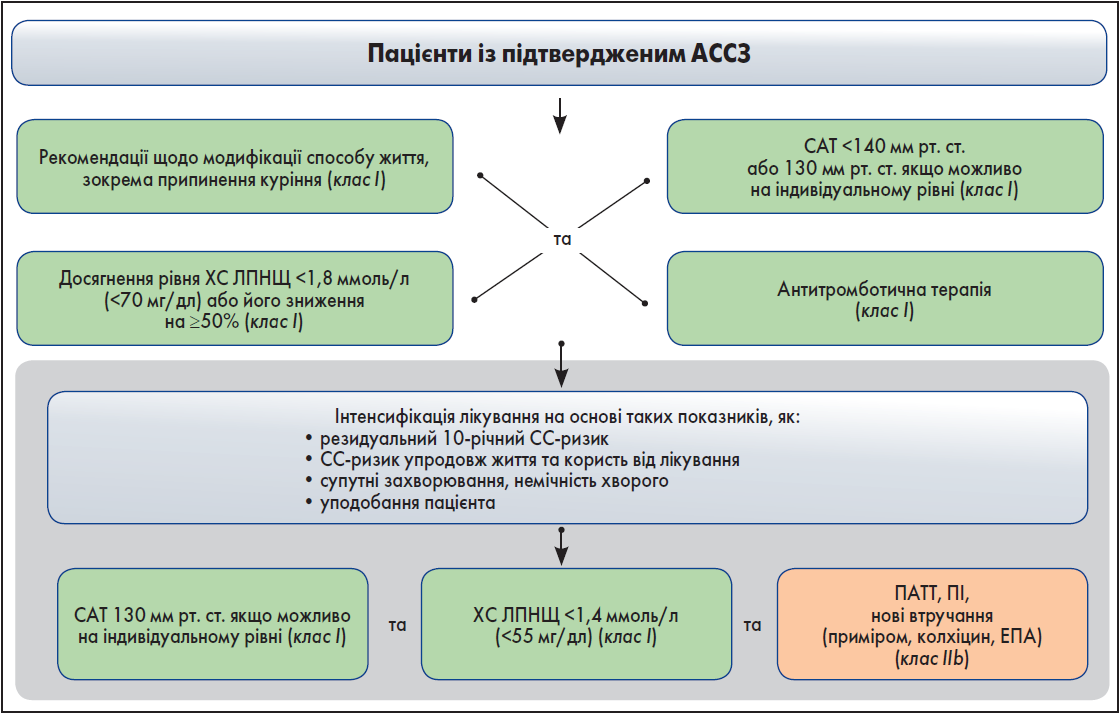
Блок-схему терапевтичних заходів для контролю СС-ризику та факторів ризику в пацієнтів зі встановленим АССЗ наведено на рисунку 1.
Рис. 1. Терапевтичні заходи для контролю СС-ризику та факторів ризику в пацієнтів зі встановленим АССЗ
Примітки: САТ – систолічний артеріальний тиск, ПАТТ – подвійна антитромбоцитарна терапія, ПІ – подвійне інгібування,
ЕПА – эйкозапентаєнова кислота.
При лікуванні слід дотримуватися оптимальних цільових показників САТ (<130 мм рт. ст.) та холестерину ЛПНЩ (відповідно до рівня ризику) згідно з рекомендаціями ESC/EAS (2019) та ESC/ESH (2018). Загалом має бути застосовано поетапний підхід: після етапу 1 передбачено перехід до посилених заходів на етапі 2.
Комунікація між лікарем та пацієнтом
Обґрунтування
В основі зменшення ймовірності ССЗ лежать належна оцінка переваг і недоліків лікування, індивідуальних ризиків пацієнта й ефективне інформування про них клініцистом, зокрема про важливість контролю факторів ризику (Spiegelhalter et al., 2011; Zipkin et al., 2014). Єдиного «правильного» підходу не існує; скоріше, терапевтична тактика залежить від уподобань хворого, емоційних факторів і розуміння ним проблеми.
Рекомендації
Лікар та хворий мають обговорювати ризик розвитку ССЗ і переваги лікування з огляду на потреби пацієнта (І, С).
Аналіз модифікаторів ризику
Обґрунтування
Оцінка додаткових чинників ризику ССЗ, окрім поширених, також важлива.
Психосоціальний стрес. Даний аспект пов’язаний із розвитком та прогресуванням АССЗ незалежно від загальних факторів ризику та статі. Для нього характерна наявність симптомів психічних розладів та стресових чинників, таких як самотність і критичні життєві події. І навпаки, показники психічного здоров’я, як-от оптимізм і потужна мотивація, пов’язані з меншою імовірністю психосоціального стресу (Rozanski, 2014). Також слід зазначити, що він значно корелює з соціально-економічними та поведінковими факторами ризику (тютюнокурінням, поганою прихильністю до лікування тощо) (Albus et al., 2019). Таким чином, скринінг пацієнтів з АССЗ на предмет психологічного стресу є важливим (Vaccarino et al., 2020; Jha et al., 2019).
Етнічна належність. Показники ризику ССЗ з огляду на етнічну належність варіюють. Тому слід використовувати відносний ризик залежно від країн та локальних інструментів оцінки.
Візуалізація. Визначення кальцієвого індексу судин (КІС), на додаток до аналізу звичайних факторів ризику, може змінити ступінь ризику ССЗ (Lin et al., 2018; Peters et al., 2012). Вищий кальцієвий індекс судин від очікуваного підвищує розрахований раніше ризик для пацієнта. Однак оцінка КІС не дає прямої інформації про загальне навантаження бляшок або тяжкість стенозу.
Контрастна комп’ютерно-томографічна ангіографія. Ця процедура дозволяє ідентифікувати коронарні стенози та прогнозувати серцеві події (Hadamitzky et al., 2009). Але чи покращує вона класифікування ризику або підвищує прогностичну цінність порівняно з оцінкою КІС, не встановлено.
Ультрасонографія сонних артерій. Систематична оцінка товщини інтима-медіа для покращення визначення імовірності ССЗ не рекомендована через відсутність методологічної стандартизації та додаткових переваг у прогнозуванні майбутніх СС-подій навіть у групі помірного ризику (Den Ruijter et al., 2012). Незважаючи на меншу кількість даних порівняно з КІС, оцінка бляшок у сонній артерії за допомогою ультразвукового дослідження впливає на ступінь ризику ССЗ (Stein et al., 2008; Peters et al., 2012). Цю процедуру розглядають у пацієнтів із помірним ризиком, якщо визначення КІС неможливе.
Інші методики. Жорсткість артерій зазвичай визначають за допомогою швидкості поширення пульсової хвилі в аорті або індексу збільшення артерії. Цей показник поліпшує прогнозування ймовірності розвитку ССЗ та класифікування ризиків (Vlachopoulos et al., 2010). Однак труднощі вимірювання та істотна систематична похибка обмежують проведення процедури (Tzoulaki et al., 2013). Вплив кісточково-плечового індексу на ступінь ризику також обмежений, можливо, за винятком жінок із помірним ризиком (Fowkes et al., 2008). Виконання ехокардіографії через брак даних стосовно ефекту на покращання прогнозування СС-ризику не рекомендоване.
Немічність, або крихкість. Це стан, що не залежить від віку або мультиморбідності та робить людину уразливішою до впливу стресових факторів. Немічність являє собою функціональний фактор ризику несприятливих результатів, зокрема високої частоти розвитку ССЗ та інших хвороб, а також смертності. Поширеність крихкості зростає з віком, але особи одного хронологічного віку можуть істотно відрізнятися за станом здоров’я та життєздатністю. «Біологічний» вік набагато важливіший у контексті клінічного статусу й тяжких наслідків (включно із СС-подіями) (Afilalo et al., 2014; Singh et al., 2014). Наявність супутніх патологій може посилити крихкість людини.
Сімейний анамнез. Взаємодію генетичних чинників та навколишнього середовища відображає сімейний анамнез передчасного ССЗ, що є простим індикатором СС-ризику (Bachmann et al., 2012). Однак він лише незначно покращує прогнозування ймовірності АССЗ порівняно з оцінкою традиційних факторів ризику (Antiochos et al., 2016; Veronesi et al., 2014).
Генетичні фактори. Етіологія АССЗ має генетичний компонент, але у профілактичних підходах ці дані наразі не використовуються (Musunuru, Kathiresan, 2019). Необхідні додаткові дослідження в галузі полігенної оцінки ризику для його стратифікації (Lambert et al., 2021; Wand et al., 2021).
Соціально-економічні детермінанти. Низький соціально-економічний статус та стрес на роботі незалежно пов’язані з розвитком та прогнозуванням АССЗ для представників обох статей (Schultz et al., 2018). Найсильнішу кореляцію виявлено між низьким доходом та смертністю від ССЗ (Khaing et al., 2018). Стрес, асоційований із роботою, визначається навантаженням та дисбалансом між зусиллями й винагородою.
Рекомендації
Регулярна оцінка інших потенційних модифікаторів ризику, як-то генетичні чинники, церкулювальні чи сечові біомаркери, судинні тести / методи візуалізації (крім визначення кальцієвого індексу судин або ультрасонографії сонних артерій на предмет бляшок) не рекомендована (ІІІ, В).
Визначення СС-ризику з огляду на специфічні клінічні умови
Обґрунтування
Індивідуальні СС-ризики, які визначають за допомогою загальноприйнятих інструментів оцінки, підлягають уточненню шляхом аналізу потенційних модифікаторів ризику. На додачу, на ймовірність ССЗ можуть негативно впливати специфічні клінічні стани, що також бувають пов’язані з погіршенням клінічного прогнозу. До того ж багато з них мають спільні фактори ризику ССЗ та АССЗ, тому їх лікування дозволяє синергічно зменшити загальний тягар захворювання.
Рекомендації
У всіх пацієнтів із ХХН з/без ЦД рекомендований відповідний скринінг на наявність АССЗ та прогресування захворювання нирок, включно з моніторингом альбумінурії (І, С). В онкохворих слід проводити контроль дисфункції серця за допомогою методів візуалізації та циркулювальних біомаркерів до, періодично під час та після лікування раку (І, В). В осіб, які отримують терапію із приводу раку, необхідні скринінг факторів та оптимізація профілю СС-ризику (І, С). Всім пацієнтам із хронічним обструктивним захворюванням легень рекомендовано проходити обстеження на наявність чинників ризику та безпосередньо АССЗ (І, С).
Хворим на ССЗ, ожиріння та АГ показане регулярне обстеження щодо якості сну (І, С). Якщо є значні проблеми зі сном та відсутність змін упродовж чотирьох тижнів при застосуванні заходів із гігієни сну, рекомендовано звернутися до фахівця (І, С).
Психічні розлади зі значними функціональними порушеннями доцільно розглядати як такі, що впливають на загальний ризик ССЗ (І, С).
Контроль факторів ризику і заходи на індивідуальному рівні
Оптимізація способу життя
Обґрунтування
Фізична активність асоційована зі зниженням ризику багатьох несприятливих наслідків для здоров’я і факторів ризику в будь-якому віці та для представників обох статей. Існує зворотна залежність між фізичними навантаженнями помірної/значної інтенсивності та смертністю від усіх причин, захворюваністю і летальними випадками від ССЗ, а також захворюваністю на ЦД 2-го типу (Kraus et al., 2019; Kyu et al., 2016).
Харчові звички корелюють із СС-ризиком, переважно на основі таких факторів ризику, як рівень ліпідів, АТ, маса тіла та ЦД (European Heart Network, 2020). Дотримання здорового харчування для мінімізації ймовірності ССЗ є важливим. Надмірне споживання алкоголю пов’язане з вищим ризиком усіх підтипів інсульту, ішемічної хвороби серця (ІХС), серцевої недостатності (СН) та деяких менш поширених ССЗ (Wood et al., 2018). Підтверджено, що помірне його вживання асоційоване з меншою імовірністю розвитку ССЗ.
Рекомендації
Дорослим будь-якого віку рекомендовано займатися аеробною активністю середньої інтенсивності щонайменше 150‑300 хв на тиждень, сильної – 75‑150 хв на тиждень або еквівалентно комбінувати, щоб зменшити захворюваність і смертність від ССЗ та будь-яких причин (І, А). На додаток до аеробної активності, слід виконувати вправи з обтяженим опором ≥2 днів на тиждень для зниження частоти летальних випадків від усіх причин (І, В). Якщо пацієнт не здатний виконувати зазначені навантаження, то має залишатися активним, наскільки дозволяють стан здоров’я та його можливості (І, В). Також варто скоротити малорухомий спосіб життя для зниження рівня захворюваності й летальності через ССЗ та інші причини (І, В).
Здорове харчування рекомендоване всім людям як наріжний камінь профілактики ССЗ (І, А). Для зниження СС-ризику доцільною є середземноморська або подібна дієта (І, А). Слід замінити насичені жири ненасиченими, щоб зменшити ймовірність ССЗ (І, А). Також варто скоротити споживання солі для зниження АТ і СС-ризику (І, А). Рекомендовано віддавати перевагу рослинній їжі, багатій на клітковину, яка включає цільнозернові, фрукти, овочі, бобові та горіхи, а також рибі (бажано жирній) хоча б раз на тиждень і обмежити споживання обробленого м’яса (І, В). Крім того, необхідно обмежити вживання алкоголю максимум до 100 г на тиждень і цукру, особливо цукровмісних напоїв (І, В).
Особам із надмірною вагою та ожирінням рекомендовано зменшити масу тіла для зниження АТ, дисліпідемії та ймовірності розвитку ЦД 2-го типу, іншими словами, покращити профіль ризику ССЗ (І, А). Важливо загалом дотримуватися здорового харчування для зниження СС-ризику (І, А).
Психічне здоров’я та психосоціальні втручання
Обґрунтування
Оптимізація способу життя знижує СС-ризик та покращує психічне здоров’я. Зокрема, відмова від куріння, лікувальна фізкультура і здорове харчування зменшують прояви депресії (Taylor et al., 2014; Opie et al., 2017). Заходи для припинення куріння, поліпшення фізичної активності та харчування, що базуються на доказах, вважаються корисними для осіб із психічними розладами (Palmer et al., 2018; Osborn et al., 2019). Останні асоційовані з підвищеним СС-ризиком та погіршенням прогнозу в пацієнтів з АССЗ через СС-події або інші причини смерті, включно з суїцидами. Лікування психічних порушень ефективно зменшує симптоми стресу та покращує якість життя хворих.
Рекомендації
Пацієнти із психічними порушеннями потребують посиленої уваги та підтримки для покращення прихильності до змін способу життя та медикаментозного лікування (І, С). Особам із АССЗ, які страждають на психічні розлади, рекомендовано надання науково обґрунтованої психіатричної допомоги та міждисциплінарний підхід (І, В). Хворим на СН і тяжку депресію не слід призначати селективні інгібітори зворотного захоплення серотоніну, інгібітори зворотного захоплення серотоніну й норадреналіну та трициклічні антидепресанти (ІІІ, В).
Необхідно повністю відмовитися від куріння, оскільки вживання тютюну є потужною і незалежною причиною розвитку АССЗ. Відмова від куріння рекомендована незалежно від підвищення ваги.
Контроль рівня ліпідів у різних групах хворих
Обґрунтування
Підтверджено, що ключовою подією, що ініціює атерогенез, є утримання ЛПНЩ та інших багатих на холестерин (ХС) ліпопротеїнів у стінках артерій. Причинну роль ХС ЛПНЩ та інших апо-В-вмісних ліпопротеїнів у розвитку АССЗ безперечно продемонстровано у межах генетичних, обсерваційних та інтервенційних досліджень (Ference et al., 2017). Було показано, що відносне зниження СС-ризику пропорційне абсолютному зменшенню вмісту ХС ЛПНЩ, незалежно використовуваного з цією метою лікування (CTT Collaboration, 2010). Навіть незначне абсолютне зменшення концентрації ХС ЛПНЩ може сприяти суттєвому абсолютному зниженню ризику в пацієнтів із високою або дуже високою ймовірністю ССЗ.
У нещодавньому рандомізованому контрольованому дослідженні вивчали цільові показники ХС ЛПНЩ у пацієнтів після перенесеного ішемічного інсульту або транзиторної ішемічної атаки (ТІА) з цільовим рівнем ХС ЛПНЩ <1,8 ммоль/л (70 мг/дл). У хворих при застосуванні статинів і, за потреби, езетимібу мав місце нижчий СС-ризик, ніж у таких із показником 2,3‑2,8 ммоль/л (90‑110 мг/дл) (Amarenco et al., 2020).
Перед початком лікування в осіб із ССЗ необхідно виключити наявність дисліпідемії, вторинної щодо інших станів. Вторинні дисліпідемії також можуть бути викликані зловживанням алкоголем, ЦД, синдромом Кушинга, захворюваннями печінки та нирок, а також ліками (наприклад, кортикостероїдами). Крім того, оптимізація способу життя має вирішальне значення для всіх пацієнтів із рівнем ліпідів, вищим за оптимальний.
Доступні на сьогодні ліпідознижувальні препарати включають статини, фібрати, секвестранти жовчних кислот, селективні інгібітори абсорбції ХС (наприклад, езетиміб) і, останнім часом, інгібітори пропротеїнової конвертази субтилізин/кексин типу 9 (PCSK9). Бемпедоєва кислота – пероральний інгібітор синтезу ХС, нещодавно була схвалена у кількох країнах. Її переважно призначають у комбінації з езетимібом у пацієнтів з непереносимістю статинів.
Очікуване зниження рівня ХС ЛПНЩ у відповідь на терапію у різних людей може значно варіювати (рис. 2) (Mach et al., 2020). Тому рекомендований моніторинг впливу на вміст ХС ЛПНЩ з його оцінкою через 4‑6 тижнів після початку чи зміни будь-якої стратегії лікування.
Рис. 2. Очікуване зниження рівня ХС ЛПНЩ на тлі комбінованої терапії
Статини знижують концентрацію ХС ЛПНЩ, що сприяє зменшенню захворюваності та смертності від АССЗ, а також потреби у втручаннях на коронарних артеріях. Статини також знижують рівень тригліцеридів (ТГ) і можуть зменшити ймовірність розвитку панкреатиту. Тому вони є препаратами першого вибору в пацієнтів із підвищеним ризиком АССЗ (Mach et al., 2020).
За даними метааналізів, поєднання статинів з езетимібом є корисним щодо зниження ХС ЛПНЩ (CTT Collaboration, 2010; Mach et al., 2020). Сприятливий ефект езетимібу також підтверджується результатами генетичних досліджень (Stitziel et al., 2014). Тож езетиміб слід розглядати як препарат другої лінії чи лікувальну тактику замість статинів, коли терапевтичної мети не досягнуто, або ж якщо статини не можуть бути призначені. Крім того, інгібітори PCSK9 знижують рівень ХС ЛПНЩ до 60% як у вигляді монотерапії, так і на додаток до статинів у максимально допустимій дозі та/або інших гіполіпідемічних засобів, як-от езетиміб.
Останні дані свідчать про посилення ролі ХС ЛПНЩ як фактора ризику АССЗ у літніх пацієнтів (Mortensen, Nordestgaard, 2020). У дослідженнях показано, що статини та інші гіполіпідемічні препарати значно зменшують СС-події незалежно від віку (CTT Collaboration, 2019; Gencer et al., 2020). В осіб до 70 років статини рекомендовані для первинної профілактики ССЗ залежно від ступеня ризику. Після цього віку початок лікування даними препаратами для первинної профілактики можна розглядати за наявності дуже високого ризику з огляду на модифікатори ризику, передбачувану користь протягом життя, супутні захворювання та уподобання пацієнтів.
Також зазначені вище чинники та оцінку ризику слід враховувати при застосуванні поетапного підходу до контролю ліпідів у хворих на ЦД. Адже зменшення концентрації ХС ЛПНЩ у цій когорті пацієнтів послідовно асоційоване зі зниженням ризику ССЗ.
Пацієнти із ХХН мають високий або дуже високий ризик розвитку АССЗ та характерну дисліпідемію. Терапія статинами або їх комбінація з езетимібом (що дозволяє значно знизити рівень ХС ЛПНЩ без збільшення дози статинів) сприятливо впливає на клінічні наслідки АССЗ при ХХН (Wanner et al., 2014). При переході ХХН у термінальну стадію застосування гіполіпідемічних препаратів можна продовжити, але у хворих із вже наявною термінальною стадією ХХН розпочинати таке лікування не рекомендовано.
Рекомендації
Поетапний підхід до інтенсифікації лікування рекомендований для практично здорових осіб із високим або дуже високим СС-ризиком, а також пацієнтів зі встановленим АССЗ та/або ЦД з урахуванням імовірності ССЗ, переваг терапії, модифікаторів ризику, супутніх захворювань та уподобань хворих (І, С).
У контексті зниження ХС ЛПНЩ за допомогою фармакотерапії в осіб віком <70 років слід призначати статини високої інтенсивності у максимально допустимій дозі для досягнення цільових показників ЛПНЩ, встановлених для конкретної групи ризику (І, А). Пацієнтам із підтвердженим АССЗ рекомендовано гіполіпідемічну терапію для кінцевого цільового вмісту ХС ЛПНЩ <1,4 ммоль/л (55 мг/дл) та його зниження на ≥50% порівняно з вихідним рівнем (І, А). Якщо на тлі використання максимально допустимої дози статину не вдається досягти цільових значень, доцільно поєднати його з езетимібом (І, В). Для вторинної профілактики пацієнтам, які не досягають цільових рівнів на терапії статином у найбільшій переносимій дозі та езетимібом, рекомендоване комбіноване лікування, що включає інгібітор PCSK9 (І, А).
Особам із сімейною гіперхолестеринемією групи дуже високого ризику (з АССЗ або іншим основним фактором ризику) за неможливості досягти цільових показників у разі застосування статину в максимально допустимій дозі та езетимібу доцільною є комбінована терапія, що передбачає призначення інгібітора PCSK9 (І, С). Статини не рекомендовані пацієнткам у пременопаузі, які планують вагітність або не використовують належну контрацепцію (ІІІ, С).
Стратегія статинотерапії для літніх хворих (˃70 років) на АССЗ є такою самою, як для молодших пацієнтів (І, А).
Лікування статинами – варіант першого вибору для зменшення імовірності ССЗ в осіб групи високого ризику із гіпертригліцеридемію: ТГ >2,3 ммоль/л (200 мг/дл) (І, А). За наявності значного порушення функції нирок та/або потенційної медикаментозної взаємодії приймання статинів необхідно розпочинати з низьких доз (І, C).
У хворих на ЦД 2-го типу із дуже високим ризиком (наприклад, зі встановленим АССЗ та/або тяжким ураженням органів-мішеней) інтенсивна гіполіпідемічна терапія в кінцевому підсумку має бути спрямована на ≥50% зниження ХС ЛПНЩ та досягнення цільового рівня <1,4 ммоль/л (55 мг/дл) (І, А). У пацієнтів віком >40 років із ЦД 2-го типу та високим ризиком рекомендоване гіполіпідемічне лікування, щоб досягти зменшення ХС ЛПНЩ на ≥50% та цільового вмісту <1,8 ммоль/л (70 мг/дл) (І, А).
У контексті контролю рівня ліпідів в осіб із помірною та тяжкою ХХН (3‑5-го ступеня згідно з критеріями Ініціативи щодо якості результатів хвороби нирок) застосування статинів або комбінації статину/езетимібу рекомендоване за відсутності потреби в діалізі (І, А). У хворих на ХХН, яким необхідне проведення діалізу, що не мають АССЗ, розпочинати терапію статинами не рекомендовано (ІІІ, А).
Лікування АГ
Обґрунтування
АГ – одна з найважливіших попереджуваних причин передчасної захворюваності та смертності. АГ уражає понад 1 млрд людей у всьому світі, з поширеністю 30‑45% серед дорослих та більш ніж 60% в осіб >60 років, а також становить 10 млн смертей у світі щорічно (Forouzanfar et al., 2017). Незважаючи на велику доказову базу ефективності зниження АТ для зменшення ймовірності та смерті від ССЗ, діагностика й лікування АТ залишаються неоптимальними (Chow et al., 2013).
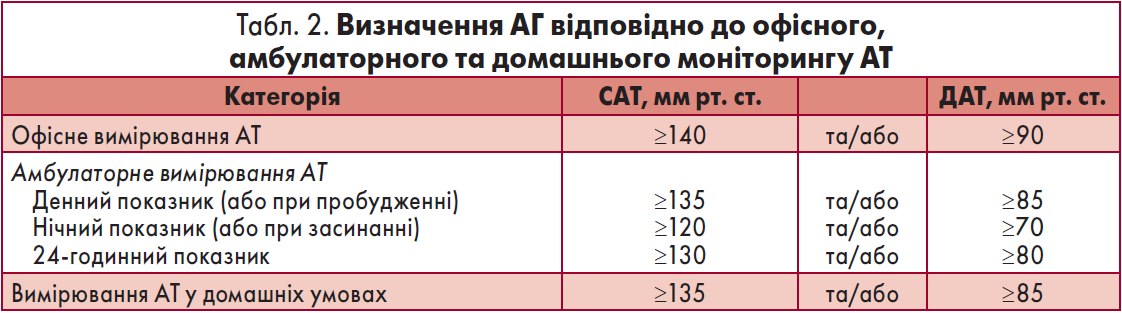
В ідеалі всі дорослі мають проходити обстеження щодо наявності АГ, принаймні особи із надмірною вагою або сімейним анамнезом АГ (Siu, 2015). При підозрі на АГ діагноз слід підтвердити шляхом повторних офісних вимірювань АТ протягом кількох відвідувань лікаря або 24-годинного амбулаторного чи домашнього моніторингу. Визначення АГ відповідно до офісного, амбулаторного та домашнього моніторингу АТ наведені в таблиці 2.
Клінічна оцінка включає такі кроки, як (Williams et al., 2018):
- Визначення факторів ризику АССЗ або наявності захворювань серця, судин чи нирок.
- Виявлення доказів на підтвердження ураження органів, опосередкованого АГ (HMOD), наприклад гіпертрофії лівого шлуночка (ЛШ), патології нирок або ретинопатії.
- Розгляд потенційних вторинних причин АГ, як-то реноваскулярне захворювання, гіперальдостеронізм або феохромоцитома. Також слід уважно оцінити можливість зловживання психоактивними речовинами та ліками, які здатні підвищити АТ (циклоспорин, симпатоміметики).
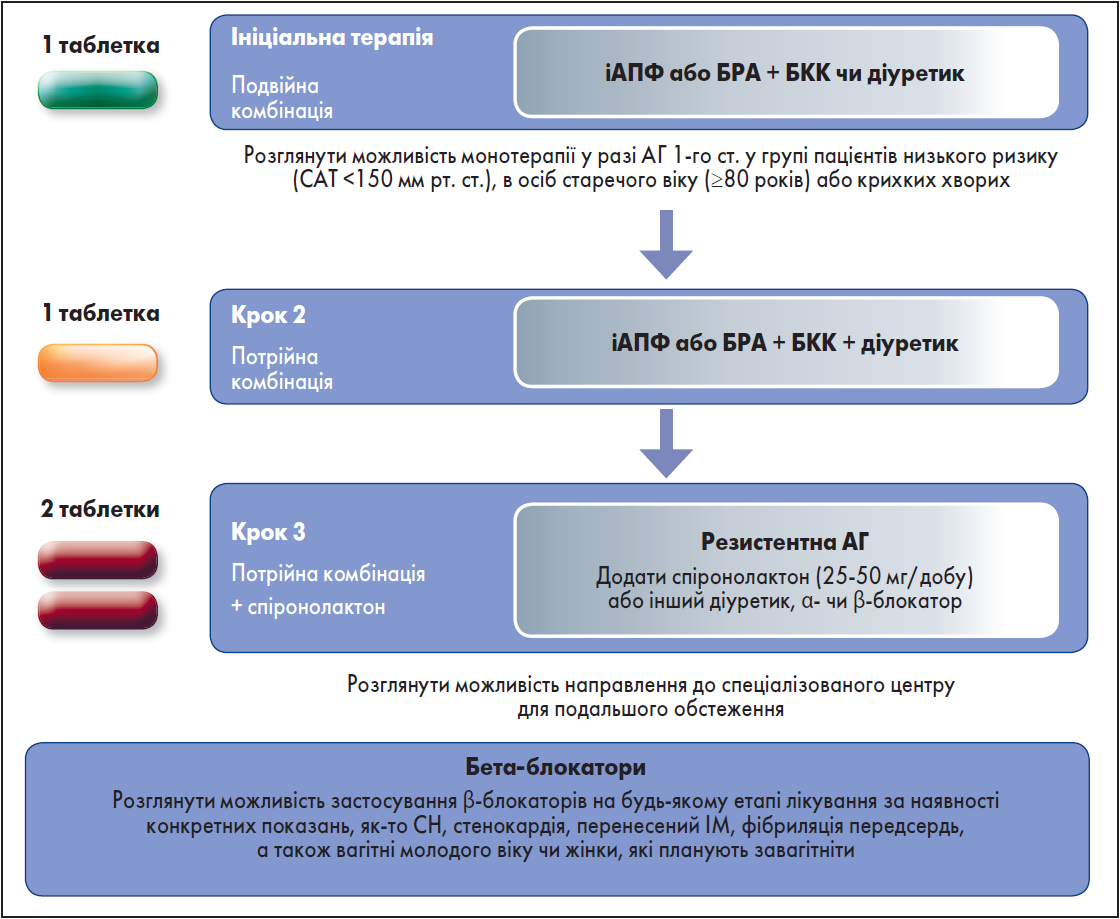
Лікування АГ передбачає зміну способу життя для всіх пацієнтів та застосування медикаментозної терапії у більшості хворих. Рекомендований алгоритм лікування на основі найкращих наявних доказів, прагматичних та патофізіологічних міркувань наведений на рисунку 3 (Williams et al., 2018).
Рис. 3. Основна стратегія лікування АГ
Примітка: Цей алгоритм підходить для більшості пацієнтів зі HMOD, ЦД, цереброваскулярними патологіями та захворюваннями периферичних артерій.
Рекомендації
Відповідно до офісних показників, АТ класифікують як оптимальний, нормальний, підвищений нормальний АТ або АГ 1‑3-го ст. (І, C). Діагноз АГ базується на (І, C):
- повторних вимірюваннях офісного АТ під час ≥1 візиту до лікаря, за винятком випадків тяжкої АГ (наприклад, 3-го ст. та особливо у пацієнтів із високим ризиком) або
- вимірюванні АТ методом амбулаторного й домашнього моніторингу.
Для оцінки наявності HMOD в усіх пацієнтів слід вимірювати креатинін сироватки крові, розрахункову швидкість клубочкової фільтрації, електролітів та співвідношення альбумін/креатинін (І, В). Електрокардіограма у 12 відведеннях є доцільною для усіх хворих, а ехокардіографія – у разі відхилень на електрокардіограмі або наявності ознак/симптомів дисфункції ЛШ (І, C). Фундоскопія або візуалізація сітківки рекомендовані особам з АГ 2‑3-го ст. та всім хворим на АГ та ЦД (І, C).
При АГ 1-го ст. лікування необхідно починати на підставі абсолютного СС-ризику, передбачуваної користі протягом життя та наявності HMOD. Пацієнтам з АГ 2-го ст. або вище рекомендовано фармакотерапію (І, А).
Що стосується офісних цільових рівнів АТ, первинною метою лікування має бути зниження АТ до <140/90 мм рт. ст., а наступні показники слід адаптувати залежно від віку та супутніх патологій (І, А). У пацієнтів, які отримували терапію у віці 18‑69 років, у більшої частки варто знизити систолічний АТ (САТ) до цільового діапазону 120‑130 мм рт. ст. (І, А). У пролікованих хворих віком ≥70 років рекомендований САТ зазвичай становить <140 мм рт. ст. (<130 мм рт. ст. якщо можливо на індивідуальному рівні) (І, А). У всіх осіб, що пройшли лікування, необхідно знизити діастолічний АТ (ДАТ) до <80 мм рт. ст. (І, А). Людям із підвищеним нормальним або високим АТ рекомендовано корекцію способу життя (І, А).
Антигіпертензивне лікування у більшості хворих рекомендовано розпочинати з поєднання двох препаратів, бажано в одній таблетці (single-pill) (І, В). Виняток становлять слабкі пацієнти похилого віку та хворі на АГ 1-го ст. із низьким ризиком (особливо якщо САТ <150 мм рт. ст.) (І, В). Найбільш оптимальні комбінації включають блокатор ренінангіотензинової системи (РАС) – іАПФ або блокатор рецепторів ангіотензину ІІ (БРА) та блокатор кальцієвих каналів (БКК) чи діуретик; також можуть бути використані інші комбінації ліків із п’яти основних класів, як-от іАПФ, БРА, β-блокатор, БКК, тіазидні/тіазидоподібні діуретики (І, А).
Якщо АТ не вдається контролювати за допомогою комбінації двох препаратів, доцільним є застосування трикомпонетної терапії, зазвичай блокатора РАС із БКК та діуретика, бажано в одній таблетці (І, А). У разі якщо за такого лікування АТ також не піддається контролю, слід додати спіронолактон, а за його непереносимості – інші діуретики (приміром, амілорид), зокрема у вищих дозах, α-/β-блокатори або клонідин (І, В). Поєднання двох блокаторів РАС не рекомендоване (ІІІ, А).
Терапія ЦД
Обґрунтування
Запобігання АССЗ у пацієнтів із ЦД 2-го типу здійснюється за тими самими принципами, що й в осіб без даної хвороби, за винятком необхідності контролю рівня глюкози. Досягнення цільових показників АТ і ХС ЛПНЩ є особливо важливим. Оптимізація способу життя є першочерговим пріоритетом у межах профілактики АССЗ та лікування ЦД.
Встановлено важливість інтенсивного зниження глюкози щодо зменшення ймовірності розвитку ССЗ в осіб, у котрих нещодавно виявили ЦД. Окрім того, підтверджено необхідність жорсткого контролю глюкози для зниження ризиків як мікро-, так і макросудинних ускладнень у чоловіків та жінок із ЦД 1-го типу (Marx et al., 2021).
Рекомендації
Особам із ЦД для запобігання розвитку ССЗ рекомендовано модифікацію способу життя, зокрема відмовитися від куріння, споживати продукти з низьким вмістом насичених жирів та високим – клітковини, займатися аеробними фізичними вправами й силовими тренуваннями (І, А). Також пацієнтам слід зменшити споживання енергії для втрати, запобігання або уповільнення набору ваги (І, А).
Цільовий рівень глікованого гемоглобіну для зниження СС-ризику та мікросудинних ускладнень ЦД у більшості дорослих із ЦД 1-го або 2-го типу становить <7% (53 ммоль/моль) (І, А).
Метформін рекомендований як терапія першої лінії після оцінки функції нирок у більшості пацієнтів без перенесених АССЗ, ХХН або СН (І, В). В осіб із ЦД 2-го типу та АССЗ доцільне застосування агоніста рецепторів глюкагоноподібного пептиду 1 (GLP‑1RA) або інгібітора натрійзалежного котранспортера глюкози 2-го типу (SGLT2) для зменшення кардіоваскулярних та/або кардіоренальних наслідків (І, А). Із цією ж метою слід призначати інгібітор SGLT2 хворим на ЦД 2-го типу та ХХН (І, А). Пацієнтам із ЦД 2-го типу та СН зі зниженою фракцією викиду (ФВ) рекомендовано інгібітор SGLT2 для зменшення кількості госпіталізацій із приводу СН та летальних випадків від ССЗ (І, А).
Антитромботична терапія
Обґрунтування
Метааналіз даних пацієнтів, що характеризуються низьким СС-ризиком, продемонстрував зниження частоти АССЗ на 12% на тлі застосування ацетилсаліцилової кислоти (АСК), але збільшення великої кровотечі (Baigent et al., 2009). Оновлений метааналіз не показав зменшення смертності від ССЗ або будь-яких причин на тлі АСК, але було виявлено меншу ймовірність нефатального ІМ та ішемічного інсульту. При цьому ризик великої, внутрішньочерепної та шлунково-кишкової кровотечі зріс, але не фатальної (Abdelaziz et al., 2019). Тож загалом, хоча АСК не слід рутинно призначати пацієнтам без встановленого АССЗ, у деяких хворих із високим або дуже високим СС-ризиком потенційна користь переважає ризики (Halvorsen et al., 2014; Yusuf et al., 2021).
При підтвердженому АССЗ АСК асоційована зі значним зменшенням серйозних судинних ускладнень, включно з інсультом та коронарними подіями, та зниженням загальної смертності на 10% (Baigent et al., 2009). Ця користь переважає ризики кровотеч.
У хворих, що перенесли ІМ, інсульт або захворювання артерій нижніх кінцівок (ЗАНК), клопідогрель показав незначні переваги щодо ішемічних подій порівняно з АСК із подібним профілем безпеки.
Рекомендації
АСК у дозі 75‑100 мг/добу рекомендована для вторинної профілактики ССЗ (І, А). Клопідогрель по 75 мг/добу є альтернативою АСК у разі її непереносимості (І, В). Клопідогрель у дозі 75 мг/добу може мати переваги перед АСК в осіб зі встановленим АССЗ (ІІb, А). Застосування інгібітора протонної помпи разом з антитромбоцитарною терапію доцільне у пацієнтів, які мають значну ймовірність виникнення шлунково-кишкової кровотечі (І, В). У хворих на ЦД із високим або дуже високим ризиком ССЗ може бути розглянуто АСК у низьких дозах для первинної профілактики за відсутності чітких протипоказань (ІІb, А).
Призначення антиагрегантів не рекомендоване особам із низьким/помірним СС-ризиком через підвищений ризик великої кровотечі (ІІІ, А).
Контроль ризику ССЗ залежно від клінічних умов
Ішемічна хвороба серця
Обґрунтування
Аспекти профілактики ССЗ залежать від конкретних клінічних умов. Значна кількість пацієнтів вже мають супутні захворювання, що наражає їх на додатковий ризик. Серед коморбідностей, які можуть супроводжувати ІХС, слід відзначити СН, АГ, порушення ліпідного обміну та роботи щитовидної залози, ЦД, ожиріння, ХХН, апное уві сні тощо (McDonagh et al., 2021).
Рекомендації
Пацієнтам із перенесеним ІМ або реваскуляризацією рекомендовано приймати АСК у дозі 75‑100 мг/добу (І, А). Також лікування АСК по 75‑100 мг/добу можна розглядати в осіб без перенесеного ІМ або реваскуляризації в анамнезі, але з остаточно підтвердженою ІХС за допомогою візуалізації (ІІb, С). При гострому коронарному синдромі слід застосовувати подвійну антитромбоцитарну терапію (ПАТТ) з інгібітором P2Y12-рецепторів на додаток до АСК протягом 12 місяців, якщо немає протипоказань, таких як надмірний ризик кровотечі (І, А).
Хворим на хронічний коронарний синдром, окрім АСК, необхідно використовувати клопідогрель у дозі 75 мг/добу протягом шести місяців після коронарного стентування, незалежно від типу стенту, якщо не вказаний коротший термін (1‑3 місяці) через ризик або виникнення загрозливої для життя кровотечі (І, А).
Інгібітори АПФ (або БРА) рекомендовані у випадках, коли у пацієнтів наявні інші клінічні стани, наприклад СН, АГ або ЦД (І, А). Бета-блокатори доцільно приймати особам із дисфункцією ЛШ або систолічною СН (І, А). Хворим на підтверджене АССЗ варто призначити пероральне гіполіпідемічне лікування для досягнення цільового значення ХС ЛПНЩ <1,4 ммоль/л (55 мг/дл) та його зниження ≥50% порівняно з вихідним рівнем (І, А).
Серцева недостатність
Обґрунтування
Лікування СН спрямоване на зменшення смертності, кількості госпіталізацій та поліпшення якості життя хворих (McDonagh et al., 2021). Для досягнення цієї мети необхідні мультидисциплінарний підхід та структуроване подальше спостереження з навчанням і корекцією способу життя пацієнтів, оптимізацією фармакотерапії, використанням засобів телемедицини, психосоціальною підтримкою та покращенням доступу до медичної допомоги (McAlister et al., 2004; Feltner et al., 2014).
Рекомендовано проводити скринінг усіх осіб із СН на наявність супутніх захворювань та якщо такі виявлено – призначити відповідне лікування.
Рекомендації
Для зниження ризику госпіталізації та смерті осіб із симптоматичною СН II‑IV функціонального класу за критеріями Нью-Йоркської асоціації серця (NYHA) зі зниженою ФВ (ФВ ЛШ <40%) має бути включено до комплексної програми кардіологічної реабілітації (І, А). Стабільним хворим на СНзнФВ з метою зменшення ймовірності госпіталізації з приводу СН рекомендовано кардіологічну реабілітацію на основі фізичних навантажень (І, А). Окрім того, необхідно проводити скринінг пацієнтів із СН щодо ССЗ та інших соматичних супутніх захворювань і у разі їх наявності лікувати, якщо доступні ефективні й безпечні втручання не лише для полегшення симптомів, але й для покращення прогнозу (І, А).
Застосування іАПФ на додаток до β-блокаторів та антагоністів мінералокортикоїдних рецепторів (АМР) є доцільним в осіб із симптоматичною СНзнФВ для зниження ризику госпіталізації та смерті (І, А). Бета-блокатор як доповнення до іАПФ або інгібітора рецепторів ангіотензину/неприлізину (ARNI) та АМР пацієнтам зі стабільною симптоматичною СНзнФВ слід призначати для зменшення ймовірності госпіталізації та летальних випадків через СН (І, А).
АМР рекомендовані категорії хворих на СНзнФВ, які вже проходили лікування іАПФ (або ARNI) та β-блокатором, для зниження ризику госпіталізації та смерті (І, А). Слід розглянути заміну іАПФ сакубітрилом/валсартаном для зменшення ймовірності госпіталізації та смерті у пацієнтів зі СНзнФВ (І, В).
Застосування БРА може бути доцільним для зниження ризику госпіталізації через СН або летальності від ССЗ в осіб із симптоматичною СНзнФВ, у яких наявна непереносимість іАПФ та/або ARNI (пацієнти також повинні отримувати β-блокатори та АМР) (І, В).
Дапагліфлозин чи емпагліфлозин рекомендовані хворим на СНзнФВ на додаток до оптимального лікування іАПФ (або ARNI), β-блокаторів і АМР для зменшення ймовірності госпіталізації та смерті (І, А). Діуретики варто застосовувати пацієнтам із СНзнФВ з ознаками та/або симптомами застійних явищ для зниження ризику госпіталізації (І, С).
Цереброваскулярні захворювання
Обґрунтування
Терапевтичні втручання при цереброваскулярних захворюваннях залежать від типу інсульту – ішемічного або геморагічного (Kernan et al., 2014; Steiner et al., 2014). Ішемічні події переважно викликані атеротромбозом, серцевою емболією або захворюванням дрібних судин (Ornello et al., 2018).
Внутрішньомозкові крововиливи здебільшого спричинені гіпертонічною та/або церебральною амілоїдною ангіопатією (Rodrigues et al., 2018). Також вони можуть бути спровоковані стрибками показників АТ, використанням антикоагулянтів або захворюваннями, що погіршують коагуляцію (Steiner et al., 2014). У пацієнтів з ішемічним інсультом або ТІА антитромботичні засоби запобігають подальшим судинним подіям.
Кардіоемболічний ішемічний інсульт, що виникає переважно при фібриляції передсердь (ФП), потребує призначення антикоагулянтів (Klijn et al., 2019; Giugliano, 2013). За некардіоемболічного механізму епізоду рекомендовані інгібітори циклооксигенази тромбоцитів.
АСК є найбільш вивченим антитромботичним препаратом при некардіоемболічному ішемічному інсульті. У дозі 75‑150 мг/добу препарат зменшує імовірність повторного ішемічного інсульту та серйозних судинних подій (Baigent et al., 2009). Клопідогрель демонструє незначну перевагу над АСК (CAPRIE Steering Committee, 1996).
Особам з інсультом або ТІА, у котрих АТ становить 140/90 мм рт. ст. або вище, необхідно знизити АТ для зменшення ймовірності повторного епізоду (Wang et al., 2016). Оптимальні цільові значення АТ у цій когорті хворих чітко не визначені, як і загальноприйнята схема приймання препаратів. Однак більшість наявних доказів свідчать на користь застосування іАПФ, БРА та діуретиків.
Рекомендації
Пацієнтам із цереброваскулярними порушеннями рекомендовано модифікацію способу життя на додаток до відповідного фармакологічного лікування (І, А). В осіб з ішемічним інсультом або ТІА слід проводити профілактику антитромботичними засобами залежно від механізму розвитку хвороби (І, А).
У хворих, що перенесли некардіоемболічний ішемічний інсульт або ТІА, доцільне застосування антиагрегантів, кардіоемболічний або ТІА – антикоагулянтів (І, А). Пацієнтам із некардіоемболічним ішемічним інсультом чи ТІА рекомендовано профілактику лише АСК, дипіридамолом з АСК або тільки клопідогрелем (І, А). В осіб із малим ішемічним інсультом або ТІА слід розглянути можливість застосування ПАТТ з АСК та клопідогрелем або з АСК та тікагрелором протягом трьох тижнів після гострої події (ІІа, А).
Захворювання артерій нижніх кінцівок
Обґрунтування
Як симптоматичне, так і безсимптомне ЗАНК пов’язане з подвоєнням 10-річної частоти коронарних подій, летальних випадків від ССЗ та загальної смертності (Fowkes et al., 2008). Усі пацієнти із ЗАНК потребують модифікації способу життя і призначення фармакологічної терапії. Статини забезпечують помірне поліпшення ходьби та знижують ризик розвитку несприятливих подій із боку кінцівок (Kumbhani et al., 2014). Поєднання статину з езетимібом або інгібітором PCSK9 також має сприятливі ефекти (Bonaca et al., 2018).
У контексті контролю АТ слід зазначити, що САТ <110‑120 мм рт. ст. може збільшити серцево-судинні події у пацієнтів із ЗАНК. Інгібітори АПФ та БРА знижують їх частоту і мають переваги перед іншими препаратами (як монотерапія або частина комбінованого лікування) (Shahin et al., 2013).
Рекомендації
Всім пацієнтам із ЗАНК рекомендовано відмовитися від куріння (І, В). Здорове харчування та фізична активність є доцільними для всіх осіб із ЗАНК (І, С). Для пацієнтів із переміжною кульгавістю необхідні тренування під наглядом (І, А), якщо ж такі заняття неможливі або недоступні – без нагляду (І, С).
Пацієнтам із симптоматичним ЗАНК рекомендоване призначення антиагрегантів (І, С). У разі супутніх ЗАНК та АГ варто контролювати АТ на рівні <140/90 мм рт. ст. (І, А). У хворих на ЗАНК та ЦД потрібний суворий контроль глікемії (І, А).
Інгібітори АПФ або БРА слід розглядати як терапію першої лінії у пацієнтів із захворюванням периферичних артерій та АГ (ІІа, В). В осіб із ЦД та хронічним симптоматичним ЗАНК без високого ризику кровотечі можна розглянути комбінацію ривароксабану (2,5 мг двічі на добу) та АСК (100 мг/добу) (IIb, B).
Хронічна хвороба нирок
Обґрунтування
Тяжка ХХН асоційована із дуже високою імовірністю ССЗ і вважається еквівалентною ризику ІХС. Зі зниженням швидкості клубочкової фільтрації виникають нетрадиційні фактори ризику та зростає ризик розвитку неатеросклеротичних ССЗ (Wanner et al., 2016).
Лікування статинами або комбінацією статину/езетимібу слід призначати хворим на ХХН із достатньо високим СС-ризиком, але не пацієнтам, що отримують замісну ниркову терапію. Ця рекомендація ґрунтується на результатах дослідження SHARP, які продемонстрували зменшення кількості серйозних атеросклеротичних подій на тлі лікування (Baigent et al., 2011).
При лікуванні ІХС на тлі ХХН пацієнти мають бути поінформовані про зміну клінічної картини при ХХН, а також супутні захворювання та ризики побічних ефектів, пов’язані з терапією.
Рекомендації
Пацієнтам із ЦД, АГ та альбумінурією слід призначити лікування іАПФ або БРА (І, В). Ці препарати необхідно титрувати до максимально допустимої та переносимої дози. Комбіноване лікування іАПФ та БРА не рекомендоване (ІІІ, С).
Фібриляція передсердь
Обґрунтування
Комплексний підхід до лікування ФП спрощує надання всеосяжної допомоги пацієнтам. Відповідно до цієї стратегії (АВС), «А» передбачає антикоагуляцію/запобігання інсульту, «В» – кращий моніторинг симптомів та «С» – контроль ССЗ та супутніх захворювань (Hindricks et al., 2021). Підхід АВС дозволяє знизити ризик летальних випадків від будь-яких причин та комбінованої кінцевої точки, що включає інсульт, велику кровотечу, СС-смерть і першу госпіталізацію, частоту СС-подій, а також витрати, пов’язані зі здоров’ям (Pastori et al., 2019; Yoon et al., 2019).
Рекомендації
Виявлення факторів ризику, супутніх патологій та їх контроль слід розглядати як невід’ємну частину лікування (І, В). Для зменшення тягаря ФП та тяжкості симптомів рекомендовано оптимізацію способу життя і таргетну терапію коморбідних станів (І, В). Пацієнтам із ФП та АГ варто звернути увагу на належний контроль АТ, щоб зменшити рецидиви ФП, ризик інсульту та кровотечі (І, В).
Підготувала Олена Коробка
Оригінальний текст документа читайте на сайті www.escardio.org