24 жовтня, 2021
Передракові ураження, рак і спадкові синдроми раку шлунка
На рак шлунка припадає близько 6% онкологічних захворювань у всьому світі, він є п’ятою за частотою злоякісною пухлиною і третьою провідною причиною смерті, пов’язаної з раком. Незважаючи на те що протягом останніх 15 років спостерігається стійке зниження рівня захворюваності та смертності від раку шлунка внаслідок зменшення поширеності Helicobacter pylori та покращення дієтичних звичок, абсолютна частота захворюваності продовжує зростати через старіння населення світу.
Канцерогенез у шлунку є багатоступеневим і багатофакторним процесом, це результат складної взаємодії між генетичною сприйнятливістю та факторами навколишнього середовища. До факторів ризику, що сприяють розвитку раку шлунка, належать інфекція Helicobacter pylori, куріння, дієтичні звички [3] (значне споживання копченої їжі, що зберігається у солі, червоного й обробленого м’яса, низьке споживання свіжих фруктів та овочів), вірус Епштейна – Барр (EBV) [4], а також модифікації мікробіоти шляхом тривалого використання інгібіторів протонної помпи [5]. Виділяють низку передракових станів, таких як хронічний атрофічний гастрит і метаплазія кишечнику внаслідок інфекції Helicobacter pylori або аутоімунної реакції (перніціозна анемія), виразкова хвороба шлунка, кукса шлунка після часткової резекції органа та поліпи шлунка.
Хоча більшість випадків раку шлунка є спорадичними, сімейний анамнез спостерігається приблизно у 10% пацієнтів. Серед них спадкові випадки, пов’язані з відомими синдромами схильності до раку та/або генетичними причинами, становлять 1-3% усіх видів раку шлунка [6, 7]. Три основні спадкові синдроми, які в першу чергу уражають шлунок, – це спадковий дифузний рак шлунка (HDGC), аденокарцинома шлунка, проксимальний поліпоз шлунка (GAPPS) і сімейний рак шлунка й кишечнику (FIGC).
Передракові ураження
Атрофічний гастрит і метаплазія кишечнику
Канцерогенез шлунка – багатоступеневий процес, що включає у більшості випадків трансформацію нормальної слизової оболонки через хронічний гастрит (хронічне запалення слизової оболонки шлунка), її атрофію (втрата шлункових залоз) і метаплазію кишечнику (заміщення епітелію шлунка кишковим епітелієм) до дисплазії (інтраепітеліальна неоплазія) та карциноми. Така послідовність подій може тривати кілька років і названа каскадом Correa [8]. Відповідно до цієї моделі, тривале запалення є основним патогенним фактором, що спричиняє розвиток раку шлунка.
Серед факторів зовнішнього середовища, що призводять до опосередкованого запаленням раку шлунка, інфекція Helicobacter pylori асоціюється з майже 90% нових випадків раку шлунка (некардіальної його частини) [9], і Всесвітня організація охорони здоров’я (ВООЗ) у 1994 р. класифікувала її як канцероген 1 типу. Приблизно половина населення світу інфікована Helicobacter pylori, однак лише у невеликої частини в кінцевому підсумку розвинеться карцинома шлунка. Це свідчить про те, що в канцерогенному процесі беруть участь додаткові чинники, включаючи фактори вірулентності Helicobacter pylori, генетичну сприйнятливість, дієту, куріння та, можливо, інші види бактерій [10]. Фактори вірулентності Helicobacter pylori, які, імовірно, впливають на патогенність бактерії, а також на ризик розвитку раку шлунка, включають CagA (cag-патогенний вогнищево кодований цитотоксинасоційований ген A) і VacA (вакуолізуючий цитотоксин A) [11]. Поліморфізм генів, що беруть участь в ініціюванні та модуляції запальної реакції (такі як гени, що кодують інтерлейкін (IL)-1β, антагоніст рецептора IL-1, IL-10 і фактор некрозу пухлини), є чинником генетичної сприйнятливості хазяїна, пов’язаним з індивідуальною чи сімейною схильністю до канцерогенезу, та опосередковується інфекцією Helicobacter pylori [12]. Хоча рівень ризику не визначений, атрофічний автоімунний гастрит пов’язаний із підвищеним ризиком розвитку дисплазії та аденокарциноми [13], а також нейроендокринних новоутворень і поліпів шлункового епітелію, таких як аденоми кишкового типу й аденоми воротарної частини шлунка.
Розроблено кілька класифікацій хронічного гастриту, наприклад Сіднейська система класифікації [14], Індекс ризику шлунка [15] та Система стадіювання гастриту OLGA (Operative Link on Gastritis Assessment) [16]. Ці системи, зокрема п’ятирівнева (0-IV) система OLGA, забезпечують основу для прогнозування ризику розвитку раку шлунка, пов’язаного з атрофічним гастритом і метаплазією кишечнику, та дають змогу удосконалити клінічне спостереження [17]. Відомі дані щодо зв’язку метаплазії кишечнику з раком шлунка кишкового типу [18]. Повна метаплазія кишечнику – це келихоподібні клітини, поглинаючі ентероцити з люмінальною щітковою облямівкою та експресія муцину кишечнику (MUC2). На відміну від цього, неповна кишкова метаплазія передбачає наявність келихоподібних клітин, поглинаючих ентероцитів без люмінальної щіткової облямівки та коекспресії кишкових і шлункових муцинів (MUC5AC, MUC6) [19]. Достовірними індикаторами ризику розвитку раку шлунка є топографічне поширення кишкової метаплазії та ступінь кишкової метаплазії неповного типу [20].
Інший тип метаплазії, який, як вважають, представляє альтернативний шлях канцерогенезу шлунка, – це псевдопілорична або спазмолітична експресуюча поліпептид метаплазія (SPEM), що експресує спазмолітичний поліпептид сімейства фактора 2 (TFF2) і становить собою метапластичну заміну кислотосекретуючих залоз дна й тіла шлунка антральними залозами, які виділяють муцин. SPEM розвивається в дні та тілі шлунка й асоціюється з хронічною інфекцією Helicobacter pylori та розвитком раку шлунка [21].
Дисплазія шлунка
Дисплазія шлунка визначається як чіткі неопластичні зміни шлункового епітелію без ознак інвазії власної пластинки. Діагностичні критерії базуються на наявності клітинної атипії, аномальної диференціації, архітектурної дезорганізації та підвищеної мітотичної активності. Ендоскопічно дисплазія шлунка може проявлятися як плоскі, депресивні або поліпоподібні ураження. Вона може виникнути de novo чи в межах вже наявних доброякісних спорадичних (гіперпластичних) поліпів і поліпів дна шлунка або гамартомних поліпів, таких як ювенільні поліпи та поліпи Пейтца – Єгерса.
На підставі гістоморфологічного профілю можна виділити дисплазію кишкового або шлункового типу. Дисплазія шлунка кишкового типу має ознаки аденоми товстої кишки з трубчастими залозами, вистеленими стовпчастими клітинами, із псевдостратифікованими та пеніцилатними ядрами, що перекриваються, які можуть бути гіперхроматичними та/або плеоморфними. Можуть спостерігатися келихоподібні, абсорбційні клітини та клітини Панета. Дисплазія кишкового типу виявляє імунореактивність на MUC2, CD10 та CDX2 [22]. Фенотип шлункового (фовеолярного) типу дисплазії характеризується кубоїдними та низькоколончастими клітинами, що нагадують шлункові (фовеолярні) клітини, з круглими й овальними ядрами та прозорою або еозинофільною цитоплазмою. Шлункова диференціація може бути підтверджена експресією MUC5AC та MUC6. Використовуючи імуногістохімічне дослідження, можна виявити також гібридні або змішані випадки з вираженням як кишкового, так і шлункового маркерів, а також нульові випадки, негативні для вищезазначених маркерів. Дисплазія фовеолярного типу частіше є високодиференційованою й асоціюється з аденокарциномою шлунка [22].
Виділяють дисплазію низького або високого ступенів на основі змін архітектоніки, особливостей ядерних і цитоплазматичних клітин та мітотичної активності. При дисплазії низького ступеня залозиста архітектура відносно збережена, клітинний плеоморфізм м’який або відсутній, ядра підтримують базальну полярність, а мітотична активність помітно не підвищена. Особливості дисплазії високого ступеня включають складну залозисту архітектуру, виражену цитологічну атипію з великими ядрами та помітними ядерцями, втрату полярності клітин і часті мітотичні фігури. Визначити відмінність між дисплазією високого ступеня та внутрішньослизовою інтестинальною аденокарциномою може бути складно, особливо у невеликих зразках біопсії, існує лише обмежений консенсус щодо діагностичних критеріїв, особливо між азіатськими та західноєвропейськими патоморфологами. Корисні ознаки для діагностики внутрішньослизової аденокарциноми включають виражену скупченість залоз, крибриформну форму і повзучий малюнок, брунькування, інфільтрацію ізольованих клітин і внутрішньозалозові некротичні часточки. Наявність десмоплазії не є необхідною для визначення стромальної інвазії. Розрізнити реактивні/регенеративні зміни та справжню дисплазію може бути складно, особливо у невеликих біоптатах і зразках із технічними артефактами. У цих випадках можна застосовувати термін «невизначений стосовно дисплазії». Дисплазія шлунка, обмежена заглибленнями, без поверхневого ураження епітелію, визначається як дисплазія крипт.
Аденоми шлунка
Класифікація, запропонована W.M. Hackeng та співавт., виділяє шлункові поліпи відповідно до частини слизової оболонки шлунка, з якої вони виникають. Аденоми шлунка, що формуються у фовеолярній частині, включають аденоми фовеолярного типу (виникають із фовеолярного епітелію без кишкової метаплазії) й аденоми кишкового типу (утворюються із фовеолярного епітелію з кишковою метаплазією). Аденоми шлунка, що виникають із залозистої частини, включають аденому воротарних залоз (pyloric gland adenoma, PGA) та аденому залоз тіла шлунка (оxyntic gland, OGA). Відповідно до їхнього залозистого гістогенезу, OGA та PGA демонструють дифузну імунореактивність щодо MUC6.
PGA складаються з щільно упакованих канальців або розширених залоз епітелію пілоричного типу, вистелених кубоподібними/низькостовпчастими клітинами з блідою, прозорою або злегка еозинофільною цитоплазмою. PGA можуть виникати при сімейному аденоматозному поліпозі та синдромі Лінча.
ОGА складаються із диспластичних залоз, що демонструють змінну диференціацію до головних і тім’яних клітин. Між ОGА й аденокарциномами шлунка типу фундальної залози наявний морфологічний зв’язок. Чи є вони окремими хворобами (перші становлять собою попередники других), чи становлять морфологічний спектр того самого ураження, досі обговорюється.
Доброякісні поліпи шлунка з можливою дисплазією і раком шлунка
Гіперпластичні поліпи – доброякісні ураження епітелію шлунка, що складаються з гіперпластичного та цистично розширеного фовеолярного епітелію на тлі помітних запальних змін. Оскільки гіперпластичні поліпи становлять собою гіперпроліферативну реакцію на пошкодження тканин, більшість із них виникають на тлі тривалого запалення слизової оболонки шлунка і є частим типом поліпів у країнах із високою поширеністю інфекції Helicobacter pylori. Дисплазія фовеолярного чи кишкового типу й аденокарцинома (кишкового або дифузного типу) можуть виникнути приблизно у 2% більших гіперпластичних поліпів (рис.). Зміни кількості копій і мутації TP53 обмежені компонентом аденокарциноми.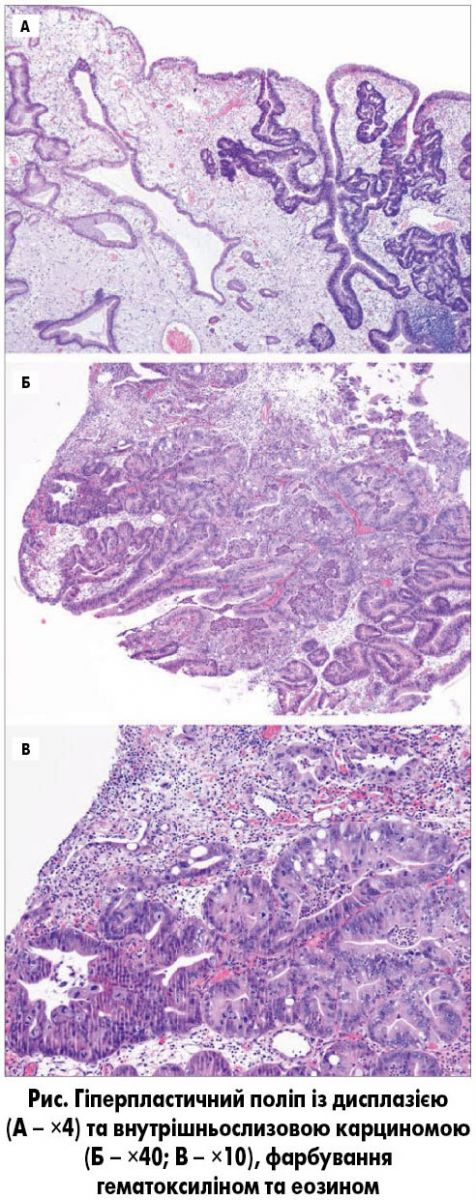
Поліпи фундальних залоз – це доброякісні ураження епітелію шлунка, що складаються з невпорядкованих розширених і цистично розширених залоз тіла шлунка, вистелених парієтальними та пептичними клітинами, а також слизовим епітелієм шийки шлункової ямки. Поліпи фундальних залоз є переважним типом поліпів у західних країнах, вони асоційовані з використанням інгібіторів протонної помпи і зворотно пов’язані з гастритом, викликаним Helicobacter pylori. У поліпах фундальних залоз може розвинутися дисплазія фовеолярного типу, яка зазвичай є низькодиференційованою. У спорадичних поліпах фундальних залоз дисплазія спостерігається рідко, і виявлення дисплазії має викликати підозру щодо спадкового синдрому, особливо у разі молодого віку пацієнтів, множинних поліпів фундальних залоз і (у разі сімейного спадкового поліпозу) поліпів в інших частинах шлунково-кишкового тракту. У контексті спадкових синдромів дисплазія у поліпах фундальних залоз може спостерігатися при аденокарциномі шлунка та проксимальному поліпозі шлунка (див. нижче) та сімейному спадковому поліпозі. Геномний ландшафт синдромних і спорадичних поліпів фундальних залоз відрізняється. Асоційовані з сімейним спадковим поліпозом поліпи фундальних залоз можуть спричиняти інактивацію гена APC, але не мати мутацій CTNNB1 (бета-катеніну), тоді як спорадичні поліпи фундальних залоз містять мутації CTNNB1 і зазвичай не мають змін APC.
Рак шлунка
Визначення
Аденокарцинома шлунка – злоякісне епітеліальне новоутворення із залозистою диференціацією, що виникає із слизової оболонки шлунка і є біологічно неоднорідною групою пухлин щодо етіології, гістогенезу, морфології та молекулярних особливостей. У цілому аденокарцинома шлунка становить 90-95% злоякісних пухлин органа.
Залежно від глибини проникнення в стінку шлунка рак шлунка класифікують як ранній або прогресуючий. Ранній рак шлунка визначається як карцинома, обмежена слизовою оболонкою (pT1a) або слизовою і підслизовою (pT1b), незалежно від розміру пухлини чи наявності метастазів у лімфатичних вузлах. Шлункові аденокарциноми, що проникають у власний м’яз і далі (>pT2), визначаються як поширені.
Клінічні особливості
Клінічна картина раку шлунка в основному пов’язана з топографією та стадією захворювання. Більшість ранніх пухлин шлунка мають безсимптомний перебіг на момент діагностування. Програми скринінгу груп ризику (Японія, Корея) сприяли ранній діагностиці у пацієнтів без симптомів та кращій загальній виживаності. На поширеній стадії захворювання загальними ознаками та симптомами є диспепсія, біль в епігастрії, абдомінальна маса та тривожні симптоми («червоні прапорці»), такі як дисфагія, значна втрата маси тіла, ознаки та симптоми шлунково-кишкової кровотечі та блювання.
Ендоскопічне дослідження з біопсією – золотий стандарт діагностики раку шлунка. Ендоскопія з поліпшеним зображенням і збільшенням може покращити рівень виявлення ранніх уражень шлунка. Точне діагностування (TNM) є наріжним каменем для визначення прогнозу та терапевтичних підходів при раку шлунка. Порівняно з поширеним раком шлунка, прогноз при ранньому раку шлунка набагато кращий, 5-річна виживаність після хірургічної резекції становить понад 90%. За відсутності лікування у 63% випадків ранній рак шлунка прогресує до поширених пухлин протягом 5 років. Прогноз при поширеному і нерезектабельному раку шлунка поганий з очікуваною виживаністю у кілька місяців. Ендоскопічна ультрасонографія є кращим методом визначення глибини інвазії в стінку шлунка (стадія рТ).
Ендоскопічна резекція рекомендована при ранньому раку шлунка з низькою ймовірністю метастазування в лімфатичні вузли. До факторів ризику розвитку метастазів у лімфатичних вузлах, щодо яких слід розглянути операцію з видаленням останніх, належать підслизова інвазія, діаметр пухлини >20-30 мм, судинна венозна або лімфатична інвазія, депресивні чи виразкові макроскопічні підтипи та недиференційована гістологічна форма пухлини. Лікування поширеного раку шлунка передбачає хірургічне втручання та хіміопроменеву терапію. Для пацієнтів із неоперабельним раком шлунка єдиним підходом є системна терапія, що включає стандартну хіміотерапію та мішеневу терапію моноклональними антитілами проти HER2, VEGFR2 та інгібіторами імунних контрольних точок. Відповідно до останніх європейських рекомендацій, єдиним встановленим прогностичним біомаркером при лікуванні раку шлунка є статус HER2, оцінений за допомогою імуногістохімічного дослідження HER2 та гібридизації ERBB2 in situ, з метою відбору пацієнтів із нерезектабельним або метастатичним раком шлунка для анти-HER2 терапії. Неоднорідність оцінки HER2 при раку шлунка широко документована, і це має практичне значення, коли HER2 оцінюють шляхом ендоскопічної біопсії (мінімальний набір з 5 біопсій виявився необхідним для надійної оцінки HER2). Нові прогностичні біомаркери для відбору пацієнтів з раком шлунка, яким може бути корисною імунотерапія на основі інгібіторів імунних контрольних точок, включають високий статус мікросателітарної нестабільності (MSI), інфекцію EBV, експресію PD-L1 (комбінований позитивний бал ≥1%), навантаження та щільність пухлинних мутацій внутрішньопухлинних CD8+ Т-клітин. До несприятливих прогностичних факторів у резекційних випадках належать більш високі стадії pT та pN, обмежена дисекція лімфатичних вузлів, лімфатична та судинна інвазія й позитивні хірургічні краї резекції.
Мікроскопічні характеристики та гістопатологічні класифікації
Рак шлунка має широку різноманітність морфологічних фенотипів, що відображається великою кількістю гістопатологічних класифікацій. Найчастіше використовуваними гістопатологічними класифікаціями є класифікації, запропоновані Lauren та ВООЗ. Класифікація Lauren виділяє два основних типи – кишковий і дифузний. Перший представлений залозами або сосочками, а другому типу притаманні інфільтративна картина росту та пухлинні клітини без клітинної згуртованості. Пухлини, що містять як кишкові, так і дифузні компоненти, називаються змішаними карциномами. Солідні пухлини – слабо диференційовані або недиференційовані карциноми, які не підходять до жодного з цих підтипів, належать до невизначеної категорії. Рак шлунка кишкового типу здатний легше виживати у венозних судинах і схильний метастазувати гематогенним шляхом, тоді як дифузний рак шлунка, як правило, поширюється через перитонеальні поверхні. Змішаний рак шлунка характеризується гіршим прогнозом порівняно з кишковим або дифузним типами і демонструє подвійну метастатичну картину (гематогенні метастази та перитонеальна дисемінація з метастазами в лімфатичних вузлах), ймовірно, через сукупний несприятливий ефект двох компонентів у межах однієї пухлини.
За класифікацією ВООЗ виділяють п’ять основних гістопатологічних підтипів раку шлунка: тубулярну аденокарциному, що складається з трубчастих, залозистих або ацинарних структур різного діаметра та ступеня диференціації (деякі солідні карциноми можна класифікувати як високодиференційовані тубулярні аденокарциноми); папілярний рак, який демонструє пальцеподібну сосочкову архітектуру, зрештою змішаний із залозистими структурами (тубуло-папілярний фенотип); дискогезивна карцинома (poorly cohesive carcinoma), що складається з пухлинних клітин, ізольованих або у невеликих скупченнях без клітинної згуртованості; муцинозна аденокарцинома, яка визначається наявністю пулів муцину, що становить >50% пухлини; змішані карциноми, які мають виражений тубуло-папілярний погано згуртований компонент. У змішаних карциномах два компоненти можуть бути поєднані, суміжні або повністю розділені.
Система оцінювання (аденокарцинома шлунка низького або високого ступеня диференціації) застосовується насамперед до тубулярних, папілярних і тубуло-папілярних підтипів. Тубулярні та папілярні карциноми приблизно відповідають раку шлунка кишкового типу, тоді як дискогезивні карциноми – дифузному підтипу Lauren.
Класифікація пухлин травної системи ВООЗ (2019) підкреслює важливість розрізнення різних підтипів у категорії дискогезивних карцином на основі наявності та кількості кільцеподібних клітин. За визначенням, перснеподібні клітини мають багато муцину у вакуолі, що заповнює цитоплазму та виштовхує ядро на периферію клітини. Дискогезивні карциноми типу перснеподібноклітинних складаються переважно або виключно (наприклад, >90%) із перснеподібних клітин, тоді як неперснеподібноклітинні дискогезивні карциноми утворені з дискогезивних та інфільтруючих клітин без класичної морфології. Важливо розпізнати цей останній підтип дискогезивного раку шлунка, оскільки прогноз при ньому гірший, ніж при суто перснеподібній карциномі.
Ранній рак шлунка
Ранній рак шлунка – карцинома, що обмежується слизовою оболонкою шлунка та/або підслизовою, незалежно від стану лімфатичних вузлів, із хорошим прогнозом. На жаль, при деяких видах раннього раку шлунка виникають метастази у лімфатичних вузлах, а останні дослідження зосереджені на ключових параметрах, які можуть бути пов’язані з погіршенням прогнозу. Зокрема, розміри, глибина інфільтрації та гістологічний тип пухлин, а також розподіл метастазів у лімфатичних вузлах є маркерами погіршення виживаності у підгрупі пацієнтів із цими пухлинами.
Корисна класифікація була впроваджена Kodama у 1983 р., вона визначає закономірності росту раннього раку шлунка та співвідносить їх із прогнозом (табл.). Новітні дослідження підтвердили важливість цієї класифікації, яка повинна бути частиною патоморфологічного звіту як у хірургічних матеріалах, так і, що важливіше, в матеріалах ендоскопічної біопсії.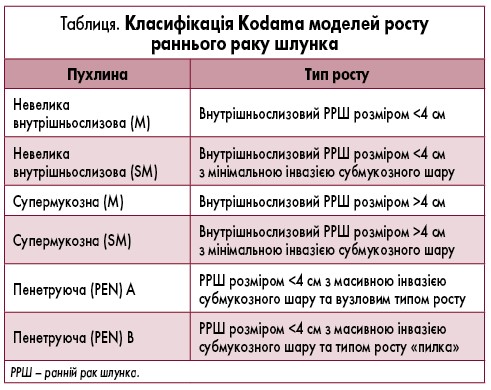
Імуногістохімічні біомаркери та молекулярні підтипи
Рак шлунка є результатом накопиченого геномного пошкодження, яке впливає на необхідні для розвитку раку клітинні функції. При раку шлунка виявлено численні мутації генів, зміни кількості соматичних копій, епігенетичні та транскрипційні зміни, що підкреслює його молекулярну гетерогенність. Молекулярні класифікації на основі інтегративного аналізу кількох геномних і протеомних даних включають класифікацію Singapore-Duke group на основі профілювання експресії генів, а також молекулярні класифікації, запропоновані The Cancer Genome Atlas та Asian Cancer Research Group.
Знакове дослідження раку шлунка з його стратифікацією на основі молекулярного профілю було проведено дослідницькою мережею The Cancer Genome Atlas (TCGA). Вона визначає чотири молекулярні підтипи: рак шлунка, асоційований з EBV, який характеризується повторними мутаціями PIK3CA, високим рівнем гіперметилювання ДНК, частим JAK2 і CD274 (PD-L1), ампліфікацією та збагаченням генами, що беруть участь у імунній сигналізації; рак шлунка з високим рівнем MSI, який характеризується пригніченням MLH1 і, як наслідок, високим рівнем гіперметилювання ДНК; геномно стабільний рак шлунка, асоційований із дифузною морфологією та періодичними CDH1 та RHOA; рак шлунка з хромосомною нестабільністю, що демонструє велику кількість мутацій TP53 та ампліфікацію рецепторів тирозинкінази. Прогностична цінність молекулярної класифікації TCGA полягає в тому, що при раку шлунка, асоційованому з EBV та високим рівнем MSI, прогноз є найкращим, можливе досягнення відповіді на мішеневу імунотерапію; при хромосомно нестабільних пухлинах прогноз помірно поганий, але вони чутливі до хіміотерапії, тоді як при геномно стабільних пухлинах прогноз найгірший, вони стійкі до хіміотерапії.
Загалом морфологія злоякісного новоутворення може дати уявлення про біологію пухлини, її слід використовувати як основу для ідентифікації клінічно значущих підгруп, як основу побудови алгоритмів для спрямованої та економічно ефективної молекулярної характеристики. Крім того, практичні алгоритми, засновані на імуногістохімічному дослідженні та гібридизації in situ, можуть застосовуватися в рутинній діагностичній практиці для переведення специфічних імунофенотипів у молекулярні підгрупи з предиктивною та прогностичною значущістю. Таким чином, позитивна гібридизація in situ для EBV-кодованої малої РНК (EBER) дає змогу відрізнити EBV-асоційований рак шлунка, втрата експресії білків відновлення невідповідності ДНК (MLH1, MSH2, MSH6, PMS2) – ідентифікувати більшість видів раку шлунка з високим статусом MSI. Геномно стабільний рак шлунка ідентифікується за дискогезивною морфологією й аномальною імунореактивністю Е-кадгерину (зниження мембранного, пунктирного, цитоплазматичного або його відсутність); аберантна експресія р53 (надмірна експресія або загальна втрата) уможливлює відрізнити тип хромосомно нестабільного раку шлунка від активації ТР53.
За матеріалами I. Gullo et al. Precancerous lesions of the stomach, gastric cancer and hereditary gastric cancer syndromes. Pathologica. 2020; 112: 166-185. doi: 10.32074/1591-951X-166.
Продовження статті у наступному номері.
Підготував Назар Лукавецький
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 3 (61) 2021 р.



