30 вересня, 2023
Вірусні пневмонії: питання діагностики та лікування
 Актуальність проблеми обумовлена зростанням показників захворюваності на вірусні пневмонії протягом останнього десятиліття; це свідчить не лише про підвищення якості діагностики, а й збільшення кількості пацієнтів з ослабленим імунітетом, еволюцію та адаптацію збудників, що зумовило глобальне зростання вірусних інфекцій у патології людини.
Актуальність проблеми обумовлена зростанням показників захворюваності на вірусні пневмонії протягом останнього десятиліття; це свідчить не лише про підвищення якості діагностики, а й збільшення кількості пацієнтів з ослабленим імунітетом, еволюцію та адаптацію збудників, що зумовило глобальне зростання вірусних інфекцій у патології людини.
Загалом (залежно від вірулентності мікроорганізму, віку та супутніх захворювань пацієнта) тяжкість перебігу вірусних пневмоній варіює від легкого самообмежувального захворювання до стану, що загрожує життю. Так, із початку 2000-х років спостерігалися 3 надзвичайні події щодо інфекційних хвороб, які мають міжнародне значення, – спалах SARS (Severe Acute Respiratory Syndrome), що тривав протягом 2002-2003 рр., та 2 пандемії – грипу А/H1N1/09/Каліфорнія і COVID‑19. Крім того, із 2012 р. реєструються випадки захворювання на MERS (Middle East Respiratory Syndrome). Усі ці хвороби об’єднують висока летальність (до 35%), вірусне походження та неспецифічність первинних проявів, що ускладнює своєчасну діагностику і лікування, тяжкі ускладнення – насамперед гострий респіраторний дистрес-синдром (ГРДС), який може спричинитися вже в перші дні хвороби, особливо за грипу. Із 2005 р. SARS регулюється Міжнародними медико-санітарними правилами. Глобальна передача SARS була припинена в червні 2003 р. після того, як Всесвітня організація охорони здоров’я запровадила традиційні заходи громадської охорони здоров’я, включаючи пошук та ізоляцію хворих, карантин і використання посиленого інфекційного контролю. Із 2004 р. не було зареєстровано випадків цього захворювання.
Частота вірусних пневмоній знижується в здорових людей молодого та середнього віку, але потім значно зростає серед осіб літнього віку. Дослідження позалікарняних пневмоній незмінно демонструють домінування в їхній етіології різних вірусів, які посідають друге місце (після Streptococcus pneumoniae), коливаючись від 13 до 50% серед діагностованих випадків [2-7].
Етіологія
- В етіології вірусної пневмонії беруть участь як ДНК, так і РНК-віруси:
- аденовіруси (Adenoviridae);
- коронавіруси (Coronaviridae) – SARS-CoV, MERS‑CoV, SARS-CoV‑2;
- хантавіруси (Hantaviridae);
- віруси грипу (Orthomyxoviridae);
- паповавіруси (Papovaviridae) – віруси JC і BK;
- параміксовіруси (Paramyxoviridae) – вірус парагрипу (PIV), респіраторно-синцитіальний вірус (RSV), метапневмовірус людини (hMPV), вірус кору;
- пікорнавіруси (Picornaviridae) – ентеровіруси, вірус Коксакі, еховірус, ентеровірус 71, риновірус;
- реовіруси (Reoviridae) – ротавірус;
- ретровіруси (Retroviridae) – вірус імунодефіциту людини (ВІЛ), лімфотропний вірус людини 1 типу (HTLV‑1).
Більшість представників сімейства герпесвірусів (Herpesviridae) також можуть спричиняти ураження легень у людей з ослабленим клітинним імунітетом:
- вірус герпесу людини‑1 (HHV‑1) і вірус герпесу людини‑2 (HHV‑2);
- вірус вітряної віспи (VZV);
- вірус Епштейна – Барр (EBV);
- цитомегаловірус (CMV);
- герпесвірус 6, 7 та 8 типів.
Найпоширенішими етіологічними чинниками вірусних пневмоній у дітей та дорослих є вірус грипу, респіраторно-синцитіальний вірус, аденовіруси, вірус парагрипу. Віруси грипу типів А і В спричиняють більше половини всіх випадків позалікарняної вірусної пневмонії, особливо під час спалахів захворювання. Найближчими роками прогнозують збільшення випадків пневмоній, спричинених іншими вірусами (риновірусами, коронавірусами, метапневмовірусами тощо), за рахунок удосконалення діагностичних тестів і підвищення їхньої доступності.
Віруси грипу – найпоширеніша причина пневмоній вірусної етіології. Серед них особливо небезпечними є усі штами пташиного грипу A (H5N1, H7N9, H9N2, H3N8) і вірус групу H1N1. Особливості перебігу таких пневмоній – швидкий початок і розвиток ГРДС на 1-му тижні захворювання, чим і зумовлена досить висока летальність (у пташиного грипу – до 70%). Це пов’язано з подвійною специфічністю вірусу грипу А H1N1 як до сіалових кислот ротоглотки, так і до сіалових кислот нижніх дихальних шляхів. Незвичайність перебігу такої первинної грипозної пневмонії (ознаки вираженої інтоксикації та дихальної недостатності в поєднанні з вельми помірно вираженим катаральним синдромом і мізерністю фізикальних даних) дезорієнтують лікаря й можуть бути причиною діагностичних помилок уже на догоспітальному етапі. Такі помилки і зумовили надзвичайно високу летальність від вірусу грипу А H1N1 у сезоні 2009-2010 рр. (із підтверджених випадків – до 10%). Одними з найважливіших особливостей первинних грипозних уражень легень є виражена невідповідність між клінічними, рентгенологічними даними та насичення крові киснем (сатурація): при незначних фізикальних даних у вигляді послаблення дихання і непостійних хрипів на рентгенограмах визначаються ознаки тотальної або субтотальної пневмонії. У лікуванні таких пневмоній найважливішу роль відіграє раннє установлення діагнозу зі своєчасним призначенням інгібіторів вірусної нейрамінідази.
До вірусу парагрипу найсприйнятливішими є діти; він посідає друге місце (після RSV) як причина захворювань нижніх дихальних шляхів у дітей, а також пневмонії та бронхіолітів у немовлят віком <6 міс. Передача відбувається через прямий контакт від людини до людини або крапельним шляхом. За антигенними характеристиками вірус парагрипу розподіляється на чотири типи, при цьому 3 тип є ендемічним цілий рік, а типи 1 і 2 сягають піку в осінній сезон. Пневмонія та бронхіоліт здебільшого спричинені 3 типом вірусу. Імунітет є короткочасним, рецидивні інфекції верхніх або нижніх дихальних шляхів виникають протягом усього життя. Парагрипозна інфекція в хворих з ослабленим імунітетом може спричинити фатальну пневмонію; в одному дослідженні було показано, що 44% пацієнтів із трансплантацією гемопоетичних стовбурових клітин мали прогресувальну пневмонію, спричинену вірусом парагрипу, з яких 37% померли.
Респіраторно-синцитіальний вірус – найчастіша причина інфекції нижніх дихальних шляхів у дітей молодшого віку та друга за поширеністю причина вірусної пневмонії у дорослих. У 2022 р. збільшення випадків RSV-інфекції (порівняно з періодом до пандемії) спостерігалося в США, країнах Панамериканської організації охорони здоров’я, Канаді, Данії, Франції, Німеччині тощо. Пов’язують це з пом’якшенням обмежувальних заходів, запроваджених у період останньої пандемії, що зумовило ослаблення імунітету проти респіраторних вірусів. Більшість випадків реєструвалася в дітей віком <4 років. У США на 45-му тижні госпіталізація до відділення інтенсивної терапії щодо бронхіоліту дітей віком <2 років становила половину всіх випадків госпіталізації. Крім того, в цей період також спостерігалися випадки одночасного зараження вірусом грипу, SARS-CoV‑2 та RSV, що отримало назву «тридемія». Особливостями перебігу RSV-інфекції у немовлят є те, що єдиними симптомами хвороби у них можуть бути дратівливість, зниження апетиту, апное, при цьому гарячка може бути відсутня.
Аденовіруси спричиняють широкий спектр клінічних симптомів залежно від серотипу збудника – від безсимптомних захворювань, кон’юнктивіту до пневмонії, шлунково-кишкових та неврологічних симптомів, геморагічного циститу, різних висипів. Хоча існують 52 серотипи, класифіковані на 7 підгруп або видів (A-G), легеневі захворювання переважно спричиняються серотипами 1-5, 7, 14 і 21. Віруси типу 7 можуть зумовлювати бронхіоліт і пневмонію в немовлят. Віруси 4 і 7 типів зазвичай спричиняють спалахи респіраторних захворювань у призовників; пневмонія рідше зустрічається в дорослих за межами військових таборів. Аденовірус типу 14 (Ad 14) спричиняє тяжку інфекцію в пацієнтів будь-якого віку, особливо в хворих із супутніми захворюваннями й ослабленим імунітетом. У 2005 р. повідомлялося про появу цього штаму серед цивільного та військового населення, а згодом спалахи сталися у військових навчальних центрах на всій території США. У 2007 р. Ad 14 зумовив великий та тривалий спалах фебрильної респіраторної інфекції серед військових стажерів у Техасі, а також (зовсім нещодавно) – в інтернатному закладі в штаті Вашингтон. Під час спалаху в Орегоні середній вік хворих становив 52 роки, 76% з них потребували госпіталізації, 47% – реанімації, а 18% померли. Більшість із цих пацієнтів були імунокомпетентними дорослими. Аденовіруси надзвичайно контагіозні. Дослідження новобранців показали рівень сероконверсії 34-97% протягом 6-тижневого періоду. Більшість дітей віком <10 років мають серологічні докази попередньої аденовірусної інфекції.
Деякі автори повідомляють, що на риновірус припадає до 30% випадків усіх вірусних пневмоній. Дослідження 211 французьких дітей з риновірусною інфекцією виявило бронхіоліт або бронхіт у 25,6% і пневмонію – в 6,2% хворих. Випробування, проведене в Нідерландах, довело, що риновіруси спричиняють 32% усіх інфекцій нижніх дихальних шляхів з ідентифікованим збудником у літніх людей (>60 років). Риновіруси в них виявлялися частіше, ніж коронавіруси (17%) або віруси грипу (7%).
Метапневмовірус людини (hMPV) є відносно нещодавно відкритим респіраторним патогеном, уперше описаним у Нідерландах у 2001 р. [21]; hMPV належить до сімейства Paramyxoviridae (як RSV і PIV). Цей вірус – убіквітарний мікроорганізм; більшість дітей віком <5 років контактують з ним. Повторне зараження відбувається протягом усього життя, в т. ч. і в дорослих. Він також може спричиняти інфекції нижніх дихальних шляхів. Тяжкість інфекції зростає зі старшим віком і супутніми захворюваннями чи імуносупресивними станами. Найпоширенішими діагнозами, пов’язаними з госпіталізацією дорослих із hMPV-інфекцією, є загострення хронічної обструктивної хвороби легень (ХОЗЛ), бронхіту та пневмонії. У хворих з ослабленим імунітетом (наприклад, гематологічні злоякісні новоутворення) повідомлялося про тяжкі пневмонії із фатальними для хворого наслідками.
Давно відомо, що коронавіруси спричиняють інфекції верхніх дихальних шляхів, але до виникнення SARS не було описано їхніх тяжких форм. Наразі ідентифіковано 7 коронавірусів людини (HCoV): HCoV‑229E, HCoV-OC43, HCoV-NL63, HCoV-HKU1, SARS-CoV (збудник SARS), MERS-CoV (збудник МЕRS) і SARS-CoV‑2 (збудник COVID‑19).
Вірус вітряної віспи (VZV) може спричиняти небезпечні пневмонії у здорових дорослих людей (включаючи вагітних) і хворих з ослабленим імунітетом. У здорових дітей ця пневмонія зустрічається рідко (переважно в дітей з ослабленим імунітетом). Ускладнення включають вторинні бактеріальні інфекції, енцефаліт, гепатит, а за одночасного застосування аспірину – синдром Рея. VZV-пневмонія має тенденцію до тяжчого перебігу в курців.
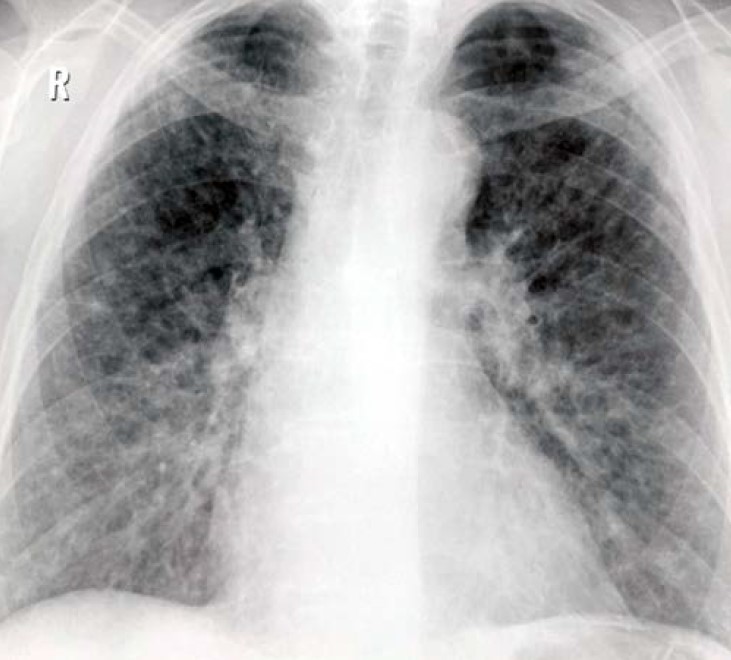
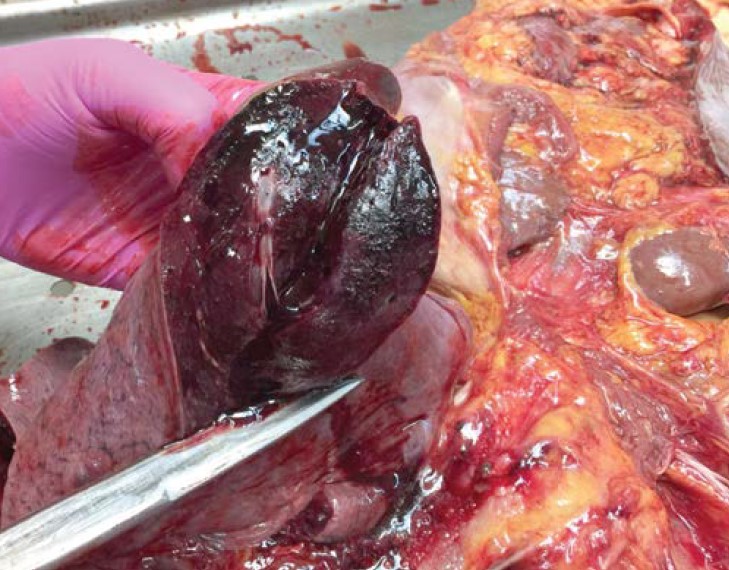
Вірус кору також може зумовити тяжку інфекцію нижніх дихальних шляхів. Одна з особливостей останньої безпрецедентної епідемії кору в Україні 2015-2019 рр. – розвиток у дорослих тяжких пневмоній, що погано лікуються, а в низці випадків за клінічними особливостями нагадують первинні грипозні ураження легень із ГРДС. Розвиток таких пневмоній відбувався в будь-який період захворювання, в т. ч. на початку реконвалесценції, а також мав непередбачуваний перебіг (рис. 1, 2).
Рис. 1. Рентгенограма хворої А., 59 років. Кір, 15-й день хвороби, субтотальна двобічна пневмонія, ГРДС
Рис. 2. Макропрепарат легень хворої А., 59 років, котра померла від корової пневмонії на 17-й день від початку хвороби.
Легені повнокровні, виражений набряк, діапедезні крововиливи
Цитомегаловірус (ЦМВ) в імунокомпетентних людей спричиняє мононуклеозоподібний синдром. Поширеність антитіл до ЦМВ у дорослих коливається від 40 до 100%. Реактивація латентної інфекції спостерігається в реципієнтів різних органів після трансплантації та в осіб, інфікованих ВІЛ. Тяжкість пневмонії пов’язана з інтенсивністю імуносупресії. У хворих після алогенної трансплантації кісткового мозку поширеність ЦМВ-пневмонії становить 15%, летальність – 85%, що робить її найпоширенішою причиною смерті в цій популяції. Хоча ЦМВ спричиняє у пацієнтів зі СНІДом ураження органа зору, коліт, енцефаліт, полірадикуліт тощо, клінічно значуща пневмонія є дуже рідкісною формою хвороби для цієї групи, навіть якщо ЦМВ культивують з альвеолярної рідини та/або визначають гістологічно.
Вірус простого герпесу – рідкісна причина інфекцій нижніх дихальних шляхів; здебільшого спостерігається в пацієнтів із серйозним імунодефіцитом із рівнем летальності 80%. Пневмонія може розвинутися як унаслідок первинної інфекції, так і її реактивації.
Хантавірусний легеневий синдром (HPS) спостерігається в Америці та спричиняється північноамериканськими варіантами хантавірусів, особливо вірусом Sin Nombre. Смертність при HPS становить 35%. В Україні захворювання не зустрічається.
До рідкісних причин вірусної пневмонії належать вірус Епштейна – Барр і ротавірус. Пневмонія як ускладнення мононуклеозу зустрічається дуже рідко, але варто пам’ятати, що вірус може її спричинити і за відсутності клінічних ознак мононуклеозу. Ці ураження пов’язані з лімфоцитарною інтерстиціальною пневмонією або легеневою лімфоїдною гіперплазією. Ротавірусна пневмонія зустрічається рідко – було зареєстровано лише декілька випадків.
Вірусні пневмонії часто ускладнюються приєднанням бактеріальної флори, що робить діагностику за суто клінічними ознаками тяжкою або неможливою. Точна та рання етіологічна діагностика є дуже важливою, але навіть за допомогою доступних наразі тестів іноді мікроорганізм-збудник не вдається ідентифікувати у 50-80% симптомних пацієнтів. Нині розроблено низку експрес-тестів для визначення етіології захворювання; їхнє використання в низці випадків пришвидшує своєчасну діагностику, що дозволяє своєчасно призначити етіотропну терапію.
Патофізіологія
Повного розуміння патофізіології та патогенезу вірусних захворювань на сьогодні немає. Після зараження більшість респіраторних вірусів мають тенденцію розмножуватися в епітелії верхніх дихальних шляхів і вторинно інфікувати легені різними шляхами. Тяжкі пневмонії можуть зумовити загальну консолідацію легень з різним ступенем крововиливів; у деяких пацієнтів з’являються кров’янисті плевральні випоти та дифузне альвеолярне ушкодження.
Механізм ураження легень залежить від задіяного вірусу. Деякі віруси є переважно цитопатичними, безпосередньо уражають пневмоцити чи бронхіальні клітини (грип); в інших випадках надмірне запалення в результаті імунної відповіді – основа патогенного процесу (COVID‑19).
Імунну відповідь можна класифікувати відповідно до моделей продукування цитокінів. Цитокіни 1 типу сприяють клітинному імунітету, тоді як цитокіни 2 типу опосередковують алергічні реакції. Діти, інфіковані RSV, у яких розвивається гострий бронхіоліт, а не легкі симптоми інфекції верхніх дихальних шляхів, мають ослаблений імунітет 1 типу чи підвищений імунітет 2 типу. На додаток до гуморальних реакцій клітинний імунітет є важливим для одужання від деяких респіраторних вірусних інфекцій.
Респіраторні віруси ушкоджують дихальні шляхи, стимулюють вивільнення гуморальних факторів, включаючи гістамін, лейкотрієн С4, вірус-специфічний IgE за RSV-інфекції та брадикінін, інтерлейкін-1, -6, -8 у разі риновірусної інфекції. RSV може також змінювати бактеріальну колонізацію, посилювати прилипання бактерій до респіраторного епітелію, знижувати мукоциліарний кліренс, змінювати фагоцитоз бактерій.
В основі ГРДС лежить первинне ураження мікроциркуляції у легенях, а не ураження дихальних шляхів (криза мікроциркуляції). Гостре ушкодження легень (паренхіматозного типу) та ГРДС є неспецифічними захворюваннями легень.
ГРДС, асоційований з COVID‑19, розглядають як нетиповий за перебігом, відзначаючи його головну характеристику – дисоціацію між тяжкістю гіпоксемії та відносно хорошою механікою дихання [62, 63]. Із клінічного погляду виокремлено 2 фенотипи [64, 65]. Пацієнти із фенотипом L мають високу піддатливість легень, їхню меншу масу за даними комп’ютерної томографії та погану відповідь на режим позитивного тиску кінця видиху (ПТКВ). Пацієнти із фенотипом Н – це хворі, перебіг захворювання яких погіршується або котрі отримували лікування, що не відповідало тяжкості перебігу, з ділянками скупчення запального ексудату в альвеолах за даними комп’ютерної томографії, низькою піддатливістю легень, їхньою більшою масою і хорошою відповіддю на режим ПТКВ. Така клінічна картина поєднується з ураженням ендотелію, порушенням легеневої вазорегуляції, стимуляцією порушення вентиляційно-перфузійного співвідношення, що і лежить в основі виникнення гіпоксемії, а також підтримує імунотромбоз. Фактори, що зумовлюють атиповий перебіг ГРДС, отримали в літературі назву мікросудинного обструктивного тромбозапального синдрому легеневих судин при COVID‑19 (MicroCLOTS). Відповідно до запропонованого визначення, ГРДС є результатом гіперімунної реакції хазяїна на SARS-CoV‑2, в основі якого лежить безпосередній вплив вірусу на клітини, вивільнення прозапальних цитокінів та опосередкований вплив через активацію системи комплементу, що спричиняє активну міграцію лейкоцитів до осередку запалення, подальше збільшення вивільнення прозапальних цитокінів. Отже, виникає тяжке ушкодження легеневої тканини з розвитком ендотеліальної дисфункції, що може пояснити прогресувальне погіршення вентиляційно-перфузійного співвідношення та утворення мікротромбозів у легенях [66]. Останнім часом усе більше починають обговорювати роль запальних молекул, які потрапляють до своєрідної пастки таких мікротромбів, резистентних до фібрінолізу та є можливим чинником розвитку постковідного синдрому.
Ускладнення
Більшість вірусних пневмоній в імунокомпетентних господарів минають з незначними наслідками. Дихальна недостатність може розвинутися внаслідок бактеріальної суперінфекції – Streptococcus pneumoniae, Staphylococcus aureus, Streptococcus pyogenes (стрептокок групи A), Haemophilus influenzae та виникнення ГРДС. Тяжке ураження легень за COVID‑19 має імунопатологічний ґенез. Вірус кору, крім бактеріальної суперінфекції та ГРДС, може спричинити реактивацію туберкульозу.
Прогноз
У переважної більшості пацієнтів із вірусною пневмонією прогноз є сприятливим. Деякі серотипи аденовірусу (особливо 2, 3, 7 і 21) були причиною розвитку хронічного перебігу з виникненням незворотних ателектазів, бронхоектазів, облітерувального бронхіоліту [17]. Аденовірус 14 має високий рівень смертності та захворюваності серед здорових пацієнтів. У тих, хто вижив, виникають серйозні наслідки, пов’язані з ураженням легень. Вірусна пневмонія може в майбутньому спричиняти інвалідність через інтерстиціальний фіброз. У немовлят, госпіталізованих щодо RSV-інфекції, згодом може розвинутися бронхіальна астма. Діагностику вірусних пневмоній необхідно здійснювати на підставі визначення випадку інфекційного захворювання (наказ Міністерства охорони здоров’я України № 905 від 28 грудня 2015 року), також варто застосовувати ПЛР і серологічні методи. Респіраторний секрет, зразки бронхоальвеолярного лаважу та тканин можна досліджувати за допомогою цитологічних і гістологічних методів. У клітинах, інфікованих ДНК-вірусами, часто є внутрішньоядерні включення. Цитоплазматичні включення зазвичай наявні в клітинах, інфікованих РНК-вірусами.
Наявність вірусних включень має низьку чутливість, тому їхня відсутність не завжди виключає інфекцію або активне захворювання.
Експрес-тести на виявлення антигена надають швидші результати, оскільки тест проводиться безпосередньо на зразках, отриманих від пацієнтів. Перевагою тестів на виявлення антигенів є вища специфічність для окремих вірусів. Окрім того, ці аналізи залишаються позитивними протягом декількох днів або тижнів, тоді як виділення культури виявляє лише життєздатний вірус. Для оптимальної діагностики вірусних інфекцій бажано використовувати методи визначення антигена разом із культурою клітин (з урахуванням різної чутливості методів) [66].
Експрес-тести на виявлення антигена RSV є інформативними в маленьких дітей, які виділяють вірус у високих титрах, але в дорослих ці методи мають низьку чутливість (порівняно із ПЛР) (0‑20%).
Жодна з вірусних пневмоній не спричиняє патогномонічних змін на рентгенограмах грудної клітки; бактеріальну пневмонію також неможливо відрізнити від вірусної на основі рентгенологічних даних. Слід пам’ятати, що рентгенографія грудної клітки має нижчу чутливість, ніж КТ.
У будь-якому випадку діагноз встановлюєтся на підставі сукупності клініко-лабораторних, інструментальних даних з урахуванням епідеміологічного анамнезу (як за будь-якого інфекційного захворювання).
Підходи до лікування
Пандемія COVІD‑19 виявила недоліки сучасних підходів до рекомендацій щодо лікування таких хвороб. Відсутність рандомізованих клінічних досліджень, а також їхній невдалий дизайн на початку пандемії, низька якість за рахунок колапсу систем охорони здоров’я зумовили надання помилкових початкових рекомендацій, які коштували життя багатьом хворим. У разі виникнення таких нестандартних ситуацій варто пам’ятати, що закономірності розвитку інфекційного процесу однакові, отже, схожими є і принципи лікування інфекційних хворих. Основний такий принцип – раннє застосування етіотропних або специфічних препаратів, здатних пригнічувати реплікацію збудника, тим самим допомагаючи імунній системі позбавитися від нього з мінімальними втратами для хворого. Крім того, метою лікування хворих на інфекційну патологію є не лише їх одужання, а й відсутність ускладнень та/або наслідків. Це також досягається тільки раннім лікуванням (ще до того, як стан хворого почне погіршуватися). Так, у травні 2023 р. у журналі The Lancet опубліковано дослідження, яке показало, що застосування нірматрелвіру/ритонавіру знижувало ризик затяжного COVID на 26%, молнупіравіру – на 14%. У ході аналізу було показано, що енситрелвір (доступний в Японії) також знижує ризик затяжного COVID‑19. Автори пишуть, що в сукупності ці дані свідчать про одне і те саме: використання противірусних препаратів у гострій фазі COVID‑19 може бути важливою стратегією запобігання постковідному синдрому. На сьогодні дуже важливим є аналіз надзвичайної ситуації, що склалася в період останньої пандемії, задля попередження трагічних помилок у майбутньому. На жаль, останнім часом усе частіше Всесвітня організація охорони здоров’я заявляє про те, що на нас чекає нова (ще тяжча) пандемія. Серед можливих її збудників розглядаються віруси пташиного грипу, денге, новий коронавірус тощо.
Лікування вірусних інфекцій є складним за рахунок обмеженої кількості ефективних етіотропних препаратів та/або відсутності до них широкого доступу. З іншого боку, респіраторні вірусні інфекції є найпоширенішими захворюваннями в людей та посідають 1-ше місце серед причин непрацездатності – навіть у міжепідемічний період на них страждає >1/6 частини населення планети.
В комплексній терапії вірусних пневмоній застосовують методи оксигенації, симптоматичне лікування (жарознижувальні препарати, аналгетики). Але найефективнішим є призначення противірусної терапії, причому якнайшвидше після встановлення відповідного діагнозу. За подальшого прогресування хвороби ефективність противірусних препаратів дещо знижується, але це не завжди може бути підставою для відмови від етіотропної терапії, оскільки в будь-якому випадку важливим є пригнічення вірусної реплікації. З іншого боку, за тяжкого перебігу захворювання вірусна реплікація може бути досить тривалою в організмі людини. Так, дослідження показали, що в разі тяжкого перебігу COVID‑19 життєздатний вірус виявляється навіть після 30-го дня захворювання, що робить актуальним противірусну терапію таким хворим не лише на амбулаторному етапі, а й при розвитку дихальної недостатності, причому єдиним дозволеним препаратом у такому разі є ремдесивір. Нірматрелвір/ритонавір демонструє найвищу ефективність для лікування COVID‑19 на амбулаторному етапі як препарат саме специфічної дії. Нірматрелвір зв’язується з мішенню – активним сайтом Mpro, інгібування якого запобігає реплікації вірусу. Водночас ритонавір підвищує біодоступність нірматрелвіру шляхом уповільнення його метаболізму за допомогою CYP3A [1, 2]. За результатами досліджень, застосування цієї комбінації на початковому етапі захворювання зменшує ризик прогресування на 89% порівняно із плацебо [3]. Крім того, цей препарат демонструє ефективність проти всіх відомих на сьогодні варіантів вірусу. При застосуванні нірматрелвіру/ритонавіру слід ураховувати чисельні лікарські взаємодії.
Молнупіравір внесено до рекомендацій NIH (National Institutes of Health, США), але не дозволено Європейським агентством з лікарських засобів (EMA) в 2023 р., тому що «на підставі сукупності даних неможливо зробити висновок, що молнупіравір може зменшити ризик госпіталізації або смерті чи скоротити тривалість хвороби або час до одужання в дорослих із ризиком тяжкого захворювання».
За грипу найефективнішими є засоби специфічної етіотропної терапії, як-от озелтамівір (75 мг/добу), занамівір (2 інгаляції по 5 мг 2 р/добу, добова інгаляційна доза складає 20 мг); зазвичай тривалість лікування становить 5 днів. Ці препарати належать до інгібіторів нейрамінідази вірусу. Балоксавір марбоксил – проліки, які шляхом гідролізу перетворюються в балоксавір (активну форму, що має противірусну активність щодо вірусу грипу). Препарат затверджено Управлінням з контролю за якістю продуктів харчування та медичних засобів США (Food and Drug Administration, FDA) 24 жовтня 2018 р. Балоксавір інгібує кеп-залежну ендонуклеазу – важливий білок, що бере участь в ініціації вірусної транскрипції шляхом розщеплення кепованої мРНК, завдяки чому пригнічується реплікація вірусу грипу. Рекомендована доза лікарського засобу для пацієнтів віком >12 років розраховується з огляду на масу тіла та застосовується одноразово (табл. 1).
|
Таблиця 1. Рекомендована доза лікарського засобу балоксавір марбоксил для дорослих та підлітків віком >12 років |
|
|
Маса тіла пацієнта (кг) |
Рекомендована одноразова пероральна доза |
|
Від 40 до 80 кг |
2 таблетки по 20 мг (одночасно); сумарна одноразова доза складає 40 мг (блістерна упаковка містить 2 таблетки по 20 мг) |
|
Від 80 кг |
2 таблетки по 40 мг (одночасно); сумарна одноразова доза становить 80 мг (блістерна упаковка містить 2 таблетки по 40 мг) |
Застосування адамантанів (ремантадин) пов’язано з появою резистентності вірусу грипу; багато сучасних штамів є нечутливими до них, включаючи вірус грипу А/H1N1, тому емпіричне використання цих агентів не рекомендується. Пташиний грип А/H5N1 слід лікувати озелтамівіром навіть після 48 год із дебюту симптомів, оскільки повідомлялося про зниження смертності госпіталізованих осіб у разі його застосування. Оптимальна тривалість лікування і доза невідомі, але Всесвітня організація охорони здоров’я рекомендує розглянути питання про вище дозування озелтамівіру (наприклад, 150 мг перорально 2 р/день) і більшу тривалість терапії за тяжкого перебігу захворювання. Слід пам’ятати, що пташиний грип H5N1 виявив резистентність до озелтамівіру (мутації H274Y і N294S). Ці резистентні штами зберігали чутливість до занамівіру. Деякі віруси, що циркулюють у птахів, продемонстрували знижену чутливість до занамівіру, але мають чутливість до адамантанів. Отже, для резистентних штамів можна розглянути комбіновану терапію інгібітором нейрамінідази й адамантаном або озелтамівіром та рибавірином; іноді рекомендують навіть потрійну терапію інгібітором нейрамінідази, адамантаном, рибавірином [61]. Балоксавір активний щодо багатьох підтипів грипу А, в т. ч. пташиних штамів (H1N2, H5N1, H5N2, H5N6, H7N9 і N9N2). На ефективність препарату не впливає підтип або географічний регіон походження вірусу. Комбіноване лікування балоксавіром та озелтамівіром вивчали на мишачій моделі. Поєднання цих препаратів спричиняло синергічну відповідь проти вірусу грипу, але клінічні випробування такого методу серед людей дотепер не проводилися [11].
Для лікування RSV-пневмонії у світі єдиним засобом противірусної терапії є рибавірин, але існують суперечливі дані щодо його ефективності. Застосовують цей препарат у вигляді аерозолів і перорально; більшість даних свідчать про переваги такої терапії у пацієнтів із високим ризиком тяжкого перебігу (реципієнти трансплантації гемопоетичних стовбурових клітин, HSCT). Для цих хворих використовували високі дози рибавірину в формі аерозолю короткої дії (60 мг/мл протягом 2 год через маску 3 р/день). RSV-специфічний внутрішньовенний імуноглобулін (палівізумаб), який являє собою моноклональне антитіло, також успішно використовувався разом із рибавірином у формі аерозолів і перорально в пацієнтів із високим ризиком тяжкого перебігу [57]. На жаль, в Україні відсутній доступ до аерозольної та внутрішньовенної форми рибавірину, а також до палівізумабу [88, 89].
Для лікування аденовірусної пневмонії застосовують цидофовір. Цей препарат продемонстрував хорошу активність in vitro проти аденовірусів, включаючи серотип 14, а також є ефективним у лікуванні аденовірусної інфекції у пацієнтів з ослабленим імунітетом [90]. Доза становить 5 мг/кг/тиж протягом 2 тиж, згодом кожні 2 тиж додають пробенецид 1,25 г/м2, який вводиться за 3 год до цидофовіру. Застосування рибавірину в більшості досліджень не показало ефективності для лікування аденовірусних пневмоній [92-94].
Для етіотропного лікування пневмоній, пов’язаних із PIV, також застосовують рибавірин (перорально й аерозольно), що асоціюється зі зниженням виділення вірусу та клінічним покращенням у пацієнтів з ослабленим імунітетом [95].
Даних про лікування метапневмовірусу людини (hMPV) рибавірином бракує, деякі повідомлення обмежуються хворими після трансплантацій органів; хоча дані на тваринах показали певну перспективу, до широкого застосування він не рекомендований у разі цього захворювання [96, 97].
Основне лікування гострої ЦМВ-пневмонії у пацієнтів з ослабленим імунітетом – ганцикловір (5 мг/кг внутрішньовенно 12 год протягом 14-21 днів, згодом – валганцикловір 900 мг перорально 1 р/добу). Також застосовують високі дози внутрішньовенного імуноглобуліну (ВВІГ) або специфічний ЦМВ-імуноглобулін. Така комбінована терапія базується на тезі, що ураження легень є не лише результатом прямої дії вірусу, а й імунологічних реакцій, спричинених ЦМВ. У реципієнтів після трансплантації легень застосування ганцикловіру із ЦМВ-імуноглобуліном або ВВІГ асоціюється зі зниженням летальності [103]. Фоскарнет є альтернативним препаратом для лікування резистентної до ганцикловіру ЦМВ-пневмонії. Комбінація фоскарнету з ганцикловіром може забезпечити противірусний синергізм, але це потребує ретельного моніторингу через збільшення токсичності [104]. Цидофовір – третій варіант лікування, але дані щодо його ефективності обмежені.
Пневмонію, спричинену вірусом простого герпесу, лікують внутрішньовенним введенням ацикловіру (250 мг/м2 кожні 8 год).
Для лікування документально підтвердженої пневмонії, спричиненої VZV, застосовують ацикловір (10 мг/кг внутрішньовенно кожні 8 год протягом 7 днів). Вагітним у ІІІ триместрі ацикловір призначають у дозі 10 мг/кг внутрішньовенно кожні 8 год упродовж 5 днів; також слід розглянути питання про терапію специфічним імуноглобуліном проти вітряної віспи та herpes zoster (VZIG).
Лікування пневмонії, спричиненої вірусом кору, зазвичай має підтримувальний характер. Дітям, інфікованим ВІЛ, і дорослим з ослабленим імунітетом призначають внутрішньовенно рибавірин (20-35 мг/кг/добу протягом 7 днів) та/або рибавірин у вигляді аерозолів (як за терапії у разі RSV-пневмоній) [101].
Лікування хантавірусного легеневого синдрому (HPS) має підтримувальний характер, а також передбачає корекцію гіпоксемії, лактоацидозу та гіпотензії. Рекомендуються механічна вентиляція легень і оптимальне дозування рідини під контролем моніторингу гемодинаміки, уникнення надмірного введення рідини та використання кардіотоніків.
Незважаючи на те що внутрішньовенне введення рибавірину було пов’язане з певним успіхом у лікуванні деяких буньявірусів (Bunyaviridae), як-от вірус Hantaan (збудник геморагічної гарячки з нирковим синдромом), вірус гарячки долини Ріфт і вірус гарячки Крим-Конго, він не продемонстрував жодної ефективності при HPS, можливо, тому що смерть зазвичай у таких хворих настає протягом 24-48 год після госпіталізації [76], що ще раз підкреслює необхідність негайного призначення противірусної терапії у разі тяжкого перебігу вірусних захворювань, які можуть спричинити розвиток пневмонії.
В Україні для лікування грипу і деяких ГРВІ широко застосовують енісамію йодид, який пройшов безліч досліджень фармакокінетики та фармакодинаміки в лабораторіях країн Євросоюзу, США, а також згідно із класифікацією Центру з методології статистики лікарських препаратів Всесвітньої організації охорони здоров’я (Норвезький інститут суспільної охорони здоров’я) отримав АТС-код: J05AX17 – група противірусних препаратів. Енісамію йодид є похідним ізонікотинової кислоти, його противірусна дія пов’язана з пригніченням РНК-полімерази вірусу грипу. Енісамію йодид ефективно пригнічував реплікацію вірусу SARS-CoV-2 in vitro в клітинах Caco-2. У дослідженнях in vitro з використанням інфікованих вірусом грипу нормальних бронхоепітеліальних клітин людини (normal human bronchial epithelial (NHBE) cells) виявлено зниження вірусних титрів на 3 log (у 1000 разів) унаслідок інкубації з енісамію йодидом протягом 24 год. Енісамію йодид пригнічував реплікацію різних штамів вірусу грипу типу А (H1N1, H3N2, включаючи високопатогенні штами H5N1 та H7N9) і В, а також резистентні до озелтамівіру, занамівіру, римантадину мутантні штами вірусу грипу. Встановлено інгібувальну дію енісамію йодиду проти респіраторно-синцитіального вірусу та коронавірусу. У 2019 р. у лабораторії Аарт’яна те Велтуїса (Кембридж, Велика Британія) було відкрито прямий інгібувальний ефект енісамію йодиду на вірусну РНК-полімеразу, який здійснюється його активним метаболітом VR17-04. Раніше науковою групою під керівництвом Бернадетт Ковач (Bernadette Kovach) ідентифіковано активний транспортер ОСТ 1 для закачування енісамію йодиду в нормальні бронхоепітеліальні клітини, що вистилають дихальний тракт людини і є воротами для грипозної інфекції. У ДУ «Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України» (м. Київ) верифіковано та підтверджено результати вірусологічних досліджень, виконаних американськими вченими на культурі диференційованих нормальних бронхоепітеліальних клітин людини (dNHBE).
Спосіб застосування наведено в таблиці 2.
|
Таблиця 2. Спосіб застосування препарату енісамію йодид у дітей та дорослих |
||
|
Форма випуску |
Схема застосування для лікування |
Схема застосування для профілактики |
|
Капсули по 500 мг |
1 капсула 3-4 р/добу, 5-7 днів |
- |
|
Таблетки по 250 мг |
1-2 таблетки 2-4 р/добу, 5-7 днів |
Дітям віком >12 років. 1 таблетка через день упродовж 2-3 тиж |
|
Таблетки по 125 мг |
Дітям з 6 до 12 років по 125 мг 2-3 р/добу протягом 7 днів |
Дітям з 6 до 12 років по 125 мг через день протягом 2-3 тиж |
|
Енісамію йодид для дітей Сироп |
Сироп у вікових дозах – |
- |
Потенційно ефективними противірусними засобами є антисептики групи поверхнево-активних речовин. З огляду на відсутність в Україні реєстрації та/або знижений доступ до деяких противірусних препаратів, що застосовуються інгаляційно, швидке призначення таких лікарських засобів може вплинути на зниження вірусного навантаження в організмі людини, а отже, сприяти легшому перебігу захворювання. Вони гальмують процес депротеїнізації вірусу в клітині шляхом зниження рівня рН, мають лізосомотропні властивості, завдяки чому можуть пригнічувати репродукцію вірусу в клітині. Властивості цих препаратів впливають на структуру та взаємодію рецепторів вірусу та клітин хазяїна, втручаючись у ранні етапи взаємодії вірусу із клітиною, що також спричиняє гальмування процесу вірусної репродукції [22].
Відомим представником таких засобів є декаметоксин – бісчетвертинна амонієва сполука, напівсинтетичний препарат, поверхнево-активний катіонний детергент із широкою протимікробною активністю. Він характеризується вираженим бактерицидним впливом на стафілококи, стрептококи, дифтерійну й синьогнійну палички, капсульні бактерії; чинить вірусоцидну дію, має фунгіцидний ефект (мікроспорії, еритразми, деякі види пліснявих грибів), а також спостерігається його протистоцидна дія на трихомонади, лямблії.
У процесі лікування препаратом підвищується чутливість антибіотикорезистентних мікроорганізмів до антибіотиків; він практично не всмоктується слизовими оболонками, неушкодженою шкірою і рановою поверхнею [23]. Механізм дії декаметоксину може бути пов’язаний із впливом на позаклітинний вірус й ушкодженням вірусної протеази. Крім того, властивості цього препарату як поверхнево-активної речовини перешкоджають взаємодії вірусних і клітинних рецепторів, тобто іншим механізмом дії декаметоксину можна вважати його вплив на ранні етапи взаємодії вірусу із клітиною-хазяїном, як-от адсорбція, проникнення й депротеїнізація вірусу грипу [24]. Зазначені ефекти можуть сприяти зменшенню вірусного навантаження, а відтак, зниженню ризику тяжкого перебігу коронавірусної інфекції та її ускладнень.
Застосовують препарат інгаляційно за допомогою небулайзера. Інгаляційна доставка ліків надає можливість створити високу концентрацію безпосередньо в місці ураження, а також мінімізувати системні ефекти, що особливо важливо для лікування захворювань органів дихання [25]. Декаметоксин у концентрації 0,2 мг/мл, що застосовується в однодозових контейнерах Декасан, не має токсичної дії, місцевих побічних ефектів, не подразнює слизових оболонок, не всмоктується з їхньої поверхні, тобто немає ризику його системної побічної дії.
Лікування тяжкої пневмонії в умовах відділення інтенсивної терапії
Проводять дихання з опором на видиху (глибокі вдихи не рідше 1 сеансу/год). За наявності постійних хрипів або ателектазу легень на рентгенограмі показана фібробронхоскопія. Крім того, призначають інгаляції β2-адреноміметиками, аерозольтерапію, муколітики. Інфузійна терапія – рестриктивний режим інфузій; здебільшого проводиться в невеликих об’ємах.
Усім хворим на негоспітальну пневмонію показано вживання значної кількості рідини. Водночас слід пам’ятати, що інтенсивне наводнення організму (як ентеральним шляхом, так і при проведенні інфузійної терапії) може зумовити в легенях підвищення вмісту позасудинної рідини. Її накопичення супроводжується потовщенням альвеолокапілярної мембрани, розвитком субклінічного та клінічного набряку легень, тому в хворих із позагоспітальною пневмонією, яким в умовах стаціонару проводять регідратацію, завжди необхідно розглядати можливість проведення оксигенотерапії.
Для лікування тяжких уражень легень в Японії у період пандемії грипу А/Н1N1 був досліджений препарат едаравон (3-метил-1-феніл-2-піразолін-5-он), який раніше застосувався для лікування інфарктів та інсультів. З’ясувалося, що едаравон запобігає ураженню легень різними факторами (ліпополісахариди, протипухлинні препарати тощо) та за ефективністю не поступається дексаметазону, а їхня комбінація чинить синергічний ефект.
Едаравон – це антиоксидант широкого спектра дії. Крім протиінсультного ефекту, він демонструє помітну плейотропну, включаючи протизапальну, антицитокінову, імуномодулювальну, антиапоптотичну, антинекротичну, антифібротичну, мембраностабілізувальну, дію, захищає легеневий сурфактант і численні органи від ушкодження внаслідок ішемії, отже, є найбільш допоміжним препаратом у запобіганні та лікуванні ГРДС.
Едаравон на ринку України представлений під торговою назвою Ксаврон.
Респіраторні вірусні інфекції залишаються актуальною проблемою суспільної охорони здоров’я. Розвиток пневмонії при цих захворюваннях має небезпеку для хворих унаслідок швидкого розвитку ГРДС. Своєчасна діагностика, отже, й лікування – запорука не лише збереження життя хворим, а і зменшення кількості тривалих наслідків, які впливають на якість життя та іноді становлять смертельну небезпеку для хворих. Противірусна терапія – головний компонент лікування в дебюті хвороби, що запобігає виникненню тяжких ускладнень, але за їхнього розвитку така сама швидка та збалансована терапевтична відповідь дозволяє досягти терапевтичного успіху. Нехтування раннім лікуванням є неприпустимим і необґрунтованим з наукового погляду.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 15 (551), 2023 р