12 жовтня, 2021
Рапіра: фехтувальна точність лікування пацієнтів із респіраторними інфекціями під час пандемії COVID‑19
 Респіраторні інфекції справедливо вважають найрозповсюдженішою інфекційною патологією людини; за місцем виникнення їх можна умовно розподілити на негоспітальні (інфекції, які з’являються в соціумі, за межами лікувальних закладів) і госпітальні. За локалізацією процесу загальноприйнятим є розподіл на інфекції верхніх (ніс, глотка, гортань) і нижніх (трахея, бронхи, паренхіма легень) дихальних шляхів. За етіологічним принципом виокремлюють вірусні, бактеріальні, грибкові та змішані інфекції. У нозологічній структурі негоспітальних інфекцій нижніх дихальних шляхів (НІНДШ) домінує негоспітальна пневмонія – провідна причина інфекційної смертності в сучасному світі. Коронавірусна хвороба, зумовлена вірусом SARS‑CoV‑2 (COVID‑19), одним із найдраматичніших проявів якої є первинна вірусна пневмонія з тяжкою дихальною недостатністю, вкотре зосередила увагу суспільства на проблемі НІНДШ і вказала не необхідність глибшого вивчення патогенезу інфекційних уражень легень (особливо вірусної етіології).
Респіраторні інфекції справедливо вважають найрозповсюдженішою інфекційною патологією людини; за місцем виникнення їх можна умовно розподілити на негоспітальні (інфекції, які з’являються в соціумі, за межами лікувальних закладів) і госпітальні. За локалізацією процесу загальноприйнятим є розподіл на інфекції верхніх (ніс, глотка, гортань) і нижніх (трахея, бронхи, паренхіма легень) дихальних шляхів. За етіологічним принципом виокремлюють вірусні, бактеріальні, грибкові та змішані інфекції. У нозологічній структурі негоспітальних інфекцій нижніх дихальних шляхів (НІНДШ) домінує негоспітальна пневмонія – провідна причина інфекційної смертності в сучасному світі. Коронавірусна хвороба, зумовлена вірусом SARS‑CoV‑2 (COVID‑19), одним із найдраматичніших проявів якої є первинна вірусна пневмонія з тяжкою дихальною недостатністю, вкотре зосередила увагу суспільства на проблемі НІНДШ і вказала не необхідність глибшого вивчення патогенезу інфекційних уражень легень (особливо вірусної етіології).
Наразі накопичені знання дають змогу розглядати COVID‑19 як двофазне вірусне захворювання із чітко вираженими стадіями [1], перша з яких зумовлена масивною реплікацією вірусу SARS-CoV‑2, триває ≈1 тиж і супроводжується клінічними проявами гострої респіраторної інфекції. У частини пацієнтів перебіг інфекційного процесу ініціює початок другої (імунологічної) стадії, яка характеризується диспропорційно великою імунною відповіддю, розвитком дифузного альвеолярного ушкодження та інтерстиційного запалення легень [2]. Запальний процес набуває системного характеру, супроводжується гіперпродукцією цитокінів і хемокінів, активацією системи гемокоагуляції з ураженням мікросудинного русла та зумовлює поліорганні ураження. У зв’язку з тим, що етіотропні препарати, на жаль, не підтвердили очікуваної ефективності, сьогодні основа фармакотерапії – патогенетичні засоби. За допомогою численних досліджень продемонстровано зниження показників смерті госпіталізованих хворих з потребою в оксигенотерапії та/або штучній вентиляції легень (ШВЛ) при використанні системних кортикостероїдів [3‑5]. Повідомляється про позитивні ефекти цієї групи препаратів у пацієнтів із COVID‑19-індукованим інтерстиційним ураженням легень [6]. В основі протизапальної дії кортикостероїдів лежить їхня здатність потужно пригнічувати продукцію прозапальних цитокінів, якою супроводжується перебіг другої (імунологічної) фази COVID‑19 [7].
З огляду на велике значення ендотеліальної дисфункції судин, а також активацію системи гемостазу внаслідок виникнення мікротромбоваскулітів іншим важливим напрямом патогенетичної терапії є застосування низькомолекулярних гепаринів і прямих пероральних антикоагулянтів [8].
Пошук перспективних і безпечних препаратів із плейотропними ефектами, здатними протидіяти різним шляхам патогенезу COVID‑19, наштовхує експертів на перспективну ідею використання одного з найпопулярніших муколітичних засобів – ацетилцистеїну (в пацієнтів з COVID‑19). Ацетилцистеїн (N-ацетилцистеїн, N-ацетил-L-цистеїн, NAC) – синтетичний препарат, що є похідним амінокислоти L-цистеїну; відповідно до фармакологічних настанов він належить до групи муколітичних і відхаркувальних засобів, що застосовуються перорально, парентерально й інгаляційно. Ця невелика молекула (із клінічним досвідом майже 60 років) має низку позитивних ефектів, що можуть виявитися корисними в лікуванні пацієнтів з COVID‑19 [9]. Ацетилцистеїн добре всмоктується та розподіляється в організмі; його біодоступність складає лише 10% при пероральному застосуванні у зв’язку з ефектом першого проходження через печінку [63]. Максимальна концентрація ацетилцистеїну в крові досягається протягом 1-3 год, а найвищі концентрації визначаються в легенях (у т. ч. у бронхіальному секреті), печінці, а також нирках. Ацетилцистеїн у помірній кількості (≈50%) зв’язується з білками крові; проникає через плацентарний бар’єр і може накопичуватися в амніотичній рідині; метаболізується в печінці з утворенням як активних (цистеїн), так і неактивних метаболітів (неорганічні сульфати, діацетилцистеїн; виводиться з організму із сечею (як неактивний метаболіт); період напіввиведення становить 1 год, а за печінкової недостатності цей час може збільшуватися до 8 год [64]. Ацетилцистеїну притаманний муколітичний ефект, який з успіхом використовується в клінічній медицині для розрідження в’язкого мокротиння в пацієнтів із муковісцидозом, бронхіальною астмою, хронічним обструктивним захворюванням легень (ХОЗЛ), гострими та хронічними захворюваннями верхніх дихальних шляхів, гострим бронхітом і навіть ВІЛ-інфекцією; препарат також призначається при нервово-психічних захворюваннях, передозуванні парацетамолом, отруєнні сполуками важких металів, токсичних міокардитах [10, 11]. Ацетилцистеїн – дериват амінокислоти L-цистеїн і попередник глутатіону, ключовими властивостями якого є очищення тканин від вільних радикалів та утворення комплексів з іонами металів [12]. Ацетилцистеїну властива протизапальна активність, яка реалізується шляхом пригнічення ядерного транскрипційного фактора NF-kB активованих B-лімфоцитів і модуляції синтезу прозапальних цитокінів [13]; його здатність обмежувати активність оксидантного стресу широко застосовується в лікуванні хронічних запальних захворювань [14]. Ще однією корисною характеристикою ацетилцистеїну є здатність руйнувати біоплівки, які утворюють клінічно значимі бактеріальні патогени [15].
Отже, розглянемо основні властивості ацетилцистеїну у площині можливостей його використання у складі комплексного лікування пацієнтів із COVID‑19-асоційованою негоспітальною пневмонією.
Антиоксидантний ефект
Потужний системний запальний процес, який спостерігається в організмі протягом імунологічної фази COVID‑19, супроводжується утворенням активних форм кисню (АФК), що спричиняє появу неконтрольованого оксидативного стресу [16].
АФК – малі молекули з високим ступенем активності завдяки наявності в них неспарених валентних електронів (іони кисню, пероксиди, вільні радикали); їхнє надмірне утворення в клітині зумовлює незворотне руйнування ліпідів, нуклеїнових кислот і білків. Протидіяти їм спроможні ферментні системи організму людини (супероксиддисмутаза, глутатіонпероксидаза, каталаза тощо), які забезпечують окислювально-відновний баланс [17]. Утім, перебіг COVID‑19 супроводжується не лише гіперпродукцією вільних радикалів, а й зменшенням активності антиоксидантних ензимів, зниженням концентрацій вітамінів A, C, E та більш низьким умістом есенціальних мікроелементів (Se, Zn, Mg, Cu) [18].
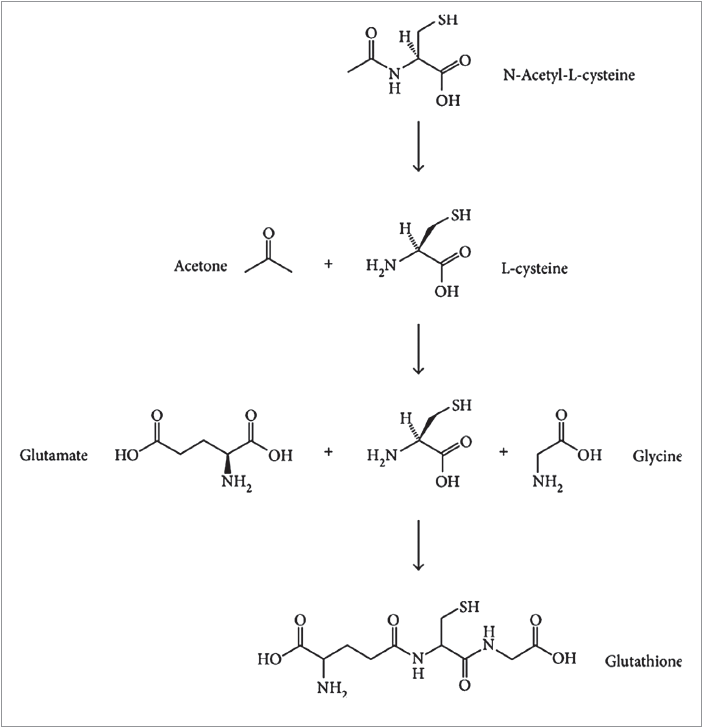
Відомо, що одним із фундаментальних біохімічних процесів, який забезпечує стабільність метаболізму клітини, є тіол-дисульфідний обмін. Сульфгідрильні SH-групи залишків цистеїну мають важливе значення щодо передавання внутрішньоклітинної інформації [19]. Базовим компонентом окислювально-відновлювального контролю в клітинному метаболізмі є здатність тіольних груп змінювати свій редокс-стан з подальшою зміною конформаційних, каталітичних і регуляторних функцій білків. Цей механізм виконує свою функцію завдяки наявності в клітині одночасно відновленої та окисленої форм глутатіону [20, 21]. Відновлений глутатіон являє собою водорозчинний трипептид, що складається із залишків амінокислот L-глутамату, L-цистеїну та гліцину (рис.); він є стійкішим до окислення (порівняно із цистеїном), що робить його придатнішим для підтримки внутрішньоклітинного редокс-потенціалу. Глутатіон не лише бере участь у процесах передачі сигналів у клітині, контролю активності факторів транскрипції, а і є основним внутрішньоклітинним антиоксидантом, що слугує як пастка для вільних радикалів. Водночас глутатіон – косубстрат у реакціях детоксикації пероксидів, які каталізуються ензимами глутатіонпероксидазою та глутатіонтрансферазою.
Рис. Утворення глутатіону
Порушення гомеостазу глутатіону здатне спричиняти оксидантний стрес, який супроводжує значну кількість захворювань людини. Доведено значення порушень метаболізму глутатіону за хвороби Паркінсона, ВІЛ-інфекції, алкогольної хвороби печінки, муковісцидозу, цукрового діабету. Не викликає також сумнівів ключова роль дисбалансу в системі глутатіону у прискореному старінні організму людини [22].
В пацієнтів із тяжким перебігом COVID‑19, госпіталізованих до відділення інтенсивної терапії, реєстрували достовірне зниження концентрації глутатіону в сироватці крові [23]. В невеликому спостережному дослідженні, проведеному в період поточної пандемії у Шанхаї (обстежено 198 хворих на COVID‑19; 9,5% пацієнтів знаходилися на лікуванні у відділенні реанімації), у 40% хворих реєстрували суттєве підвищення активності ферменту глутатіонредуктази, що було маркером порушень у системі антиоксидантного захисту [24]. Одним зі шляхів протидії виникнення дефіциту глутатіону є збільшення надходження до організму його попередників, зокрема цистеїну [25]. З огляду на низьку біодоступність цистеїну для збільшення його концентрації в організмі зазвичай використовують його транспортну форму – N-ацетилцистеїн. У дослідженні встановлено, що введення ацетилцистеїну в дозі 1000 мг/добу зумовлює значне підвищення вмісту глутатіону [26].
Для оцінки ефективності ацетилцистеїну в комплексній терапії пацієнтів з COVID‑19-асоційованою негоспітальною пневмонією середньої тяжкості до рандомізованого клінічного дослідження залучили 46 пацієнтів, серед яких 22 осіб отримували стандартне лікування, а 24 хворих додатково приймали ацетилцистеїн у дозі 1200-1500 мг/добу [27]. Результати випробування продемонстрували, що призначення ацетилцистеїну спричиняло статистично значиме підвищення рівня сатурації кисню в крові, швидшу нормалізацію рівня С-реактивного білка та швидшу регресію рентгенологічних змін у легенях; ці позитивні ефекти реалізувалися в скороченні терміну госпіталізації хворих.
Яскраво ілюструє антиоксидантні ефекти ацетилцистеїну клінічний випадок, опублікований у липні 2020 року в журналі Clinical immunology. До одного із клінічних центрів США було госпіталізовано пацієнта із тяжким перебігом COVID‑19 на тлі тяжкої генетичної патології – дефіциту глюкозо‑6‑фосфатдегідрогенази (Г6ФД). Стан хворого ускладнився приєднанням гемолітичної анемії. Одна з особливостей проведення терапії серед хворих з новою коронавірусною хворобою в першій половині минулого року – широке застосування гідроксихлорохіну – препарату, відомого своїм прооксидантним ефектом. Стартова терапія пацієнта передбачала застосування гідроксихлорохіну в дозі 400 мг/добу. На 5-й день перебування в стаціонарі стан хворого різко погіршився внаслідок прогресування дихальної недостатності та виникнення клінічно значимого гемолізу. Саме глибоке порушення в системі глутатіону на тлі дефіциту Г6ФД, посилене прийомом гідроксихлорохіну, спричинило появу гемолітичних порушень. Паралельно з посиленням респіраторної підтримки (переведення пацієнта на ШВЛ, згодом – застосування екстракорпоральної мембранної оксигенації, ЕКМО) була розпочата терапія ацетилцистеїном у дозі 600 мг кожні 12 год (внутрішньовенно) [28]. Упродовж подальших 2 тиж лікування стан пацієнта покращився; його виписали для продовження реабілітації. Терапевтичний підхід із призначенням ацетилцистеїну з антиоксидантною метою був згодом успішно використаний авторами ще в 9 пацієнтів із COVID‑19 на ЕКМО.
Отже, стабілізація систем антиоксидантного захисту й очищення від вільних радикалів, що досягається посиленням синтезу глутатіону (завдяки прийому ацетилцистеїну), є важливою складовою фармакотерапії пацієнтів із COVID‑19-асоційованою негоспітальною пневмонією.
Очевидно, для досягнення клінічно вираженого ефекту необхідно використання вищих доз препарату, що потребує внесення змін до офіційної інструкції для застосування ацетилцистеїну.
Противірусний ефект
Сьогодні (особливо у зв’язку з пандемією COVID‑19) зростає медико-соціальне й економічне значення вірусних інфекцій у сучасному світі. З огляду на це надзвичайно обнадійливими є повідомлення щодо наявності в ацетилцистеїну противірусної активності [29]; зокрема, зазначається про його здатність (у разі грипу) пригнічувати індукцію апоптозу й експресію генів, відповідальних за синтез прозапальних цитокінів і хемокінів, як-от ІЛ‑6 та ІЛ‑8, а також інтерферон-індукувального білка (IP‑10) [30, 31]. В експериментальних умовах ацетилцистеїн у комбінації з рибавірином або осельтамівіром пригнічував реплікацію вірусу грипу на ранній стадії інфекції, що проявлялося зменшенням смертності лабораторних тварин, інфікованих цим вірусом [32-34]. Противірусний ефект ацетилцистеїну при грипі підтверджений також і за допомогою клінічних досліджень. Для вивчення профілактичного ефекту ацетилцистеїну щодо попередження грипу, а також гострих респіраторних вірусних інфекцій (ГРВІ) до рандомізованого багатоцентрового плацебо-контрольованого дослідження було залучено 262 пацієнтів, серед яких 78% мали вік >65 років, а в 62% спостерігалися супутні нереспіраторні хронічні захворювання [35]. Ацетилцистеїн призначали в дозі 600 мг 2 р/добу впродовж 6 міс. За результатами подальшого спостереження доведено зменшення частоти, ступеня тяжкості та тривалості епізодів грипу і ГРВІ. В групі ацетилцистеїну в усіх хворих симптоми інфекції були менш вираженими (порівняно із групою плацебо). Водночас спостерігалася нормалізація показників клітинної ланки імунітету. Отже, згідно з висновками італійських учених, тривалий прийом ацетилцистеїну зменшує тяжкість перебігу грипу і ГРВІ (особливо в пацієнтів груп ризику), хоча й не попереджає появи грипу A/H1N1.
Застосування ацетилцистеїну в пацієнтів із тяжким перебігом грипу може підвищувати ефективність етіотропної противірусної терапії. Так, повідомляється про швидке покращення стану у хворого із септичним шоком на тлі грипу A/H1N1, якому було призначено комбіновану терапію осельтамівіром та ацетилцистеїном у високій дозі – 100 мг/кг/добу [36].
Персистуюча інфекція, зумовлена респіраторно-синцитіальним (РС) вірусом, є однією із причин прогресування хронічних респіраторних захворювань. Зокрема, РС-вірус – один з етіотропних чинників виникнення загострень ХОЗЛ; спричинене ним запалення слизової оболонки нижніх дихальних шляхів супроводжується порушенням фізико-хімічних властивостей бронхіального слизу й активності війчастого епітелію, що проявляється суттєвим сповільненням мукоциліарного кліренсу. Знижуючи експресію β-тубуліну, РС-вірус порушує циліагенез у клітинах війчастого епітелію. У власному випробуванні M. Mata та співавт. виявили, що ацетилцистеїн відновлював функцію респіраторного епітелію, зменшував прояви оксидантного стресу, гальмував розвиток РС-інфекції [37].
Одним з основних структурних білків коронавірусу SARS-CoV‑2 є т. зв. спайк-білок, який відповідає за з’єднання вірусу з основним клітинним рецептором – ангіотензинперетворювальним ферментом‑2; цей спайк-білок розглядається як основна мішень для розробки потенційних противірусних засобів. Цікавою є експериментальна робота австралійських і французьких дослідників [38], під час проведення якої вивчалася здатність у разі застосування ацетилцистеїну із бромелаїном (екстракт рослинного походження, який містить комплекс ензимів) руйнувати цілісність спайк- і капсидних білків коронавірусу SARS-CoV‑2. Виявлено, що комбінація ацетилцистеїн/бромелаїн руйнує дисульфідні зв’язки, порушуючи просторову структуру спайк-білка коронавірусу, унеможливлюючи в такий спосіб його з’єднання з рецептором клітини-хазяїна. Крім того, дослідники спостерігали пригнічення реплікації in vitro як дикого, так і мутантних штамів SARS-CoV‑2 під впливом досліджуваного продукту.
Імунопатологічна фаза коронавірусної хвороби зазвичай супроводжується появою дихальної недостатності, яка в ≈3% госпіталізованих хворих може зумовлювати потребу застосування ШВЛ [39]. Cкладною для лікування та потенційно фатальною залишається проблема вентилятор-асоційованої госпітальної пневмонії. Перебіг цього ускладнення, що з’являється в >30% пацієнтів на ШВЛ, супроводжується комплексом патогенетичних процесів, серед яких велике значення мають колонізація дихального тракту патогенною й умовно-патогенною флорою, утворення бактеріальних біоплівок, аспірація контамінованого тахеобронхіального секрету, процеси вільнорадикального ушкодження альвеолярного епітелію. З огляду на ці особливості та фармакологічні властивості ацетилцистеїну його застосування в пацієнтів із тяжкою вентилятор-асоційованою пневмонією має всі показання. Проведено проспективне рандомізоване подвійне сліпе плацебо-контрольоване дослідження серед 60 пацієнтів, які перебували на механічній вентиляції легень [40]. 30 хворих отримували ацетилцистеїн у дозі 600 мг 2 р/добу через назогастральний зонд, інші 30 пацієнтів – плацебо. Частота виникнення вентилятор-асоційованої пневмонії у хворих, котрі отримували комплексне лікування з додаванням ацетилцистеїну, була достовірно нижчою порівняно із групою плацебо (26,6 проти 46,6%; p=0,032). Із цим фактом також було тісно пов’язане зменшення тривалості перебування в палаті інтенсивної терапії (14,36±4,69 проти 17,81±6,37 діб; p=0,028) та в стаціонарі загалом (19,23±5,54 проти 24,61±6,81 діб; p=0,03). Частота повного одужання в групі ацетилцистеїну була достовірно вищою, ніж у групі плацебо (56,6 проти 30%; p=0,006), при цьому достовірних відмінностей за частотою появи небажаних явищ серед обстежених хворих не виявляли. В іншому випробуванні продемонстровано, що ацетилцистеїн, який призначався в дозі 600 мг 2 р/добу, значно зменшує рівні фактора некрозу пухлин і малонового діальдегіду, що проявляється обмеженням наслідків оксидантного стресу у хворих на пневмонію [41]. Отже, корекція запалення в тканинах легень шляхом застосування ацетилцистеїну в дозі 1200 мг/добу (з огляду на виражений антиоксидантний ефект) має позитивний вплив на результат лікування пацієнтів із пневмонією (особливо тяжкого перебігу).
В одноцентровому рандомізованому пілотному клінічному дослідженні вивчали переваги призначення ацетилцистеїну пацієнтам із гострим респіраторним дистрес-синдромом (ГРДС) на тлі COVID‑19. 47 хворих додатково до основної терапії отримували ацетилцистеїн внутрішньовенно в дозі 40 мг/кг/добу, а 45 пацієнтів – плацебо. Хоча відмінності між групами не досягли статистичної достовірності, в пацієнтів, котрі отримували ацетилцистеїн, реєстрували тенденцію до зменшення 28-денної смертності, частоти переведення на ШВЛ і середньої тривалості перебування у відділенні інтенсивної терапії [42].
Ад’ювантний ефект при антибіотикотерапії
Незважаючи на те, що COVID‑19 належить до вірусних інфекцій, у 5-10% пацієнтів перебіг захворювання може ускладнюватися внаслідок приєднання опортуністичної бактеріальної інфекції. Механізми, які цьому сприяють: вірус-індуковане пригнічення експресії низки генів, відповідальних за активацію систем антибактеріального захисту. Експериментальним шляхом доведена роль вірусів у порушенні мікробіоти кишечнику та дихальних шляхів, а також збільшення адгезії бактерій, зокрема пневмококів, до інфікованих вірусом клітин [43].
Етіотропна антибіотикотерапія – основний інструмент лікування пацієнтів із бактеріальною ко- чи суперінфекцією, однак ефективність протимікробної терапії може бути нівельована здатністю бактерій утворювати біоплівки. Останні являють собою багатоклітинну спільноту, об’єднану у просторову та метаболічну структуру, розташовану на межі розподілу середовищ і занурену в позаклітинний полімерний матрикс [44]. Досягти ерадикації мікробних колоній з такою просторовою орієнтацією надзвичайно складно. Мікроорганізми у зрілих біоплівках можуть бути дуже стійкими: їхня резистентність є у 2-1000 разів вищою, ніж у планктонних форм. Саме тому властивість ацетилцистеїну швидко руйнувати бактеріальні біоплівки шляхом розривання дисульфідних зв’язків мукополісахаридного матриксу тривалий час використовується в лабораторній і клінічній практиці для посилення ефекту антибіотиків [45].
Повідомляється, що ацетилцистеїн виявляє антибактеріальну активність проти різноманітних патогенних та умовно-патогенних бактерій, як-от S. epidermidis, E. coli, P. aeruginosa, K. pneumoniae [46, 47]. Такий ефект реалізується шляхом пригнічення метаболізму цистеїну й ушкодження есенціальних білкових структур у бактеріальній клітині через хімічну реакцію з тіольною групою (–SH) ацетилцистеїну. Препарат зменшує синтез екстрацелюлярної полімерної субстанції, що зумовлює порушення адгезії бактерій до епітеліального шару. Ацетилцистеїн як речовина з малою молекулярною масою легко проникає крізь біологічні мембрани, швидко порушуючи функціонування адгезивних протеїнів бактерій. Призначення ацетилцистеїну в комбінації з колістином, ципрофлоксацином, рифампіцином, карбеніциліном, гентаміцином і деякими іншими антибіотиками збільшує їхні антибактеріальні властивості [48, 49]. Використання ацетилцистеїну з антибіотиками підвищує ефективність терапії у пацієнтів з гострими та хронічними респіраторними інфекціями, зменшує інтенсивність і тривалість клінічних симптомів [50, 51]. Сьогодні здатність ацетилцистеїну руйнувати біоплівки також використовується в низці біотехнологій, спрямованих на захист матеріалів для імплантації, катетерів тощо [52]. Нещодавно опубліковано результати дослідження ефективності призначення ацетилцистеїну реанімаційним хворим із септичним шоком на тлі інфекції, спричиненої карбапенем-резистентними штамами K. pneumoniae й A. baumannii, яке продемонструвало статистично достовірне зниження смертності впродовж 30 днів з моменту залучення до випробування [53].
Наявні на сьогодні докази, отримані як у лабораторних, так і в клінічних умовах щодо здатності ацетилцистеїну позитивно впливати на перебіг респіраторних вірусних інфекцій, широко обговорюються в наукових публікаціях [54, 55]. Очевидно, що наявність в організмі хворих на COVID‑19 системної запальної відповіді й оксидантного стресу з масивним утворенням вільних радикалів, а також із глибокими порушеннями функціонування мукоциліарного апарату (особливо у випадках приєднання вторинної бактеріальної інфекції) обґрунтовує доцільність призначення ацетилцистеїну цим пацієнтам у складі комплексного лікування. Необхідно враховувати і наявність виснаження T-лімфоцитів, значне вірусне навантаження, гіперпродукцію цитокінів унаслідок надмірної антигенної стимуляції, порушення окислювально-відновлювальних процесів, зумовлене виникненням TNFγ-керованого запального процесу й іншими чинниками при коронавірусній хворобі [56].
Потенційно фатальним ускладненням COVID‑19 є ГРДС. Незважаючи на успіхи критичної медицини, смертність пацієнтів із ГРДС перевищує 40% [57]. ГРДС обумовлений процесом дифузного альвеолярного ушкодження, який завжди супроводжується утворенням АФК і перекисним окисленням ліпідів. Важливим способом протидії вторинному ушкодженню альвеолоцитів та їхньої базальної мембрани вільними радикалами може бути призначення ацетилцистеїну. В огляді 8 рандомізованих контрольованих досліджень за участю 289 пацієнтів із ГРДС доведено зменшення терміну лікування хворих у відділенні інтенсивної терапії за використання ацетилцистеїну [58].
Крім того, обговорюється можливість комплексного застосування ацетилцистеїну, оксиду азоту, міді й інших речовин у комбінації з ремдеcивіром у разі COVID‑19 [59]. У зв’язку зі стимулювальним впливом на імунну відповідь існує теоретичне підґрунтя для використання ацетилцистеїну в поєднанні з аскорбіновою кислотою, цинком і вітаміном D з метою профілактики й лікування COVID‑19 [60].
Станом на кінець червня 2021 року на платформі clinicaltrials.gov зареєстровано 10 клінічних досліджень з ацетилцистеїном при COVID‑19; лише 3 з них завершено (NCT04419025, NCT04900129, NCT04570254), а інші тривають. Утім, очікувати на публікації з ґрунтовним аналізом отриманих результатів необхідно щонайменше півроку.
Як медичний препарат ацетилцистеїн застосовується з 1960-х років і міститься в переліку есенційних медикаментів Всесвітньої організації охорони здоров’я; його також схвалено для використання Управлінням з контролю за якістю продуктів харчування та лікарських засобів США (FDA) [61, 62].
Серед генеричних препаратів ацетилцистеїну на ринку України слід виокремити препарат Рапіра від компанії «Фармак», що є одним із лідерів вітчизняної фармацевтичної індустрії; його переваги: здатність впливати на всі види мокротиння (слизове, слизово-гнійне, гнійне) та наявність зручних форм випуску (саше, які містять 100, 200, 600 мг порошку для приготування розчину). Наявність усіх додаткових до мукорегуляторного ефекту властивостей ацетилцистеїну (антирадикальна, противірусна, протизапальна дія) надають змогу призначати препарат Рапіра пацієнтам із сухим кашлем при гострому бронхіті й інших вірусних інфекціях респіраторного тракту. Показання до застосування – лікування гострих і хронічних захворювань бронхолегеневої системи, що супроводжуються підвищеним утворенням мокротиння. Препарат Рапіра виготовляється з дотриманням міжнародних вимог до якості, а також стандартів належної виробничої практики GMP. Вітчизняне виробництво дозволяє забезпечити найкраще співвідношення ціни та якості, що гарантує доступність препарату для пацієнтів з обмеженими фінансовими можливостями. Дозування: вміст саше слід розчинити в ⅓ склянки теплої води; діти віком від 2 до 6 років – 200-400 мг (розподілити на 1-3 прийоми на добу); діти віком від 6 до 18 років – 400-600 мг (1-3 прийоми на добу); діти віком від 12 років і дорослі – 600 мг (1 раз на добу).
Отже, препарат Рапіра – якісний генерик ацетилцистеїну, що може ефективно доповнити арсенал засобів додаткової терапії у пацієнтів з COVID‑19 будь-якого ступеня тяжкості (особливо за появи порушень мукоциліарного кліренсу чи приєднання опортуністичної бактеріальної інфекції).
Список літератури знаходиться в редакції.