Практичні аспекти диференційної діагностики кристал-індукованих артритів
 Мікрокристалічні артропатії (або кристал-індуковані артрити) — симптомокомплекс, зумовлений відкладенням різних солей у суглобах або навколосуглобових тканинах, а в деяких випадках, наприклад у разі подагри чи за відсутності відповідного лікування, і в тканинах інших органів. До мікрокристалічних артритів належать подагра (запалення, пов’язане з відкладанням кристалів моноурату натрію — МУН), хвороба відкладання кристалів пірофосфату кальцію (ПФК) — пірофосфатна артропатія (ПФА) та хвороба відкладання кристалів основних фосфатів кальцію (ОФК). «Кристали ОФК» є узагальнювальним терміном для опису декількох видів фосфатів кальцію, у тому числі карбонатапатиту, гідроксиапатиту, три- й октакальцієвих фосфатів, кристалів вітлокіту магнію [15].
Мікрокристалічні артропатії (або кристал-індуковані артрити) — симптомокомплекс, зумовлений відкладенням різних солей у суглобах або навколосуглобових тканинах, а в деяких випадках, наприклад у разі подагри чи за відсутності відповідного лікування, і в тканинах інших органів. До мікрокристалічних артритів належать подагра (запалення, пов’язане з відкладанням кристалів моноурату натрію — МУН), хвороба відкладання кристалів пірофосфату кальцію (ПФК) — пірофосфатна артропатія (ПФА) та хвороба відкладання кристалів основних фосфатів кальцію (ОФК). «Кристали ОФК» є узагальнювальним терміном для опису декількох видів фосфатів кальцію, у тому числі карбонатапатиту, гідроксиапатиту, три- й октакальцієвих фосфатів, кристалів вітлокіту магнію [15].
Подагра — це системне метаболічне тофусне захворювання, що розвивається у зв’язку із запаленням у місці відкладення кристалів МУН в осіб із гіперурикемією, зумовленою зовнішньосередовищними та/або генетичними чинниками [2]. Поширеність подагри сягає 1,2% серед дорослого населення Європи. Рівень захворюваності збільшується з віком: до 7% чоловіків у віці старше 65 років і до 3% жінок у віці старше 85 років мають цей діагноз. Персистуюче перевищення сироватковим рівнем сечової кислоти сатураційного порога (близько 404 мкмоль/л) призводить до накопичення та відкладення кристалів МУН у тканинах.
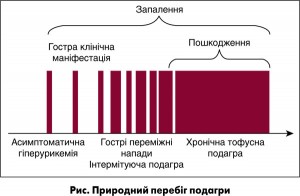
Початковий період захворювання супроводжується асимптомною гіперурикемією й відкладенням кристалів МУН на поверхні суглобового хряща та м’яких тканинах, що оточують суглоб. Подагра маніфестує гострим нападом надболючого синовіту в результаті поширення кристалів МУН у порожнину суглоба, де вони формують кристалічні депозити [2, 6].
Численні описи в літературі дали змогу сформувати погляд на класичний подагричний артрит як на гострий напад, що раптово починається, зазвичай уночі або під ранок, із болючого ураження плеснефалангового суглоба першого пальця стопи (І ПлФС).
Такі клінічні симптоми, як почервоніння та припухлість суглоба, котрі разом із болем досягають свого піку в перші 12 год артриту, є важливими діагностичними ознаками гострої подагри [2]. Артрит І ПлФС не є прерогативою виключно подагри, однак наявність таких типових ознак, як виражені гіперемія та припухлість, що поєднуються з гострою хворобливістю, змушує думати саме про подагричний артрит. Зазвичай вдається виявити наявність провокуючих чинників, які добре відомі: прийом алкоголю, часте споживання м’яса та жирної їжі, відвідування лазні (гіповолемія), операції, мікротравми, пов’язані з тривалими навантаженнями на стопу чи, навпаки, вимушеним статичним положенням (перельоти в літаку, перебування за кермом тощо), носіння незручного взуття з тривалим стисненням дрібних суглобів стопи й мікротравматизацією. Поєднання артриту з підвищеним рівнем у крові сечової кислоти (гіперурикемією) полегшує діагностику. За відсутності адекватного лікування, прийому уратознижувальних препаратів, покликаних знизити рівень сечової кислоти, під час наступних гострих нападів у патологічний процес можуть залучатися інші суглоби аж до поліартикулярного ураження.
Гострий напад подагри регресує (можливий і самостійний регрес) протягом 7-14 днів, і настає міжприступний період, упродовж якого пацієнт не пред’являє жодних скарг. Утім, за умови дії провокуючих чинників подібні гострі напади можуть виникати знову й знову, тривалість міжприступних періодів скорочується, й подагра переходить у фазу хронічної. Власне, у перебігу подагри виокремлюють три періоди: гострий подагричний артрит, період між нападами та інтермітуючий подагричний артрит, а також хронічну подагру. Природний перебіг подагри наочно представлений на рисунку.
Хронічну подагру діагностують за умови розвитку стійкого ураження суглобів, що зазвичай представлене оліго- чи поліартритом, на тлі якого продовжують виникати гострі спалахи класичного подагричного артриту. За хронічний артрит при подагрі приймають запальні явища в суглобах тривалістю понад 3 міс. При хронічному артриті залучаються суглоби не лише нижніх, а й верхніх кінцівок. У разі формування тофусів діагноз стає практично очевидним.
Тофуси є депозитами кристалів МУН і здатні досягати різних розмірів, іноді значних. Відкладення МУН у тканинах передбачає повільне епітаксіальне нарощення кристалів із формуванням кристалічних структур [18]. «Улюбленими» органами-мішенями є структури суглоба, насамперед хрящ і субхондральна кістка, а також нирки, шкіра, вушні раковини, суглобові сумки та місця кріплення сухожилків. Гістологічно тофус є крейдоподібним (білого кольору в центральній його частині) вузлом, що складається з кристалів МУН, білків і мукополісахаридів; відкладення кристалів оточені гістіоцитами, лімфоцитарним валом та фібробластами.
Формування тофусів є облігатним процесом для подагри. У суглобах вони можуть виявлятися вже після першого епізоду артриту. Видимі депозити кристалів МУН (як правило, підшкірні) є атрибутом хронічного перебігу хвороби, хоча швидкість їх формування вкрай варіабельна: як через 2 міс, так і через 25 років після початку хвороби. Підшкірні тофуси зазвичай локалізуються в ділянці пальців кистей і стоп, колінних суглобів, на ліктях і вушних раковинах, але можуть утворюватися практично на будь-яких ділянках тіла та внутрішніх органах. У літературі описані казуїстичні випадки відкладання уратних депозитів у стінці шлунка [7], тканинах нирки, міокарді й клапанах серця, а також у хребті, призводячи до повної деструкції хребців і розвитку життєзагрозливої неврологічної симптоматики [5].
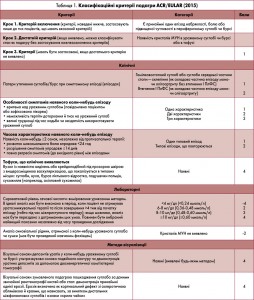
Новітні класифікаційні критерії подагри, запропоновані у 2015 році Американською колегією ревматологів (ACR) та Європейською протиревматичною лігою (EULAR), представлені в таблиці 1. Для діагностики подагри достатньо всього 8 з максимально можливих 23 балів.
Хотілося б підкреслити, що діагноз подагри є правомірним і без виявлення кристалів МУН, проте ймовірність помилки в цьому разі залишається досить високою [6]. Звісно, введення в стандарти ревматології обстеження синовіальної рідини на кристали є більш адекватним рішенням, ніж упровадження різних оцінювальних шкал. Тим більше з усього спектра показників, які зазвичай досліджують у синовіальній рідині, виявлення кристалів і забарвлення їх за Грамом є практично єдиними показниками, що мають реальне діагностичне значення [2, 7].
Хвороба депонування кристалів ПФК (або пірофосфатна артропатія) — захворювання, яке є результатом утворення й депонування кристалів ПФК у суглобах і розвитку у зв’язку з цим запалення імунного характеру [1]. Три інноваційні для свого часу методи сприяли відкриттю ПФА: завдяки рентгенографії було описано феномен хондрокальцинозу (ХК), впровадження поляризаційної мікроскопії дало змогу ідентифікувати неуратні кристали в синовіальній рідині, а рентгенівська дифракція розпізнала ці кристали як ПФК дигідрату (Ca2P2O7 × 2H2O). Питання про поширеність ПФА досить умовне, оскільки хвороба може маскуватися під остеоартрит (ОА), подагру, ревматоїдний артрит, проявлятись як недиференційований хронічний артрит, що ускладнює діагностику. Крім «маскування», складність діагностики ПФА можна пояснити низькою чутливістю й специфічністю променевих методів щодо виявлення ХК, передусім рентгенологічних, а також складністю виявлення кристалів ПФК, що є вирішальним фактором у діагностиці захворювання [3, 20]. Проте показано, що в 7-10% хворих старше 60 років під час рентгенологічного дослідження виявляють один із проявів ПФА — ХК [10].
ПФА — варіант ектопічної кальцифікації гіалінового й фіброзного хряща (міжхребцевого диска, лобкового симфізу, місць прикріплення сухожилля до кістки) з розвитком запалення. Захворювання може виникати в молодому віці (30-40 років) у разі спадкової (сімейної) та метаболічної форм (при гемохроматозі, гіперпаратиреозі, гіпомагніємії, гіпофосфатазії тощо), а також дебютувати після 55 років, що властиво ідіопатичній формі ПФА [11]. Для ПФА характерне ураження практично всіх суглобів, однак найчастіше в процес утягуються колінний і променевозап’ястний суглоби. Клінічні прояви ПФА різноманітні. Класичним варіантом ПФА є розвиток гострого артриту, найчастіше моноартриту, що характеризується раптовим розвитком із піком больових відчуттів і запальних реакцій упродовж 24-48 год та з подальшим регресом симптомів протягом 3-5 днів. Гострий моноартрит за перебігом надзвичайно нагадує подагру, не дарма гострий напад ПФА часто називають «псевдоподагрою». Утім, його зумовлюють зовсім інші кристали — кристали ПФК і він уражає інші групи суглобів, менш властиві подагричному нападу.
Необхідно підкреслити надзвичайно виражений запальний компонент нападу ПФА. Як і в разі подагри, напади можуть регресувати самостійно. Атаки ПФА часто виникають на тлі гострих інтеркурентних захворювань (загострення серцево-судинної патології, гострий інфаркт міокарда, травма, хірургічні втручання, гостра респіраторна вірусна інфекція тощо). Відзначено сезонність: напади достовірно частіше трапляються навесні. Примітно, що під час повторних атак уражається той самий суглоб, з якого й почалося захворювання [1]. Можливий також розвиток так званих малих нападів (petit attack), коли раптово виникає гострий біль у суглобі без його припухання, біль триває, як правило, 2-3 год і самостійно регресує без залишкових явищ. Гострі синовіти, пов’язані з відкладенням кристалів ПФК, на думку експертів, є однією з найчастіших причин гострих моноартритів у літніх пацієнтів [12]. «Улюбленою» локалізацією депонування кристалів ПФК є променевозап’ястний і колінний суглоби, дрібні суглоби кистей (зона зап’ястка), ліктьові, рідше — плечові, гомілковостопні, кульшові суглоби.
ПФА нагадує подагру ще з однієї позиції: для цієї артропатії, як і для подагри, властивий безсимптомний перебіг, що характеризується наявністю ХК за відсутності клінічних проявів. Як гіперурикемія тривалий час може бути асимптомною, так і кристали ПФК можуть відкладатися без клінічних симптомів. Ураження суглобів зазвичай виявляють випадково під час рентгенологічних досліджень, виконаних із різних приводів (травми, планове обстеження тощо). Проте травма, хірургічне втручання, загострення хронічних хвороб може стимулювати клінічну маніфестацію ПФА — гострий моноартрит.
Хронічний варіант перебігу ПФА нагадує ОА та часто позначається як «псевдоостеоартрит». Цей варіант спостерігають майже у половини хворих на ПФА. Диференційні відмінності між ПФА і ОА вкрай невиразні. Зокрема, вважається, що відмінності стосуються типу уражених суглобів і вираженості запальних реакцій. При ПФА, на відміну від первинного ОА, можуть уражатися суглоби, що не піддаються навантаженню: плечові, ліктьові, променевозап’ястні. І для ОА, і для ПФА типовим є ураження колінного суглоба, при ПФА, однак, при цьому відзначають украй високу «зацікавленість» пателофеморального компонента й істотну вираженість запалення, у тому числі й поєднання з гострими атаками за типом подагричних. Під час лабораторного обстеження виявляють різко підвищені рівні С-реактивного білка, фібриногену, ШОЕ, може виявлятися ревматоїдний фактор у низькому титрі. При ОА запальний компонент зазвичай проявляється помірно, триває довго й не розрішається самостійно. І ОА, і ПФА частіше розвиваються в літніх пацієнтів, що ускладнює виокремлення якихось принципових клінічних відмінностей [3].
«Улюблена» локалізація відкладання депозитів кристалів ПФК — меніски колінних суглобів. Останні відіграють життєво важливу роль у передачі навантаження, амортизації й стабільності суглоба. Дегенерація й кальцифікація менісків — ключові особливості ОА колінних суглобів. З’являється дедалі більше даних стосовно того, що меніски колінних суглобів не залишаються пасивними в процесі розвитку ОА. Кальцифікація менісків наростає з віком і корелює з ураженням хряща в осіб без симптомів артриту в анамнезі. Висловлюють припущення, що кальцифікація менісків і хрестоподібних зв’язок із провокацією запалення та втратою/порушенням стабілізувальної функції може первинно ініціювати ОА колінних суглобів [8].
Верифікацію діагнозу проводять з урахуванням виявлення кристалів ПФК у синовіальній рідині за допомогою методу поляризаційної мікроскопії та/або з огляду на характерну рентгенологічну картину: ХК менісків і суглобового хряща. Діагностичні критерії ПФА [20] представлені в таблиці 2.
При виявленні кристалів ПФК дигідрату методом поляризаційної мікроскопії можуть виникати деякі складнощі. Так, кристали ПФК мають слабке променезаломлення, що ускладнює їх візуалізацію. Неодмінною умовою візуалізації кристалів ПФК є їх досить висока концентрація в синовіальній рідині. Низька концентрація кристалів ПФК може призвести до негативного результату. Поріг концентрації для надійної ідентифікації кристалів методом поляризаційної мікроскопії — 10-100 мкг/мл. Крім того, результат залежить і від досвіду дослідника [1].
Другою ознакою, обов’язковою для достовірного діагнозу, є рентгенологічний феномен, так званий хондрокальциноз. Його діагностують на підставі виявлення типових кальцифікатів у ділянці гіалінового й фіброзного хрящів під час рентгенологічного дослідження суглобів. Найчастіше ХК діагностують під час рентгенографії колінних, променевозап’ястних суглобів і ділянки таза.
Ультразвукові критерії верифікації депозитів ПФК є такими:
• тонкі гіперехогенні стрічки, паралельні поверхні гіалінового хряща, аналогічні рентгенологічному феномену ХК;
• пунктирні депозити (плямисті структури), що складаються з декількох дрібних гіперехогенних плям (найбільш поширені в трикутних фіброзно-хрящових комплексах і сухожиллях);
• гомогенні гіперехогенні вузлові чи округлі депозити, частіше рухливі (локалізовані в бурсах або суглобових загортах).
Кристали ПФК, як правило, представлені «іскристими» включеннями, при цьому задня акустична тінь з’являється, тільки якщо їхній діаметр >10 мм. І навпаки, гіпоехогенні депозити, що мають задню акустичну «доріжку» навіть у ранній стадії (діаметром 2-3 мм), асоційовані з кристалами іншої природи (можливо, з кристалами ОФК) [13].
Отже, часте рецидивування гострого артриту в пацієнта з ОА, або гострий моноартрит із вираженими запальними симптомами, або перебіг суглобового синдрому з вираженими запальними змінами, виявлення під час рентгенологічного дослідження ХК певних суглобів, залучення в процес суглобів, що не піддаються навантаженню, зв’язок із пусковим фактором, яким найчастіше є травма та ішемія, є приводами для проведення диференційно-діагностичних заходів з метою виявлення ПФА [11], включаючи метод поляризаційної мікроскопії. При цьому діагноз подагри не виключає наявності хвороби депонування кристалів ПФК.
Своєчасна діагностика ПФА дає змогу запобігти прогресуванню деструкції хряща, пов’язаної з кальцифікацією.
Кристали ОФК та їх депонування патогенетично пов’язані з ОА, кальцинуючим тендинітом, гострим кристалічним артритом і атеросклерозом. Також ці кристали виявляють у синовіальній рідині при тяжкому деструктивному ОА й асептичному некрозі головки стегнової кістки набагато частіше, аніж кристали ПФК [4]. Так, феномен мінералізації хряща трапляється в 92% випадків у хворих на ОА у пізніх стадіях і в усіх хворих з асептичним некрозом. Кристали кальцію визначають у синовіальній рідині в 65% випадків гонартрозу [17], їх із високою частотою виявляють у гіаліновому хрящі при ОА, а також у 100% пацієнтів у суглобовому хрящі при проведенні операції тотального ендопротезування [9, 14]. Останнім часом з’явилися дані досліджень, які свідчать, що кристали ОФК не тільки є «мовчазними свідками» суглобових подій, а й беруть активну участь у патогенезі ОА [19].
Найкращою ілюстрацією потенційно деструктивного характеру кристалів ОФК є синдром Мілуокі (Milwaukee) — тяжке дегенеративне ураження великих суглобів, зазвичай плечових, зумовлене відкладенням кристалів ОФК. Цю патологію нерідко описували під іншими назвами: «сенільна деструктивна артропатія», «артропатія з розривом сухожиль обертальної манжети плеча» тощо. У синовіальній рідині таких пацієнтів виявляють численні скупчення кристалів апатиту, які, на думку D.J. McCarty, є причиною цієї патології [16]. Синдром Мілуокі частіше розвивається у жінок 70 років і старше й характеризується болем, припуханням і прогресуючим порушенням функції суглоба. Біль зазвичай посилюється в нічний час і за умови навантаження на суглоб. Відзначають виражену припухлість суглоба, зумовлену випотом, що поширюється при ураженні плечового суглоба в піддельтоподібний простір, а також нестабільність суглоба. Деструктивні зміни зачіпають усі суглобові структури: періартикулярні тканини, зв’язки, хрящ, кістку. Ураження буває двостороннім; окрім плечового суглоба, аналогічні зміни описували в інших великих суглобах, частіше — в колінному й кульшовому.
Найчастішою маніфестною формою ОФК-артропатії є гострий кальцифікуючий періартрит. Епізод гострого тендиніту може бути спровокований травмуванням сухожилля, фізичним навантаженням або яким-небудь соматичним захворюванням, у результаті чого відбувається вихід кристалів із кальцината в товщу сухожилля й навколишні тканини з розвитком бурхливої запальної реакції внаслідок фагоцитозу кристалів. При локалізації кальцината в плечовому суглобі розвивається гострий тендиніт надостного м’яза, субакроміальний бурсит. Також може розвиватися періартрит ліктьового, променевозап’ястного й колінного суглобів [9].
Хронічні форми відкладення кристалів ОФК зазвичай асоціюються з ОА, формуючи особливий фенотип захворювання [19]. Клінічно дегенерація суглобового хряща, зумовлена відкладенням кальційумісних кристалів, відрізняється від такої при первинному ОА. Якби кристали були простим епіфеноменом дегенерації хряща, їх виявляли б у суглобах, які найчастіше уражаються при первинному ОА, тобто в колінних, кульшових, дрібних суглобах кистей. І навпаки, хвороба депонування кристалів ОФК частіше уражає нетипові для первинного ОА суглоби — плечові, променевозап’ястні, ліктьові. Наявність кристалів у суглобовій (випітній) рідині асоціюється з тяжчою дегенерацією суглобового хряща. Обговорюють питання про те, що є причиною, а що наслідком: відкладення кристалів або дегенерація хряща. Дослідження на тваринах додатково підтверджують патогенну роль кристалів ОФК при ОА. Так, уведення кристалів ОФК у колінні суглоби мишей індукують синовіт, деградацію хрящової тканини й апоптоз хондроцитів. Точний механізм пошкодження суглобового хряща кальційумісними кристалами не відомий, але окремі елементи патогенного впливу охоплюють кристал-індуковане підвищення експресії інтерлейкіну‑1 та інтерлейкіну‑6, активацію остеокластогенезу, здатність індукувати матричні металопротеїнази, стимулювання синтезу простагландинів, активацію фібробластоподібних синовіоцитів [19]. Доведено, що саме фібробластоподібні синовіоцити експресують гени, які провокують патологічну кальцифікацію.
Дуже часто кристали ПФК і ОФК присутні в хрящі одночасно. Різниця між ними в тому, що кристали ОФК, як правило, виявляються при ОА, особливо в термінальних стадіях, часто утворюються й відкладаються в періартикулярних тканинах, а кристали ПФК утворюються виключно в хрящі.
Крім того, кристали ПФК візуалізуються за допомогою світлового та поляризаційного мікроскопа, рентгенологічно й ультрасонографічно в хрящі. Кристали ОФК такими способами візуалізувати неможливо. Тому, якщо візуалізується кальцифікація хряща (саме хряща, а не періартикулярних тканин), можна з великою впевненістю вважати, що пацієнт має хворобу депонування кристалів ПФК [1].
У певного відсотка випадків у хворих з ОА виявляють кристали ПФК без феномена ХК. І хоча відсутність ХК не виключає діагноз ПФА, складно діагностувати хворобу відкладання кристалів ПФК без виявлення власне депозитів у органі-мішені — хрящі. Більшість дослідників вважає, що діагноз ПФА необхідно встановлювати й таким хворим. Кристали ПФК на відміну від кристалів ОФК не є наслідком ОА. Виявлення навіть одного такого кристала в синовіальній рідині є діагностично значущим. Тому будь-яку синовіальну рідину, отриману із запаленого суглоба від пацієнта з недиференційованим діагнозом, особливо з колінних і променевозап’ястних суглобів хворих літнього віку, необхідно піддавати рутинному дослідженню на кристали ПФК і МУН.
У таблиці 3 представлено диференційні відмінності гострих мікрокристалічних нападів — подагричного артриту, гострого артриту, спричиненого депонуванням кристалів ПФК і кристалів ОФК.
Правильна диференційна діагностика та правильне встановлення діагнозу мікрокристалічних артритів дасть змогу безпомилково призначити терапію й уникнути руйнівної дії кристалів на суглобові тканини.
Література
1. Барскова В.Г. Диагностика болезни депонирования кристаллов пирофосфата кальция (пирофосфатной артропатии) // Русский медицинский журнал. — 2012. — № 7. — С. 350-353.
2. Барскова В.Г. Диагностика подагрического артрита // Русский медицинский журнал. — 2011. — № 19 (10). — С. 614-617.
3. Барскова В.Г., Ильина А.Е., Семенова Л.А. и др. Пирофосфатная артропатия — ревматологический синдром «айсберга»: время для переоценки значения в патологии суставов // Современная ревматология. — 2010. — № 2. — С. 5-11.
4. Дубиков А.И., Кабалык М.А., Перикеева Т. Ю. и др. Феномен микрокристаллизации хряща при коксартрозе и асептическом некрозе головки бедренной кости // Научно-практическая ревматология. — 2012. — № 5 (54). — С. 37-41.
5. Елисеев М.С. Поражение позвоночника при подагре // Русский медицинский журнал. — 2016. — № 24 (2). — С. 85-89.
6. Елисеев М.С., Владимиров С.А. Распространенность и клинические особенности подагры и болезни депонирования пирофосфата кальция у пациентов с острым артритом // Научно-практическая ревматология. — 2015. — № 53 (4). — С. 375-378.
7. Насонова В.А., Захарова М.М., Барскова В.Г. и др. Выявление кристаллов моноурата натрия в биоптатах слизистой оболочки желудка у больных подагрой // Терапевт. архив. — 2004. — № 76 (6). — С. 47-51.
8. Носков С.М., Дыбин С.Д., Цурко В.В. Болезнь депонирования кристаллов пирофосфата кальция (пирофосфатная артропатия) // Лечащий врач. — 2013. — № 4. — С. 12-18.
9. Носкова Т.С., Широкова К.Ю., Бахтиярова Т.И., Филимонова Н.С. Болезни отложения кристаллов кальция: клиника и лечения // Клиническая геронтология. — 2012. — № 18 (3-4). — С. 59-63.
10. Цурко В.В., Носков С.М. Остеоартроз с кристаллами пирофосфата кальция: клиника и лечение // Лечебное дело. — 2014. — № 2. — С. 18-23.
11. Шостак Н.А. Пирофосфатная артропатия — подходы к диагностике // РМЖ «Медицинское обозрение». — 2015. — № 25. — С. 1518-1519.
12. Doherty M. Calcium pyrophosphate dihydrate crystal-associated arthropathy. In: Hochberg M. (ed.). Rheumatology. Edinburgh: Mosby, 2003; 1937-50.
13. Falsetti P., Frediani B., Acciai C., et al. Ultrasonographic study of Achilles tendon and plantar fascia in chondrocalcinosis. J Rheumatol. 2004; 31: 2242-2250.
14. Fuerst M., Bertrand J., Lammers L., et al. Calcification of articular cartilage in human osteoarthritis. Arthritis Rheum. 2009; 60: 2694-2703.
15. Liote F., Ea H.-K. Clinical implications of pathogenic calcium crystals. Curr. Opin. Rheumatol. 2014; 26 (2): 192-196.
16. McCarty D.J., Halverson P.B., Carrera G.F., et al. Milwaukee shoulder — association of microspheroids containing hydroxyapatite crystals, active collagenase, and neutral protease with rotator cuff defects. I. Clinical aspects. Arthritis Rheum. 1981; 24: 464-473.
17. Nalbant S., Martinez J.A., Kitumnuaypong T., et al. Synovial fluid features and their relations to osteoarthritis severity: new findings from sequential studies. Osteoarthritis Cartilage. 2003; 11: 50-54.
18. Pascual E., Ordonez S. Orderly arrayed deposit of urate crystals in gout suggest epitaxial formation (letter). Ann Rheum Dis. 1998; 57: 255.
19. Stack J., McCarthy G. Basic calcium phosphate crystals and osteoarthritis pathogenesis: novel pathways and potential targets. Curr. Opin. Rheumatol. 2016; 28 (2): 122-126
20. Zhang W., Doherty M., Bardin T., et al. European League Against Rheumatism recommendations for calcium pyrophosphate deposition. Part I: terminology and diagnosis. Ann Rheum Dis. 2011; 70: 563-70.
СТАТТІ ЗА ТЕМОЮ Ревматологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Після десятиліть, а часом і запеклих суперечок про переваги та недоліки застосування глюкокортикоїдів (ГК) досягнута певна конвергенція. Сучасні рекомендації лікування таких захворювань, як ревматоїдний артрит (РА), ревматична поліміалгія (РПМ) та васкуліт великих судин відображають поточний стан консенсусу терапії ГК. Однак залишаються відкритими питання щодо можливості тривалого лікування дуже низькими дозами ГК у пацієнтів із РА, а також успішності пошуку інноваційних ГК (лігандів ГК-рецепторів) із покращеним співвідношенням користь/ризик....
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....
Зв’язок між рівнем сироваткової сечової кислоти (ССК) і ризиком серцево-судинних захворювань (ССЗ) упродовж багатьох років є предметом вивчення дослідників. Установлено, що рівень ССК – незалежний предиктор смерті від усіх причин і серцево-судинної смерті, зокрема від гострого коронарного синдрому, інсульту та серцевої недостатності (СН). Також опубліковано багато робіт про зв’язок між ССК і функцією нирок. Попри значну кількість публікацій, деякі моменти, а саме: яким є оптимальний поріг ССК для визначення ризику ССЗ, чи необхідна корекція значень ССК для функції нирок, чи є ССК ключовим патологічним елементом метаболічної дисрегуляції, потребують прояснення....