28 листопада, 2021
Ацетилсалициловая кислота: проверенная временем, современная, незаменимая
Часть вторая
 Аспиринорезистентность: значимость и способы преодоления
Аспиринорезистентность: значимость и способы преодоления
Известно, что терапия АСК не имеет одинаковой эффективности у всех пациентов как при первичной, так и при вторичной профилактике при ССЗ, а сердечно-сосудистые катастрофы в иных случаях возникают, несмотря на постоянный ее прием: так, например, несмотря на терапию АСК, около трети больных с атеросклеротическим поражением артерий нижних конечностей в течение 4 лет переносят различные тромботические осложнения, половина из которых являются фатальными [134]. Считают, что причиной этого является аспиринорезистентность (АР) – снижение чувствительности тромбоцитов к АСК.
Существенное клиническое значение АР подтверждено в ряде исследований и метаанализов. Еще в 1996 г. в исследовании CAPRIE было отмечено, что частота ССО у больных, перенесших ИМ и получающих АСК, достигает 10% в год [135]. В последующем во многих работах анализировался показатель неэффективности АСК, однако результаты очень варьировали, составляя от 2 до 43% [13].
В метаанализе (2016), по данным обследования 2930 пациентов с ССЗ, выявлено повышение риска развития сосудистых осложнений (ОР 2,95), смерти (ОР 5,99) и ОКС (ОР 4,06) у больных, являвшихся, по результатам исследований, нечувствительными к АСК [136].
Проливает свет на одну из возможных причин АР исследование Т. Grosser и соавт. [137, 138], в котором было выявлено влияние различных лекарственных форм АСК на агрегацию тромбоцитов (400 здоровых добровольцев в возрасте 18-55 лет). В этом исследовании критериями эффективности АСК были лабораторные показатели агрегации тромбоцитов, индуцированной АК, а также сывороточная концентрация метаболита ТхА2 – ТхВ2. Было установлено, что при тестировании этих параметров через 4 и 8 ч после приема желудочнорастворимого препарата эффективность желудочнорастворимой формы АСК отмечалась у 100% испытуемых; в случае же назначения препаратов кишечнорастворимой АСК в 49 и 17% случаев (через 4 и 8 час соответственно) отмечалась АР, которую авторы оценили как транзиторную.
В другом подобном исследовании сравнивали эффективность терапии АСК в желудочно- и кишечнорастворимой формах в дозе 75 мг/сут по концентрации сывороточного TхB2 у 244 пациентов с ССЗ.
Установлено, что у 19% из тех, которые «не отвечали» на лечение, АР удалось преодолеть при:
- замене кишечнорастворимой формы АСК на желудочнорастворимую;
- увеличении дозы до 150 мг/сут.
Было отмечено, что «не ответившие» пациенты имели более высокую массу тела, чем «ответившие» на терапию, что объясняют большим объемом распределения препарата у таких пациентов и, соответственно, созданием меньшей эффективной концентрации препарата [139], в связи с чем считают целесообразным использовать «простую» форму АСК в дозе 75 мг/сут у больных с массой до 120 кг и 150 мг/сут – при массе >120 кг [139], а также учитывать биодоступность кишечнорастворимых форм – их доза 75 мг эквивалентна дозе 50 мг желудочнорастворимой АСК [49].
Кроме фармакокинетических особенностей различных лекарственных форм АСК, среди возможных причин феномена АР выделяют [6] фармакодинамическое взаимодействие АСК с НПВП (в частности, с ибупрофеном); повышенный синтез тромбоксана А2, а также наличие нетромбоцитарных источников его синтеза (эндотелий, моноцитарная / макрофагальная ЦОГ‑2); экспрессия ЦОГ‑2 во вновь образующихся тромбоцитах; гидролиз АСК эстеразами слизистой оболочки желудочно-кишечного тракта; гиперлипидемия и генетические особенности пациента. Однако в настоящее время именно фармакокинетический механизм, связанный с замедленным или неполным всасыванием АСК из кишечнорастворимой формы, рассматривается многими исследователями как одна из ведущих причин АР [137].
Можно ли оценить наличие АР у конкретного пациента при назначении АСК?
В настоящее время в клинических и экспериментальных исследованиях используется мониторинг реакции на антитромбоцитарную терапию по оценке функции тромбоцитов, но, согласно консенсусу специалистов [140], рутинное измерение остаточной агрегации тромбоцитов для контроля за антиагрегантной терапией не рекомендуется в связи с тем, что диагностические критерии выявления резистентности к АСК не разработаны, к тому же, нет общего мнения относительно того, какой из методов и какие лабораторные показатели являются оптимальными для их использования в коррекции лечения АСК. В связи с этим, с нашей точки зрения, рационально использовать такие лекарственные формы АСК, которые имеют описанные выше преимущества.
Существует и другая сторона этой проблемы. Считают, что еще одна значимая причина АР – низкий комплаенс относительно АСК. В исследовании [141] показано, что 29% больных после ИМ имели АР, но большинство из них (57%) принимали АСК нерегулярно. Более того, только 60% пациентов, которым была назначена АСК, ее принимали. Это важно, поскольку исследования показали, что ускоренное восстановление функции тромбоцитов после прекращения их ингибирования АСК может выступать дополнительным фактором, изменяющим ответ тромбоцитов на патогенетическую терапию у больных, которые используют АСК для первичной и вторичной профилактики [142]. Последнее свидетельствует о необходимости беспрерывного применения назначенного препарата. Низкая приверженность к лечению способствует развитию осложнений: в исследовании Physicians’ Health Study (двойное слепое плацебо-контролируемое КИ, 22 000 тыс. врачей-мужчин, 5 лет наблюдения) АСК в соответствии с протоколом следовало принимать по 325 мг через день. В условиях строгого соблюдении графика приема препарата наблюдалось снижение риска развития нефатального ИМ на 44%, тогда как среди пациентов, принимавших лекарство менее чем в половине рекомендованных дней, снижение риска составило только 17% [5].
Учитывая вышесказанное, становятся понятными преимущества оптимизированных форм АСК, в частности, буферных с антацидными компонентами, особенности которых заключаются в меньшем количестве их побочных эффектов, что, в свою очередь, ведет к большему комплаенсу и уменьшению отказов от лечения [143].
Побочные эффекты АСК и их профилактика
Преимущества приема АСК при использовании по показаниям однозначно выше рисков, которые возникают при ее применении, о чем свидетельствуют данные многочисленных КИ, однако в каждом конкретном случае необходимо учитывать соотношение «польза – риск». Чаще всего имеют место диспептические расстройства, гастриты, язвы желудка и двенадцатиперстной кишки, острые колиты, внутричерепные кровоизлияния, появление гематом после травм, рецидивирующие носовые кровотечения. Описываются аллергические реакции, поражения респираторного тракта, в т. ч. аспириновая астма, и т. д. Метаанализ исследований по применению АСК показал, что ее прием ведет к увеличению риска желудочно-кишечных кровотечений или язвообразования в 3,5 раза [11].
Побочные эффекты со стороны желудочно-кишечного тракта особенно часто возникают при наличии факторов риска (язвенная болезнь желудка и двенадцатиперстной кишки в анамнезе, возраст >60 лет, прием глюкокортикоидов, антикоагулянтов, НПВП, Helicobacter pylori, почечная и печеночная недостаточность и др.). Наиболее часто они проявляются в виде изжоги, тошноты, рвоты, боли в эпигастрии, могут появляться у 25% больных и в 5-10% случаев являются причиной отмены АСК [144].
Нужно учитывать, что язвы при применении АСК могут быть бессимптомными: по данным многоцентрового эндоскопического исследования JUPITER, среди пациентов, принимавших в течение как минимум 28 дней АСК в дозе 75-325 мг/сут, язвы желудка и двенадцатиперстной кишки были выявлены у 11% пациентов, при этом только 20% из них имели симптомы диспепсии, а 80% случаев язвы были бессимптомными [145].
Наиболее опасными осложнениями при приеме АСК являются желудочно-кишечные кровотечения, частота развития которых имеет дозозависимый характер. По данным исследования CURE [146], при дозе <100 мг/сут жизненно опасные кровотечения наблюдались у 1,2% больных; при дозе от 100 до 161 мг/сут – у 1,7% и при дозе АСК >200 мг/сут – у 2,5% больных. Тем не менее для всех пациентов с высоким риском серьезных ССС абсолютная польза лечения достоверно превосходила абсолютный риск больших геморрагических осложнений [7].
В последнее время уделяется внимание недавно описанным поражениям тонкого и толстого кишечника, вызванным АСК и другими НПВП: это скрытые и явные кровотечения, перфорации, стриктуры, обострения хронических энтероколитов. Частота этих осложнений значительно меньше, чем в желудке и начальном отделе двенадцатиперстной кишки; тем не менее они также оказывают отрицательное влияние на комплаенс и, соответственно, показатели эффективности лечения АСК [147]. Поражения толстого кишечника при приеме НПВП бывают как в ранее неизмененной толстой кишке (острый колит, одиночные язвы-эрозии в слепой, ободочной, сигмовидной кишке), так и у пациентов с ранее измененным кишечником (перфорации при дивертикулезе, обострение хронических воспалительных процессов). Вопросы профилактики поражения слизистой нижних отделов желудочно-кишечного тракта при назначении АСК до конца не изучены.
Аспирин-индуцированное респираторное заболевание (aspirin-exacerbated respiratory disease, AERD, ранее – аспириновая астма) – один из первых побочных эффектов, зафиксированных для АСК. Уже через 3 года после появления первого препарата АСК – аспирина (в 1902 г.) D. Hirschberg (Польша) описал реакцию гиперчувствительности на его прием в виде выраженных нарушений дыхания и отека лица. Связь между гиперчувствительностью к АСК, бронхиальной астмой и полипозом носа была описана M. Widal и соавт. в 1922 г. Впоследствии было показано, что и другие НПВП могут вызывать сходные клинические проявления, однако частота гиперчувствительности к АСК и другим НПВП остается неизвестной [148].
Относительно недавно в литературе даже было предложено понятие «респираторное заболевание, индуцируемое НПВП» (nonsteroidal-anti-inflammatory drugs – NSAIDs-exacerbated respiratory disease, NERD), которое определяет патогенетические механизмы данного синдрома и выделяет НПВП как триггер развития этого заболевания. Синдром NERD относят к реакции гиперчувствительности, индуцируемой НПВП, проявляющейся бронхиальной обструкцией, одышкой, блокадой носа и/или ринореей [148].
Имеются данные о том, что непереносимость НПВП у больных с аспириновой триадой, повреждение эпителия и появление назального полипоза, а также хронического персистирующего воспаления в нижних дыхательных путях всегда развиваются на фоне хронического воспаления верхних и нижних дыхательных путей [149], при котором ведущую роль играет хроническая инфекция (вирусная и стафилококковая) [150].
Развитие NERD связывают с активацией метаболизма АК по липооксигеназному пути и повышенным образованием лейкотриенов – ЛТА4, а затем цис-ЛТ, которые способствуют расширению микрососудов и повышению их проницаемости, увеличению секреции слизи, затруднению носового дыхания, ринорее и приступообразному чиханию, а также имеют бронхоспазмогенное действие [151].
Побочные эффекты со стороны ССС. Одной из форм непереносимости АСК по типу аллергической реакции является синдром Коуниса (Кounis) – группа симптомов, которые проявляются в виде нестабильной вазоспастической стенокардии (даже как ОКС, в т. ч. ИМ) одновременно с аллергическими проявлениями и инициируются выходом медиаторов аллергии / воспаления вследствие аллергии на различные препараты, укусы животных и насекомых, даже на стенты с лекарственным покрытием и эндоваскулярные устройства [152]. Синдром Коуниса встречается нечасто, однако в большинстве случаев это потенциально летальное осложнение остается недиагностированным. Он может возникать во время острой аллергической реакции как у пациентов без поражения коронарных сосудов, так и при наличии подтвержденной ИБС и проявляется классическими признаками ОКС в сочетании с крапивницей, кожным зудом и респираторными симптомами [153]. Возможность индуцирования АСК (очень редко, чаще – в больших дозах) спазма коронарных артерий (синдром аллергической стенокардии) доказана [154].
Еще один побочный эффект АСК со стороны ССС – т. н. аспириновый парадокс. В исследовании PRISM PLUS при применении АСК при ОКС было обнаружено возрастание ССР: частота развития ИМ, рефрактерной стенокардии и внезапной смерти к 7-му дню наблюдения составляла 12,1% среди больных, не принимавших ранее АСК, и 23,5% – среди лиц, которые принимали АСК до развития обострения («аспириновый парадокс») [155], генез которого непонятен. Факт ухудшения ишемии миокарда на фоне АСК – важный клинический ориентир для оценки уровня последующего коронарного риска, поскольку является независимым от других важнейших параметров фактором, используемым для выделения больных высокого коронарного риска. По уровню собственной прогностической значимости факт развития обострения ИБС на фоне АСК имеет даже большее значение, чем традиционный предиктор высокого коронарного риска – смещение сегмента ST на ЭКГ. Наличие депрессии ST увеличивало вероятность смерти, ИМ и рефрактерной ишемии в среднем в 1,5 раза, а факт наличия «аспиринового парадокса» – в 1,74 раза [156].
Синдром Рея – острая реакция, возникающая у детей (чаще в возрасте 4-12 лет) на фоне лечения лихорадки вирусного происхождения АСК-содержащими препаратами и характеризующаяся быстро прогрессирующей гепатоэнцефалопатией. Синдром Рея сопровождается гипераммониемией, повышением уровня АСТ, АЛТ в сыворотке крови (>3 норм) при нормальном уровне билирубина, что обусловлено генерализованной митохондриальной дисфункцией у лиц с врожденными дефектами митохондриальных ферментов (не имевших клинических проявлений до развития данного состояния) [157]. Ингибирование окислительного фосфорилирования и бета-окисления длинноцепочечных жирных кислот приводит к их накоплению в ткани печени и формированию микровезикулярного стеатоза с последующим резким ухудшением прогноза жизни, в связи с чем АСК противопоказана у детей в возрасте до 15 лет [158].
Способы уменьшения побочных эффектов АСК
Наибольшее внимание всегда уделялось уменьшению побочных эффектов АСК со стороны желудка и двенадцатиперстной кишки.
Разработано несколько способов улучшения переносимости.
1. Высокоэффективный метод – использование АСК с ингибиторами протонной помпы (ИПП), что является целесообразным при наличии высокого риска желудочно-кишечных кровотечений (так, риск повторных желудочно-кишечных кровотечений на фоне терапии АСК у лиц с их предшествующим анамнезом составляет 15% в течение года [159]) или при двойной антиагрегантной терапии. Алгоритм профилактики этих осложнений представлен в рекомендациях Американской коллегии кардиологов по минимизации риска желудочно-кишечных кровотечений у пациентов, которым необходима антитромбоцитарная терапия (рис. 2) [36].
Рис. 2. Рекомендации Американской коллегии кардиологов по минимизации риска желудочно-кишечных кровотечений у пациентов, которым необходима антитромбоцитарная терапия [36, 160]
Примечание: ГЭРБ – гастроэзофагеальная рефлюксная болезнь.
В отношении тестирования на Helicobacter pylori: несмотря на то, что терапия АСК повышает риск гастродуоденальных осложнений (их риск увеличивается при наличии Helicobacter pylori), в целом риск скорее низкий, поэтому рутинное направление на анализ на Helicobacter pylori и последующее проведение эрадикации по медицинским и экономическим соображениям не оправдано, а также не является универсальной рекомендацией, а зависит от наличия факторов риска! (В, уровень доказательности 1b) [161]. Авторы Маастрихтского консенсуса рекомендуют тестировать на Helicobacter pylori-инфекцию пациентов, принимающих НПВП и АСК, с наличием в анамнезе пептической язвы, а также обязательно рекомендовать им прием ИПП, при выявлении бактерии – антихеликобактерную терапию (Маастрихт‑5, 2015) [162].
Согласно метаанализу 13 исследований, в которых использовались низкие дозы АСК и ИПП для профилактики осложнений со стороны желудочно-кишечного тракта, совместное назначение ИПП и АСК снижало риск эрозивно-язвенных поражений желудочно-кишечного тракта на 75% [163]. В качестве дополнительного средства повышения безопасности лечения АСК для больных высокого риска рассматривают терапию минимально эффективными дозами АСК (75 мг/сут).
2. Для больных с факторами риска повреждения желудочно-кишечного тракта очень важен выбор безопасной формы АСК. С этой целью были разработаны кишечнорастворимые формы АСК и АСК с адъювантами-антацидами (буферные формы с гидроксидом магния). В первом случае основной целью является предотвращение контакта АСК со стенкой желудка (всасывание препарата происходит в тонком кишечнике), а во втором – защита гидроксидом магния слизистой оболочки желудочно-кишечного тракта (вследствие нейтрализации соляной кислоты) от воздействия АСК и HCl (при отсутствии влияния на всасывание самой АСК). Более высокая безопасность применения новых форм АСК, по сравнению с «простыми» формами, была подтверждена в КИ с использованием гастроскопии [147, 164].
Исследования, посвященные прямому сравнению безопасности этих двух «безопасных» форм АСК (кишечнорастворимых и буферных), немногочисленны и противоречивы. В некоторых из них показана равноценность лекарственных форм, например, в ретроспективном исследовании M. Takada и соавт. (2004) [165], а также в работах [166-168], где было показано, что кишечнорастворимые и буферные формы АСК существенно не различаются по безопасности применения в плане желудочно-кишечных осложнений. Подобные результаты были получены Kelley и соавт. (1996) [169], которые изучали риск кровотечений из верхних отделов желудочно-кишечного тракта, ассоциированный с приемом различных форм АСК в течение предшествующих 7 дней (550 больных с подтвержденным желудочно-кишечным кровотечением vs 1202 здоровых лиц). ОР кровотечений во время применения АСК в дозах ≤325мг/сут составил 2,6 для желудочнорастворимых форм и 2,7 для форм с кишечнорастворимой оболочкой, что объясняется, вероятно, механизмом развития повреждения слизистой: это в большей степени результат системных эффектов АСК, а не местного повреждающего действия АСК.
В других исследованиях [170, 171] был показан более низкий риск повреждений желудочно-кишечного тракта на фоне приема буферных форм АСК, чем при использовании кишечнорастворимых препаратов. В качестве примера можно привести исследование Э. П. Яковенко и соавт. (2013) по влиянию различных лекарственных форм на слизистую оболочку желудка [40]. В рамках исследования проводилась профилактическая терапия у пациентов с ИБС с высоким риском развития гастропатии антитромбоцитарными препаратами, содержащими АСК: АСК в кишечнорастворимой форме, а также АСК + оксид магния в дозах 150 мг/сут (100 человек в каждой группе, 12 нед терапии). Пациенты в обеих группах были сопоставимы по значению рН желудочного содержимого. Безопасность лечения оценивалась по развитию и динамике симптомов диспепсии и эндоскопической картины НПВП-гастропатии. При равной клинической эффективности эрозивные поражения слизистой оболочки желудка и двенадцатиперстной кишки отмечались у 23% больных в группе АСК с гидроксидом магния и у 65% пациентов, получавших кишечнорастворимую АСК без гидроксида магния.
Существуют, однако, и альтернативные данные о том, что буферные формы не обеспечивают значимого снижения частоты желудочно-кишечных побочных явлений [168], а преимущества в плане развития эрозий желудка имеют кишечнорастворимые формы [172], однако в систематическом обзоре, оценивавшем результаты КИ по влиянию различных форм АСК на слизистую желудка, D. W. Banoob и соавт. пришли к заключению, что для подтверждения большей безопасности кишечнорастворимых форм АСК необходимы дальнейшие исследования [173].
Важный вопрос – продолжать ли прием АСК, если было кровотечение на ее фоне? При поиске ответа на него нужно учитывать данные исследования, в котором было показано, что через 1-2 нед после прекращения приема АСК для вторичной профилактики кардиоваскулярный риск возрастал, а пациенты, которые возобновили прием АСК, не имели повышения риска кровотечения по сравнению с не получавшими АСК, однако среди них наблюдалась значительно более низкая смертность в течение 1 мес (1 против 9%) и 8 нед (1 против 13%). Пациенты с язвенным кровотечением, получавшие низкие дозы АСК для вторичной профилактики, могут продолжить применение АСК через 1-7 дней после остановки кровотечения [174]!, но для уменьшения риска повторного кровотечения как котерапию необходимо использовать ИПП. Комбинированная терапия АСК + ИПП после остановки кровотечения более рациональна, чем переход на клопидогрель (А, уровень доказательности 1b) [161]. В этом плане очень показательно исследование Chаn и соавт. (2005), в котором 320 больным с перенесенным кровотечением из верхних отделов желудочно-кишечного тракта после заживления язв и эрадикации Helicobacter pylori был назначен клопидогрель 75 мг/сут либо возобновлена терапия АСК (АСК 80 мг/сут + эзомепразол 20 мг/сут). Вероятность повторного кровотечения на протяжении 12 мес приема составляла: у тех, кто получал комбинацию АСК с эзомепразолом, – 0,7%, у получавших клопидогрель – 8,6% (в 12 раз выше!) [26, 175].
Комбинированная терапия с АСК
Для лечения больных с ИБС и мультифокальным атеросклерозом часто требуется сочетание антитромбоцитарных и антитромботических препаратов для предупреждения развития тромбоза вследствие активации тромбоцитов и системы коагуляции. Используется двойная антиагрегантная терапия (АСК в сочетании с клопидогрелем, тикагрелором или прасугрелем) и тройная антиагрегантная терапия (с включением антикоагулянта при наличии соответствующих показаний). Выбор, время начала и продолжительность антитромботических мероприятий при реваскуляризации миокарда зависят от клинической ситуации (плановое, острое или экстренное вмешательство) [176].
В исследовании CURE (2001, 12 562 больных с ОКС без подъема сегмента ST) [146] было показано, что назначение комбинации клопидогреля с АСК в течение 3-12 мес (в среднем – 9 мес) позволяет снизить кумулятивный риск развития сердечно-сосудистой смерти, ИМ и инсульта на 20% по сравнению с монотерапией АСК. Различия в группах по частоте исходов начали проявляться уже через 2 ч от начала лечения, что связано с использованием однократной нагрузочной дозы клопидогреля в 300 мг, т. к. известно, что в обычной дозе (75 мг/сут) оптимальный антитромбоцитарный эффект клопидогреля достигается только через несколько дней, при этом нужно учитывать, что количество серьезных геморрагических осложнений в группе комбинированной антитромбоцитарной терапии было больше, чем при монотерапии АСК (3,7 и 2,7% соответственно), однако статистически достоверной разницы по числу угрожающих жизни геморрагий не отмечено – 2,1 и 1,8%. Риск кровотечений зависел от дозы АСК в комбинации с клопидогрелем и был выше при приеме АСК в дозе >200 мг, чем при дозе <100 мг/сут (3,9 и 1,9% соответственно) [177].
Результаты другого КИ (III фаза THEMIS) показали, что использование комбинации тикагрелора и АСК также приводило к статистически значимому снижению частоты больших ССС в сравнении с монотерапией АСК. Это большое многоцентровое исследование, в котором изучалась степень влияния на ССР у больных, имеющих ИБС и СД при назначении двойной дезагрегантной терапии, включающей АСК и тикагрелор в низких дозировках, что позволило к 36-ти мес наблюдения получить расхождение по первичной конечной точке и снижение ССР на 10% [178].
При необходимости усиления терапии АСК у больных с различными проявлениями атеротромбоза (помимо комбинированной терапии с тиенопиридинами) используют ингибиторы IIb-IIIa рецепторов тромбоцитов для внутривенного применения (абциксимаб и др.), непрямые антикоагулянты (варфарин), новые оральные антикоагулянты, ингибирующие каскад коагуляции на разных этапах [179].
В 2002 г. были опубликованы результаты РКИ WARIS II [180], целью которого было сравнительное изучение АСК (160 мг), варфарина (дозы под контролем международного нормализованного отношения, МНО) и комбинации АСК 75 мг + варфарин у больных, перенесших ОКС (n=3630, срок наблюдения – 4 года). Средний уровень МНО за период наблюдения в группе монотерапии варфарином составил 2,8, в группе АСК + варфарин – 2,2. Снижение ОР ССС в группе варфарина по сравнению с группой АСК составило 19%, а в группе комбинированной терапии по сравнению с группой монотерапии АСК был равен 29%. Таким образом, наилучшие результаты в отношении влияния на частоту конечных точек были достигнуты в группе больных, получавших АСК в дозе 75 мг/сут в комбинации с варфарином. Потребность в реваскуляризации миокарда, а также смертность в сравниваемых группах были практически одинаковыми. Частота серьезных геморрагий в группах АСК, варфарина, АСК + варфарин составила 0,15/0,58/0,52% соответственно (в год), что было меньше, чем в исследовании CURE при использовании комбинации с клопидогрелем.
Подобные доказательства большей эффективности и относительной безопасности варфарина либо комбинации варфарина с АСК перед монотерапией АСК у больных, перенесших ОКС, были продемонстрированы также в исследованиях ASPECT‑2, APRICOT‑2 и OASIS‑2 [181]; в исследовании ТРТ, напротив, при снижении риска коронарных событий наблюдали увеличение фатальных и нефатальных геморрагических инсультов и кровотечений (по сравнению с монотерапией варфарином или АСК).
Новыми данными, подтвердившими эффективность АСК у пациентов с заболеваниями, связанными с атеросклерозом (стабильное течение ИБС и/или атеросклероза периферических артерий), стали результаты плацебо-контролируемого исследования III фазы COMPASS [182]. Пациенты в исследовании были рандомизированы для получения либо ривароксабана 2,5 мг 2 р/сут в дополнение к приему АСК 100 мг/сут, либо только ривароксабана 5 мг 2 р/сут, либо только АСК 100 мг 1 р/сут (3 группы). В группе пациентов, принимающих только ривароксабан по 5 мг 2 р/сут (по сравнению с группой монотерапии АСК), не наблюдалось значимых различий в частоте развития оцениваемых ССС, однако достоверно увеличилось общее число случаев кровотечения; в группе получавших комбинацию ривароксабан 2,5 мг 2 р/сут + АСК на 24% был ниже риск развития событий первичной конечной точки по сравнению с группой принимавших только АСК.
АСК и другие препараты: усиливает, ослабляет?
При коморбидной патологии, как правило, применяются одновременно препараты различных групп, которые могут взаимодействовать между собой, снижая активность друг друга. Проанализируем несколько таких клинически значимых сочетаний.
АСК и ИАПФ. В метаанализе результатов рандомизированных исследований у 96 000 больных ИМ [183] и при лечении >20 000 больных в исследовании [184] не было обнаружено ослабления эффекта ИАПФ и других гипотензивных препаратов при одновременном применении АСК как представителя НПВП.
АСК и НПВП. При добавлении других НПВП к антитромботическим препаратам риски осложнений возрастают. Так, при совместном применении НПВП с АСК риск ССО возрастает на 46%, с клопидогрелем – на 75%. Наиболее высокий риск отмечен при применении комбинации оральных антикоагулянтов и неселективного ЦОГ‑1 и ЦОГ‑2-ингибитора диклофенака [185].
Важным достоинством селективного блокатора ЦОГ‑2 целекоксиба является большая безопасность в плане развития поражений желудочно-кишечного тракта при сочетанном использовании его с низкими дозами АСК, используемыми для профилактики сосудистых тромбозов. В качестве доказательства можно привести результаты плацебо-контролируемого РКИ, проведенного J. Goldstein и соавт. (2006) на 662 добровольцах (возраст 50-75 лет), у которых при ЭГДС не было выявлено язвы или >5 эрозий желудка и/или двенадцатиперстной кишки, не инфицированных Helicobacter pylori и не принимавших низкие дозы АСК или другие НПВП до включения в исследование. Все участники получали АСК 81 мг/сут в сочетании с целекоксибом 200 мг/сут, или с напроксеном 500 мг 2 р/сут, или с плацебо. Через 7 дней всем участникам была проведена ЭГДС, показавшая, что частота язв желудка и двенадцатиперстной кишки на фоне приема комбинации целекоксиб + АСК была более чем в 4 раза меньше, чем при использовании неселективного препарата напроксена с АСК [186].
Известно, что сочетанное применение НПВП и АСК является фактором риска развития повреждений желудочно-кишечного тракта. Тем не менее, согласно рекомендациям EULAR, у пациентов с риском ССО для снижения риска тромботических ССО рекомендовано использование НПВП (как селективных, так и неселективных) совместно с низкими дозами АСК, поскольку риски ССС у таких больных имеют большую значимость. Исключение составляют комбинации АСК + ибупрофен, или напроксен, или индометацин, при использовании которых снижаются кардиозащитные свойства АСК [187] и несколько повышается риск коронарных событий [188]. Этот факт взаимодействия объясняют конкурентными взаимоотношениями ибупрофена и АСК за место связывания с молекулой ЦОГ‑1, в результате чего ибупрофен нивелирует антитромбоцитарные эффекты АСК. Клинически это было подтверждено в одном из исследований особенностей взаимодействия НПВП с АСК, проведенном с использованием базы данных California Medicare (1999-2004), где было установлено, что применение АСК снижает риск развития ИМ при лечении рофекоксибом (ОР 1,31 vs 1,03), целекоксибом (ОР 1,12 vs 0,88), а также мелоксикамом (ОР 1,52 vs 0,53), при этом практически не снижался риск развития ИМ у лиц, принимавших индометацин (ОР 1,65 vs 1,21), ибупрофен (ОР 1,08 vs 1,20) [187].
АСК и COVID‑19
Использование АСК (как и других НПВП) у пациентов с COVID‑19 является предметом дискуссий, однако основные научные общества и регулирующие органы по всему миру подготовили рекомендательные документы, чтобы воспрепятствовать отказу от НПВП либо прекращению их применения при COVID‑19 [189-191], оценивая ситуацию с осторожностью в свете соотношения «польза – риск». Так, пациенты с COVID‑19, принимающие АСК в низких дозах для вторичной профилактики ССЗ, должны продолжать лечение [192]; также во время пандемии COVID‑19 необходимо постоянное профилактическое применение АСК по показаниям беременными [98], поскольку в настоящее время нет доказательств того, что низкие дозы АСК у беременных с COVID‑19 или у пациентов с COVID‑19 с высоким / очень высоким ССР связаны с повышенным риском кровотечения [193]. В настоящее время проводится ряд наблюдательных и интервенционных исследований, изучающих эффективность и безопасность АСК в различных дозах при COVID‑19.
В базе PubMed имеется >220 исследований, посвященных применению АСК при COVID‑19. Интерес к этому вопросу объясняется двумя факторами. С одной стороны, важным звеном патогенеза COVID‑19 является развитие тромбовоспаления, с другой стороны, АСК (помимо антиагрегантного) имеет другие эффекты, которые могут иметь значение в терапии COVID‑19: противовоспалительное, противовирусное и др.
Тромбовоспаление при COVID‑19. Установлено, что вирус SARS-CoV‑2 может (наряду со чрезмерной активацией каскадов местного и системного воспаления) способствовать прогрессирующему состоянию гиперкоагуляции и агрегации тромбоцитов, что ведет к тромботическим явлениям микро- и макрососудов [194]. Этот последний дуэт патологических событий, вызванных вирусной инфекцией, формирует т. н. состояние тромбовоспаления (рис. 3), которое наблюдалось и при других вирусных и невирусных инфекциях [195].
Рис. 3. Механизмы развития тромбовоспаления при COVID‑19 [193]
Прогрессирующий эндотелиальный тромбовоспалительный синдром может затрагивать микрососудистое русло мозга и других жизненно важных органов, что приводит к полиорганной недостаточности и смерти [196].
С учетом сложного механизма развития тромбовоспаления при COVID‑19 особенно интересными представляются плейотропные эффекты АСК.
Противовирусная активность АСК [193]. Результаты изучения противовирусной активности АСК получены in vitro и в многочисленных экспериментальных исследованиях. Приведем несколько фактов. Противовирусное действие АСК задокументировано как в отношении различных ДНК-, так и РНК-вирусов. Имеется целый ряд механизмов этого эффекта. Препарат снижает индуцированную цитомегаловирусом продукцию активных форм кислорода и активацию NF-κB, что приводит к ингибированию репликации вируса в гладкомышечных клетках; высокие дозы АСК способны частично обратимо снижать репликацию вируса ветряной оспы; АСК стимулирует сверхэкспрессию белков, которые ответственны за ингибирование репликации вируса гепатита C (ВГС). Другое исследование показало, что АСК может снижать патогенные эффекты ВГС за счет подавления клеточного окислительного стресса и повышения активности супероксиддисмутазы в инфицированных клетках. Кроме того, АСК продемонстрировала дозозависимую противовирусную активность против вирусов гриппа A (H1N1), риновируса человека и вируса Коксаки, причем этот эффект наблюдался при нецитотоксических дозах АСК. Положительные эффекты АСК против вируса гриппа частично объясняются ингибированием активности PGE2 в макрофагах и последующим усилением выработки интерферона-I, что приводит к ограничению репликации вируса и способствует развитию T-клеточного иммунного ответа.
Кроме того, ранее были получены интересные клинические данные об улучшении при использовании АСК выживаемости пациентов с различными типами вирусных инфекций, причем последние состояния также характеризовались гиперактивацией каскада воспаления и повышенной реактивностью тромбоцитов [197-202], а также данные о снижении риска явного ДВС-синдрома в ретроспективном исследовании с участием 390 пациентов с септическим шоком из отделений интенсивной терапии, которые получали антиагрегантную терапию до госпитализации [203].
С этими данными четко коррелируют результаты, полученные в исследовании [204], в котором оценивали тяжесть течения COVID‑19 у госпитализированных больных, использовавших АСК в течение 7 дней до госпитализации или на протяжении 24 час после нее. У таких больных потребность в ИВЛ снижалась на 44%, частота случаев госпитализации в блок интенсивной терапии – на 43%, внутрибольничная смертность уменьшалась на 47%!
Дети и подростки не должны принимать АСК из-за риска того, что она может вызвать опасное для жизни состояние, называемое синдромом Рея [157, 158, 205].
Антикоагулянтные эффекты АСК особенно полезны при венозных тромбозах. В дополнение к способности АСК предотвращать артериальные тромбоэмболические события есть свидетельства того, что АСК может также уменьшать венозную тромбоэмболию (ВТЭ). В этом отношении результаты исследований комбинации варфарин + АСК (WARFASA) и монотерапии АСК для предотвращения рецидивирующей ВТЭ (ASPIRE) показали, что у пациентов с первой неспровоцированной ВТЭ после отмены варфарина АСК снижала риск тромботических событий (рецидивов) на 32% [206]. При анализе объединенных результатов исследований ASPIRE и WARFASA было четко продемонстрировано статистически значимое снижение частоты ВТЭ и частоты достижения композитной конечной точки (ВТЭ + ИМ + ИИ + кардиоваскулярная смерть) у пациентов, получавших АСК для вторичной профилактики ВТЭ, по сравнению с плацебо [207]. Недавний метаанализ 13 РКИ показал, что эффективность АСК для профилактики ВТЭ у пациентов, перенесших полную замену тазобедренного сустава или замену коленного сустава, не отличалась от эффективности антикоагулянтов [208].
С целью объяснения антитромботических эффектов, опосредованных АСК, были предложены механизмы, альтернативные ингибированию ЦОГ, включая способность АСК вызывать ацетилирование белков, участвующих в каскаде свертывания (например, фибриногена), тем самым способствуя фибринолизу [209].
АСК в международных и украинских рекомендациях по COVID‑19
В настоящее время запланированы хорошо организованные крупные КИ по эффективности АСК в лечении COVID‑19, которые находятся на стадии проведения исследований; при составлении же существующих рекомендаций учитывались КИ разной степени организации.
В Украине существуют постоянно обновляющаяся «Жива» клінічна настанова» (2021) [210] и также регулярно обновляемый протокол лечения COVID‑19 «Надання медичної допомоги для лікування коронавірусної хвороби (COVID‑19)» [211]. При создании «Живої» клінічної настанови» были учтены клинические рекомендации, использованные при создании протокола, в т. ч. руководства ВОЗ, Великобритании, Бельгии, США и Австралии. Как отмечают авторы «Живої» клінічної настанови», она является информационным сопровождением лучшей медицинской практики лечения COVID‑19 и не должна расцениваться как стандарт лечения; в ней АСК включена в рекомендации по лечению заболевания в его легкой форме, когда больные находятся на амбулаторном лечении: рекомендовано применение АСК в интервале доз 81-325 мг (наряду с аскорбиновой кислотой, витамином D, комплексом витаминов группы В, цинком, мелатонином и ивермектином).
Подобные рекомендации приведены в обновляемом американском протоколе EVMS [212], в соответствии с которым применение АСК симптомным амбулаторным больным рекомендуется (с учетом противопоказаний) в дозе 325 мг в сочетании с аскорбиновой кислотой, витамином D, флавоноидами, цинком, мелатонином, а также ивермектином.
Магникор: качественный украинский генерик АСК
В настоящее время на фармацевтическом рынке Украины присутствуют ≈30 представителей препаратов АСК в дозах, применяемых как антиагрегантные (75-300 мг). Одним из наиболее популярных из них, занимающим лидирующее место по продажам в Украине (по данным аптечных месячных продаж за 9 мес 2021 г., база Proxima Research, Morion), является генерик АСК Магникор – препарат АО «Киевский витаминный завод», который, как и другие препараты АСК, служит средством первичной и вторичной профилактики сердечно-сосудистых катастроф и входит в стандарты лечения ССЗ при наличии у больного соответствующих показаний.
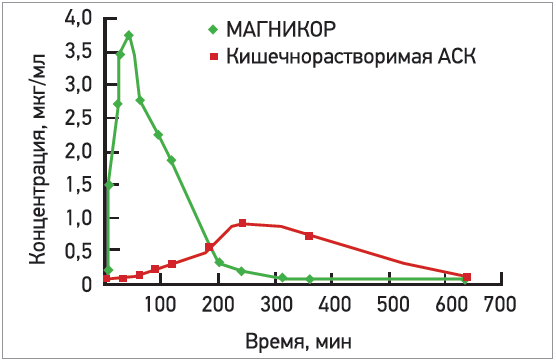
В производстве Магникора используется субстанция производства Франции. Он выпускается в желудочнорастворимой оболочке, что обеспечивает, во‑первых, существенно более быстрое (в течение 40-60 мин) всасывание уже в желудке и создание в разы более высокой пиковой концентрации АСК (рис. 4) вследствие низкой ионизации АСК в кислой среде желудка и более слабой инактивации ее в кишечнике, во‑вторых, при применении желудочнорастворимой АСК клинический эффект наступает быстрее: антиагрегантное действие кишечнорастворимой АСК развивается после как минимум 1 нед лечения и приема в дозах >75 мг (81-100 мг); у желудочнорастворимой же формы – уже после первого приема 75 мг АСК [36].
Рис. 4. Особенности фармакокинетики АСК в зависимости от ее лекарственной формы [137, 213]
При этом с целью достижения желаемого эффекта Магникор можно назначать в несколько меньших дозах, чем кишечнорастворимую АСК. С учетом различий во всасывании и метаболизме доза АСК в желудочнорастворимой форме 50 мг соответствует 75 мг АСК в кишечнорастворимой [137], т. е. доза Магникора 75 мг не только сопоставима со 100 мг кишечнорастворимой АСК, но и превышает ее по расчетной активности (эквивалентная доза кишечнорастворимой АСК – 112,5 мг).
Магникор имеет две дозировки: 75 мг (Магникор) и 150 мг (Магникор форте), что позволяет подобрать дозу препарата с учетом особенностей статуса конкретного больного. Дополнительным преимуществом Магникора перед другими препаратами АСК является наличие (в качестве вспомогательного вещества) антацида магния гидроксида, что обеспечивает препарату, как отмечалось выше, большую безопасность применения по сравнению с другими лекарственными формами АСК.
Выпускается препарат в блистерной упаковке, что обеспечивает хорошую индивидуальную защиту каждой таблетки от воздействия влаги и микробной контаминации. Наличие больших упаковок (100 таблеток) настраивает больных на длительный непрерывный прием препарата. Магникор входит в программу «Доступні ліки» (при приобретении Магникор форте – нулевая доплата), что делает его еще более востребованным и улучшает комплаенс больных.
Выводы
Антиагрегантная терапия является ведущим способом первичной и вторичной профилактики кардиоваскулярных осложнений и смерти в результате тромбоза.
Благодаря убедительной доказательной базе АСК входит в международные и украинские стандарты профилактики и лечения при заболеваниях и поражениях сердечно-сосудистой системы (нестабильная стенокардия, ХКС, СД, гипертоническая болезнь и т. д.).
Магникор имеет преимущества желудочнорастворимой формы АСК: быстрое и хорошее всасывание в желудке, соответственно – более быстрое начало антиагрегантного действия (через 60 мин), более прогнозируемый антитромботический эффект, сопровождающийся благоприятным защитным действием на слизистую желудка адъювантного компонента с антацидной активностью магния гидроксида.
Магникор (как генерический препарат АСК) может быть выбран благодаря его качеству, эффективности, безопасности и экономической доступности.
Список литературы находится в редакции.



.png)