29 грудня, 2016
Сравнение эффективности и безопасности двух режимов ступенчатой терапии системными кортикостероидами при обострениях бронхиальной астмы

Обострение бронхиальной астмы (БА) – одна из частых причин обращения за неотложной медицинской помощью во всем мире. В США ежегодно с этим состоянием в отделения неотложной помощи поступают примерно 1,8 млн пациентов, из них до 500 тыс. госпитализируются (Aggarwal P. et al., 2006). В первые часы обострения важно добиться быстрого улучшения функции легких, для чего применяется терапия системными кортикостероидами (СКС).
Глобальная инициатива по борьбе с бронхиальной астмой (GINA) рекомендует раннее внутривенное назначение СКС госпитализированным пациентам с переходом к пероральному их приему коротким курсом после выписки.
Доказано, что СКС при относительной безопасности сокращают длительность пребывания в стационаре, уменьшают риск повторных обострений БА и потребность в скоропомощных ингаляционных препаратах (Rowe B.H. et al., 2002; Fiel S.B. et al., 2006). В большинстве исследований у пациентов с обострениями астмы применялась ступенчатая терапия метилпреднизолоном: внутривенно в первые дни, затем перорально от 1 до 8 нед. В некоторых странах на практике также применяется более дешевая схема с внутривенным введением гидрокортизона и последующим пероральным приемом преднизолона. Остается открытым вопрос, какой из вариантов терапии СКС эффективнее и безопаснее. Сравнительных исследований СКС у пациентов с обострениями астмы проведено очень мало, а их результаты противоречивы. Индийские ученые P. Aggarwal, S. Bhoi провели пилотное сравнительное исследование эффективности и безопасности ступенчатой терапии метилпреднизолоном и схемы с гидрокортизоном и преднизолоном при обострении БА.
Материал и методы исследования
Рандомизированное исследование с односто ронним ослеплением проводилось в течение 6 мес (с июня по ноябрь 2008 г.) в отделении неотложной помощи больницы третичного уровня в Северной Индии. Пациенты не знали о том, какой СКС им вводили внутривенно, но пероральный курс терапии был открытым. Включали больных в возрасте 13-60 лет, поступавших в отделение с обострением БА средней тяжести (пиковая скорость выдоха (ПСВ) 50-70% от должной, оценка по шкале астма-счета 8-11) или тяжелым обострением (ПСВ <50% от должной, астма-счет 12-15). Исключалось участие пациентов с легким обострением БА (ПСВ >70% от должной, астма-счет 5-7), температурой тела >38°C, пневмонией, интерстициальными заболеваниями легких, застойной сердечной недостаточностью, а также принимавших СКС в течение последних 30 дней и требующих искусственной вентиляции легких (ИВЛ) в течение часа после поступления в отделение неотложной помощи.
Кроме обычного физикального обследования и лабораторных тестов при поступлении, через 1, 3 и затем каждые 6 ч до момента выписки и через две недели после выписки у пациентов измеряли ПСВ и объем форсированного выдоха за секунду (ОФВ1) при помощи электронного пикфлоуметра Piko®-I (Ferraris Respiratory Europe Ltd., Великобритания).
Отобранных по критериям включения и исключения пациентов рандомизировали на две группы.
Группа А – 200 мг гидрокортизона внутривенно через каждые 6 ч до выписки, затем преднизолон перорально по 0,75 мг/кг массы тела ежедневно в течение 2 нед.
Группа Б – 125 мг метилпреднизолона внутривенно болюсно однократно (Солу-медрол®, Pfizer), затем по 40 мг внутривенно через каждые 6 ч до выписки, затем по 0,6 мг/кг метилпреднизолона перорально (Медрол®, Pfizer) в течение двух недель.
В обеих группах пациенты при поступлении также получали небулайзерную терапию: ипратропий 250 мкг + сальбутамол 2,5 мг, после чего в зависимости от индивидуального ответа подбирались дозы бронходилататоров для дальнейшей терапии. При необходимости лечащие врачи могли назначать и другие препараты, кроме СКС, а также кислородотерапию.
Решение о выписке пациентов принимали лечащие врачи, обычно, когда ПСВ достигала >65% от должной. Через две недели после выписки пациенты приходили на контрольное обследование, во время которого врачи измеряли параметры внешнего дыхания и собирали жалобы о побочных эффектах.
Первичной конечной точкой служила терапевтическая неудача, под которой следовало понимать любой из следующих исходов: возникшая необходимость в проведении ИВЛ, продлении госпитализации, смерть в течение двух недель от поступления, повторное поступление с обострением астмы в течение двух недель после выписки, назначенное врачом усиление терапии от момента выписки до контрольного визита через две недели.
Вторичными конечными точками были динамика ОФВ1 и ПСВ за время пребывания пациента в отделении и в течение двух недель амбулаторной терапии, динамика астма-счета за две недели амбулаторной терапии, длительность пребывания в отделении неотложной терапии или в стационаре. Кроме того, в обеих группах регистрировались все побочные эффекты.
Результаты
Всего было отобрано и рандомизировано 100 пациентов. По разным причинам 6 пациентов выбыли из исследования в течение первого часа после рандомизации. В анализы эффективности и безопасности включили данные 94 участников: 49 из группы А и 45 – Б. Группы были хорошо сбалансированы по возрастному и гендерному составу пациентов (средний возраст 45 лет, незначительно преобладали мужчины), длительности БА (в среднем 12 и 13,7 года в группах А и Б соответственно) и текущего эпизода обострения (в среднем 1,9 дня в обеих группах), стажу курения (8,2 и 8,9% в группах А и Б соответственно), поддерживающей медикаментозной терапии до поступления, клиническим проявлениям обострения БА и астма-счету на момент поступления (12,1 и 12,4 в группах А и Б соответственно). Исходные показатели спирометрии также достоверно не различались между группами: ПСВ в среднем 70,7 и 67,9 л/мин в группах А и Б соответственно; ОФВ1 в среднем 0,5 л в обеих группах.
Среднее время пребывания в отделении неотложной помощи составило 10,2±6,49 ч в группе А и 8,9±5,99 ч в группе Б, без статистически достоверных различий между группами. Один пациент из группы А был впоследствии госпитализирован. Группы не различались достоверно по потребности пациентов в дополнительных дозах небулайзерной терапии в первые 6 ч, а также по использованию других медикаментов (пероральных бронходилататоров, антибиотиков).
После курса лечения показатели частоты дыхания, ПСВ, ОФВ1 и астма-счет достоверно улучшились в обеих группах по сравнению с исходными.
За первые 6 ч пребывания в отделении неотложной помощи у пациентов обеих групп достоверно улучшился показатель ПСВ (р<0,0001 по сравнению с исходным). В группе А средняя ПСВ через 6 ч составила 160,0±40,44 л/мин, в группе Б – 167,6±33,39 л/мин, без статистически достоверной разницы между группами. Средние значения ОФВ1 также не различались между группами через 1, 3 и 6 ч пребывания в отделении неотложной помощи.
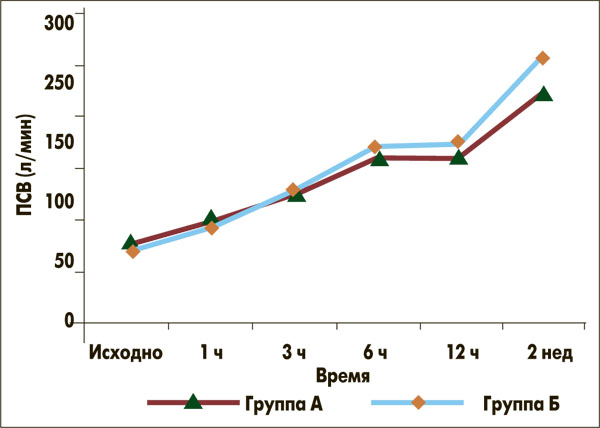
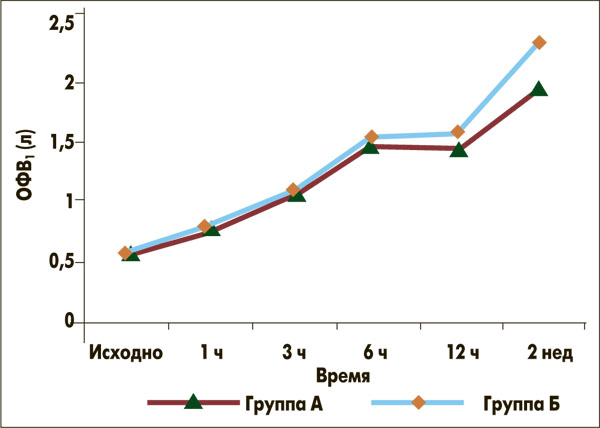
Разница прироста ПСВ и ОФВ1 между группами не достигала достоверности на момент выписки из отделения. Однако достоверные различия прироста ПСВ и ОФВ1 были получены через две недели наблюдения: ПСВ выросла на 189,7 л/мин в группе Б против 152,1 л/мин в группе А (р<0,001), ОФВ1 вырос на 1,8 л против 1,4 л соответственно (p<0,001) (рис. 1, 2).
Исходные показатели гликемии составляли в среднем 98,2±12,06 мг/дл в группе А и 113,6±20,51 мг/дл – в группе Б (p<0,0001). Через две недели терапии этот показатель больше вырос в группе А (135,0±28,01 мг/дл), чем в группе Б (122,2±12,55 мг/дл, p<0,0001).
Диастолическое артериальное давление в группе А достоверно выросло с 78,7±7,14 до 83,5±6,22 мм рт. ст. (p<0,0001). В группе Б этот показатель, наоборот, уменьшился с 128,3±18,98 до 123,6±9,2 мм рт. ст. (p=0,032).
Два пациента из группы А (4,17%) в течение двух недель повторно обратились с обострением БА. Одному пациенту из этой же группы потребовалось проведение ИВЛ, он умер через двое суток после поступления.
За две недели наблюдения были отмечены следующие побочные эффекты: абдоминальный дискомфорт и запор у двух пациентов группы А (8,33%); жгучая боль в эпигастрии у двух пациентов группы А (8,33%) и у одного пациента группы Б (2,22%); отечность лица у 7 пациентов группы А (14,58%) и у 3 пациентов группы Б (6,67%).
Обсуждение и выводы
Предыдущие исследования, посвященные выбору СКС для терапии обострений БА, дали неоднозначные результаты. Sue M.A. et al. (1986) сравнивали гидрокортизон (100 мг внутривенно через каждые 6 ч), метилпреднизолон (20 мг внутривенно через каждые 6 ч) и дексаметазон (3,75 мг внутривенно через каждые 6 ч) и не обнаружили достоверных различий эффективности в первые 3 сут терапии. В исследовании Hall С.М. et al. (1996) гидрокортизон оказался эффективнее метилпреднизолона по критерию длительности пребывания в стационаре пациентов с тяжелыми обострениями астмы. Однако дозирование было не равнозначным: гидрокортизон назначался в дозе 200 мг внутривенно через каждые 4 ч, а метилпреднизолон – по 125 мг внутривенно каждые 12 ч. Ни в одном исследовании не сравнивались ступенчатые схемы терапии разными СКС (внутривенные инфузии, затем прием таблеток), что является рекомендованным подходом.
В данном исследовании функция легких значительно улучшилась уже через несколько часов от начала внутривенных инфузий СКС в обеих группах. Однако за первые 6 ч пребывания в отделении неотложной помощи состояние больных не различалось статистически достоверно между группами. Длительность пребывания в стационаре пациентов, которые в комплексной терапии получали метилпреднизолон, была меньше, чем пациентов, получавших гидрокортизон. Но эта разница была не достоверна. Через две недели амбулаторного этапа исследования улучшение показателей спирометрии было достоверно более выраженным на фоне перорального приема метилпреднизолона по сравнению с пациентами, которые получали преднизолон. Этот результат можно объяснить множественными преимуществами метилпреднизолона.
Противовоспалительный эффект метилпреднизолона более выражен, а минералокортикоидный – менее выражен, чем у преднизолона (Hall C.M. et al., 1996). Метилпреднизолон эффективнее подавляет специфические клетки воспаления, в том числе моноциты периферической крови (Hirano T., 2004). В экспериментах на животных метилпреднизолон создавал более высокие концентрации в легочной ткани по сравнению с эквивалентной дозой преднизолона (Vichyanond P., 1989).
Уровень глюкозы в крови повысился в результате лечения у пациентов обеих групп, но в группе А более достоверно, чем в группе Б (p<0,0001 против p=0,031). Такая динамика гликемии подтверждает результаты других исследований, которые демонстрируют, что преднизолон оказывает гипергликемический эффект (Maltais F. et al., 2002). Профиль других побочных эффектов указывает на более высокую безопасность ступенчатой терапии метилпреднизолоном по сравнению с гидрокортизоном и преднизолоном.
В группе А зарегистрировано три события первичной конечной точки: у двух пациентов развилось повторное обострение БА в течение двух недель, а один пациент умер в отделении неотложной помощи. В группе Б на ступенчатой терапии метилпреднизолоном не зарегистрировано ни одного подобного события.
Результаты исследования показали более высокую эффективность и безопасность ступенчатой терапии обострений БА метилпреднизолоном по сравнению с внутривенным гидрокортизоном и пероральным применением преднизолона. Внутривенные инфузии метилпреднизолона с переходом к пероральному его приему можно рекомендовать как стандарт терапии СКС при обострениях БА.
Список литературы находится в редакции.
По материалам Aggarwal P., Bhoi S. J Emerg Trauma Shock. 2010 Jul; 3(3): 231-7
Подготовил Дмитрий Молчанов