20 березня, 2018
Принципы применения глюкокортикоидов в лечении ревматических болезней с учетом их эффективности и безопасности

Глюкокортикоиды (ГК) получили широкое распространение в медицине с середины XX века, после первого успешного опыта использования кортизола и гидрокортизона для лечения больных ревматоидным артритом (РА) группой американских ученых (P.S. Hench, C. Slocumb, H. Polley, 1948). Результаты были столь впечатляющими, что исследователям, выделившим из надпочечников первые глюкокортикоидные гормоны и начавшим их применять с лечебной целью, уже через два года была присвоена Нобелевская премия (E.C. Kendall, T. Reichsten, P.S. Hench, 1950).
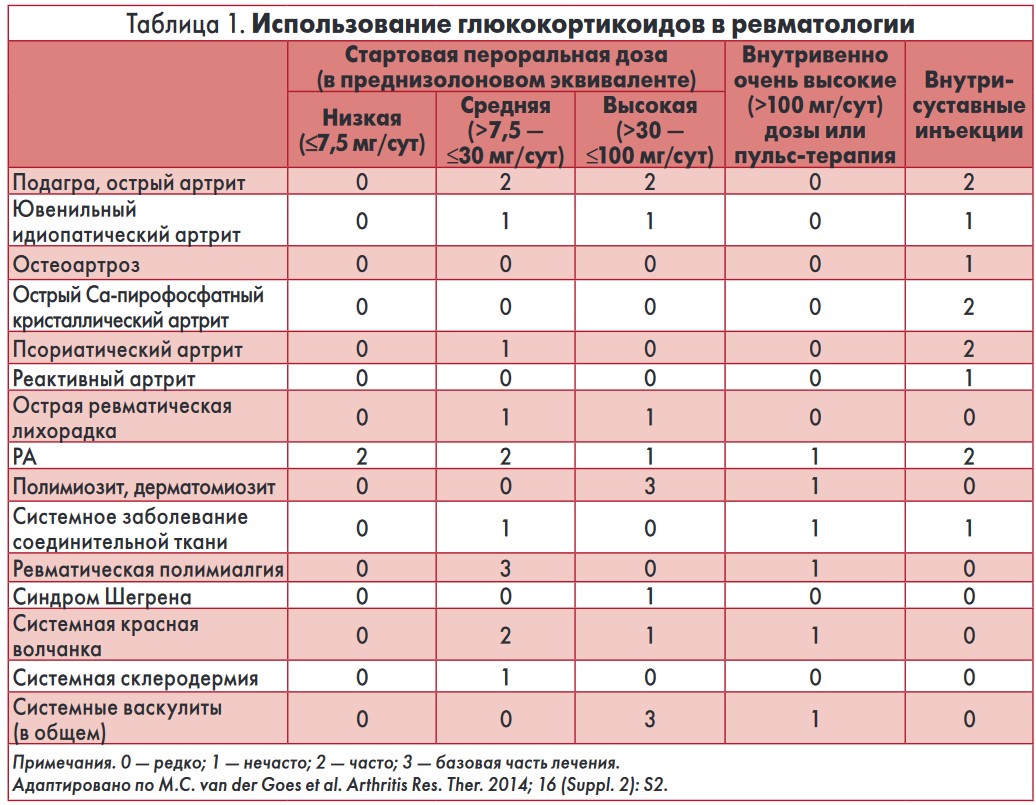
В современной ревматологической практике применяются такие синтетические ГК, как преднизон, преднизолон, метилпреднизолон, бетаметазон, дексаметазон и триамцинолон. Нет ни одного ревматического заболевания, при котором в тех или иных режимах не находили бы применения ГК, хотя их роль и возможности существенно различаются в зависимости от конкретной патологии (табл. 1).
При системных заболеваниях соединительной ткани и васкулитах ГК являются препаратами первого ряда, без которых невозможно достижение клинико-лабораторной ремиссии. В практике лечения РА актуальность ГК сохраняется, несмотря на внедрение биологических болезнь-модифицирующих препаратов, хотя вопросы дозирования и длительности терапии ГК при этом заболевании остаются предметом дискуссий.
Номенклатура и классификация ГК
По химическому составу ГК подразделяются на нефторированные (преднизон, преднизолон, метилпреднизолон) и фторированные (бетаметазон, дексаметазон, триамцинолон, флуметазон и др.). Наличие в молекуле фтора уменьшает минералокортикоидные свойства, но ассоциируется с риском развития миопатии. На этом основывается рекомендация избегать применения дексаметазона, триамцинолона и бетаметазона у пациентов с дерматомиозитом или с известной миопатией.
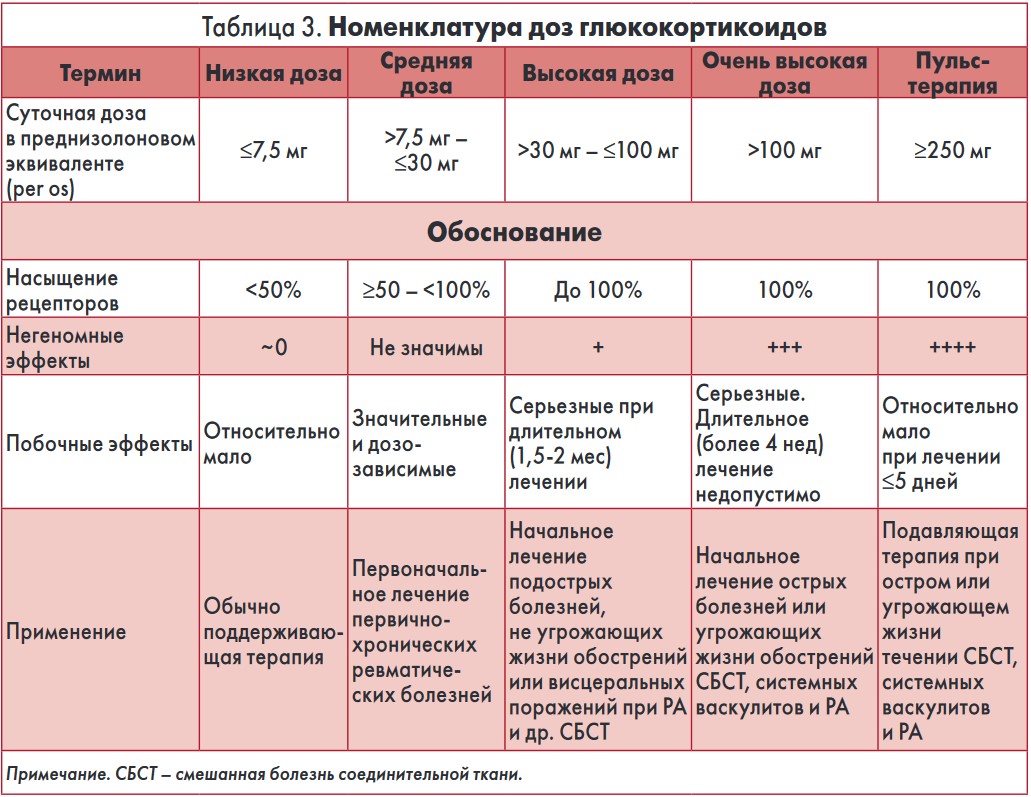
Синтетические ГК более активные, чем природные гормоны, поэтому действуют в меньших дозах. При сходной направленности действия синтетические ГК характеризуются различным соотношением глюкокортикоидных и минералокортикоидных свойств – соответственно, различаются и выраженность противовоспалительного действия, и профили побочных эффектов. Исходя из этих различий составлены таблицы относительной эффективности и эквивалентных доз ГК (табл. 2, 3). 5 мг преднизолона соответствуют 4 мг метилпреднизолона, 0,75 мг дексаметазона или бетаметазона. Минералокортикоидная активность (способность задерживать натрий, вызывать отеки, повышение артериального давления) практически отсутствует у метилпреднизолона, дексаметазона и бетаметазона, незначительно выражена у преднизолона, а самая высокая – у кортизона и гидрокортизона. В связи с этим кортизон и гидрокортизон, с которых начинался терапевтический триумф ГК 70 лет назад, в настоящее время применяются для лечения заболеваний с гипофункцией надпочечников, а не с противовоспалительной целью.
Также ГК классифицируются по длительности действия, которая зависит от периода полувыведения (табл. 2). Быстрее всего выводятся из организма кортизон и кортизол. К препаратам средней длительности действия относят преднизолон, метилпреднизолон и триамцинолон, к длительно действующим – дексаметазон и бетаметазон. Не рекомендуется назначать ГК с длительным периодом полувыведения для длительного приема во избежание подавления выработки собственных глюкокортикоидных гормонов. Поэтому дексаметазон и бетаметазон используются в основном для стартовой и интенсивной терапии. Если необходима длительная терапия, предпочтение отдается преднизолону и метилпреднизолону, которые характеризуются оптимальным балансом противовоспалительного эффекта и побочных действий.
Механизмы действия
Для рационального использования ГК необходимо иметь представление о механизмах действия и их особенностях у разных представителей этой группы препаратов. На сегодняшний день известно, что ГК различаются по путям реализации своего иммуносупрессивного и противовоспалительного потенциала. Выделяют два пути действия ГК: геномный и негеномный (F. Buttgereit et al. Ann. Rheum. Dis. 2002; 61 (8): 718-22).
Геномные эффекты ГК реализуются в дозах ≥2,5 мг в преднизолоновом эквиваленте посредством связывания с внутриклеточными цитозольными α-рецепторами (GRα). Терапевтическое действие развивается не ранее чем через 30 мин после образования гормонорецепторного комплекса. Связываясь с GRα, ГК воздействуют на внутриклеточные сигнальные пути, идущие от мембраны к ядру и опосредующие экспрессию генов синтеза провоспалительных факторов, а также регулируют жизненно важные метаболические процессы в клетке. ГК стимулируют выработку липокортина, который блокирует фосфолипазу А2. В результате блокируется распад фосфолипидов с образованием арахидоновой кислоты и, следовательно, нарушается синтез провоспалительных лейкотриенов и простагландинов. Блокада ядерного транскрипционного фактора каппа B (NF-κB) приводит к угнетению синтеза интерлейкинов 1 и 6, фактора некроза опухоли-α (TNF-α), металлопротеиназ. NF-κB также влияет на активность индуцибельной NO-синтазы, с которой связано развитие цитотоксического окислительного стресса и системной воспалительной реакции.
Посредством сложной модуляции цитокинов, интерлейкинов и молекул адгезии, а также вмешательства в процессы пролиферации и синтеза белка ГК блокируют чрезмерную активацию практически всех клеточных звеньев иммуновоспалительного ответа, включая макрофаги, моноциты, эндотелиальные клетки, базофилы, фибробласты и лимфоциты. Таким образом, противовоспалительный и иммуномодулирующий эффекты ГК реализуются сразу несколькими параллельными путями.
Негеномные эффекты развиваются в течение первых секунд и минут после введения ГК в высоких дозах. Их объясняют непосредственным взаимодействием молекул ГК с биомембранами, а также стероидоселективными мембранными рецепторами.
Выделяют четыре основных группы негеномных эффектов:
1) стабилизация клеточных мембран и мембран органелл, снижение проницаемости капиллярного эндотелия, защита клеток от цитотоксического воздействия;
2) угнетение активности фагоцитирующих мононуклеаров;
3) подавление миграции лейкоцитов в очаг воспаления;
4) снижение функциональной активности эндотелиоцитов, моноцитов, макрофагов, нейтрофильных гранулоцитов и фибробластов.
Самыми выраженными негеномными эффектами обладают дексаметазон и метилпреднизолон. Они реализуются, начиная с 60 мг в преднизолоновом эквиваленте. Поэтому именно эти препараты в высоких дозах применяются для пульс-терапии в ревматологии.
Следует отметить, что ГК блокируют воспалительный каскад на более высоком уровне, чем это делают нестероидные противовоспалительные препараты (НПВП). Если сравнивать ГК с другими противовоспалительными препаратами, которые применяются для лечения ревматических заболеваний (сульфасалазин, соли золота, метотрексат, циклоспорин, антитела к TNF-α), то действие ГК на синтез цитокинов и другие факторы воспаления, а также функции иммунокомпетентных клеток более универсальное и всеобъемлющее.
Продолжается изучение механизмов реализации многочисленных внутриклеточных эффектов ГК. Есть основания полагать, что некоторые различия между ГК обусловлены особенностями их рецепторного взаимодействия. Доказано существование двух типов глюкокортикоидных рецепторов – GRα и GRβ, которые экспрессируются в цитоплазме практически всех клеток организма. α-рецепторы признаны основными в цепочке реализации эффектов ГК, в то время как физиологическая роль β-рецепторов долгое время оставалась неясной. GRβ представлены в меньшем количестве и не связывают ГК. В некоторых, но не всех исследованиях было установлено, что GRβ оказывают доминантное негативное влияние на GRα-индуцированную трансактивацию ГК-зависимых генов (C.M. Bamberger et al. J. Clin. Invest. 1995; 95: 2435-2441. P.J. Hauk et al. Am. J. Respir. Cell. Mol. Biol. 2002; 27: 361-367. R.H. Oakley et al. J. Biol. Chem. 1999; 274: 27857-27866). Другими словами, вероятно, GRβ противодействуют реализации известных геномных эффектов ГК через GRα. При аутоиммунных воспалительных заболеваниях возможна гиперэкспрессия GRβ, что нередко приводит к развитию устойчивости к ГК. То есть существование GRβ может объяснять терапевтические неудачи ГК-терапии. Тем не менее есть данные о том, что реакция GRβ неодинакова под воздействием различных ГК. По данным О. Fruchter и соавт., GRβ подавляет GRα-индуцированную трансактивацию, стимулированную триамцинолоном, дексаметазоном, гидрокортизоном и бетаметазоном на 96, 68, 62 и 49% соответственно, однако этого не наблюдалось при использовании метилпреднизолона (O. Fruchter et al. J. Clin. Endocrinol. Metab. 2005; 90: 3505-3509).
Полученные данные свидетельствуют о том, что метилпреднизолон может быть препаратом выбора при развитии резистентности к другим ГК.
Пульс-терапия
В 1976 году E.S. Cathcart и соавт. сообщили о положительном эффекте инфузий сверхвысоких доз метилпреднизолона у пациентов с волчаночным гломерулонефритом и быстрым ухудшением функции почек. С этого момента началось формирование концепции пульс-терапии ГК.
Пульс-терапия – интермиттирующее введение препаратов в супрафармакологических дозах для усиления терапевтического эффекта и снижения риска побочных эффектов. Дозы ГК при этом превышают 250 мг/сут в преднизолоновом эквиваленте в течение 1-5 дней (F. Buttgerent et al. Ann. Rheum. Dis. 2002; 61: 718-722).
Для пульс-терапии ГК применяются как самостоятельно, так и в сочетании с цитостатиками (чаще всего циклофосфаном), плазмаферезом или внутривенным введением иммуноглобулина.
Показаниями к пульс-терапии являются тяжелые ревматические заболевания и системные заболевания соединительной ткани с риском опасных для жизни исходов (ревматоидный васкулит, тяжелое рефрактерное течение анкилозирующего спондилита, волчаночный нефрит, поражения центральной нервной системы, тяжелые васкулиты, дерматомиозит и др.). При системных васкулитах пульс-терапия особенно показана на ранних этапах развития воспалительных изменений в сосудистой стенке, до наступления необратимых ишемических, некротических изменений в органах и тканях (на этапе индукции ремиссии).
Пульс-терапия противопоказана при наличии у пациента инфекционного заболевания, язвы желудка, глаукомы, плохо контролируемой артериальной гипертензии (АГ), декомпенсированного сахарного диабета (СД). Однако все противопоказания являются относительными, когда речь идет о спасении жизни.
В реализации выраженного терапевтического действия высоких доз ГК важную роль играют быстрые негеномные эффекты – стабилизация клеточных мембран и мембран органелл, снижение проницаемости капиллярного эндотелия, защита клеток от цитотоксического воздействия.
Чаще всего для проведения пульс-терапии ГК в клинической практике используется метилпреднизолон, который характеризуется продолжительным действием (24-72 ч после инфузии) и линейным характером связывания с белками плазмы крови (концентрация метилпреднизолона в плазме крови соответствует дозе вводимого препарата). Противовоспалительный эффект метилпреднизолона превосходит по выраженности таковой у кортизона, гидрокортизона, преднизолона и преднизона, а минералокортикоидный – практически не проявляется.
В зависимости от индивидуальных особенностей пациента и клинической ситуации врач может использовать один из вариантов пульс-терапии ГК (В.А. Насонова, Е.Л. Насонов и др., 2012):
– классический – метилпреднизолон в дозе 1000 мг/сут внутривенно капельно 3 дня подряд;
– средней интенсивности («миди»-пульс-терапия) – метилпреднизолон в дозе 500 мг/сут внутривенно капельно 3 дня подряд;
– низкой интенсивности («мини»-пульс-терапия) – метилпреднизолон в дозе 250 мг/сут внутривенно капельно 3 дня подряд.
Нет специальных показаний к проведению мини-, миди- и классической пульс-терапии. Режим определяется в индивидуальном порядке с учетом тяжести состояния, риска развития побочных эффектов и противопоказаний.
Для предупреждения побочных эффектов следует избегать чрезмерно быстрого введения ГК и проводить мониторинг состояния пациента во время и после инфузии. Большинство побочных эффектов появляется во время введения препарата или через несколько часов, очень редко – на вторые-третьи сутки. В связи с тем, что побочные эффекты требуют быстрой коррекции (например, гипергликемия), пульс-терапию следует проводить только в условиях стационара.
Побочные эффекты ГК и вопросы безопасности
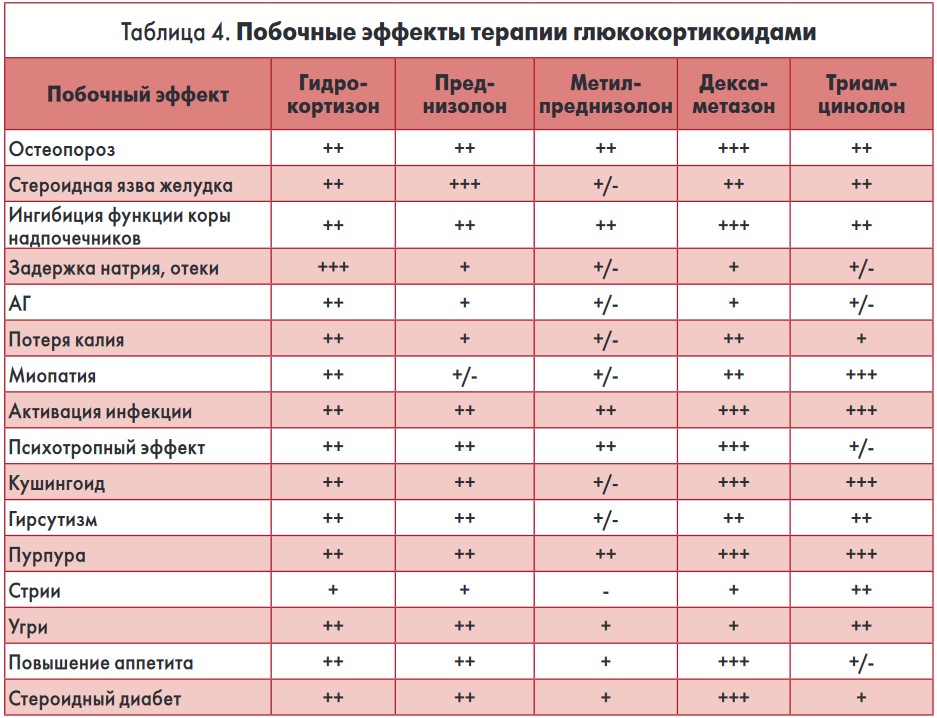
Вмешательство синтетических ГК, применяемых с лечебной целью, в различные метаболические пути практически всех клеток организма обусловливает широкий спектр нежелательных эффектов (табл. 4).
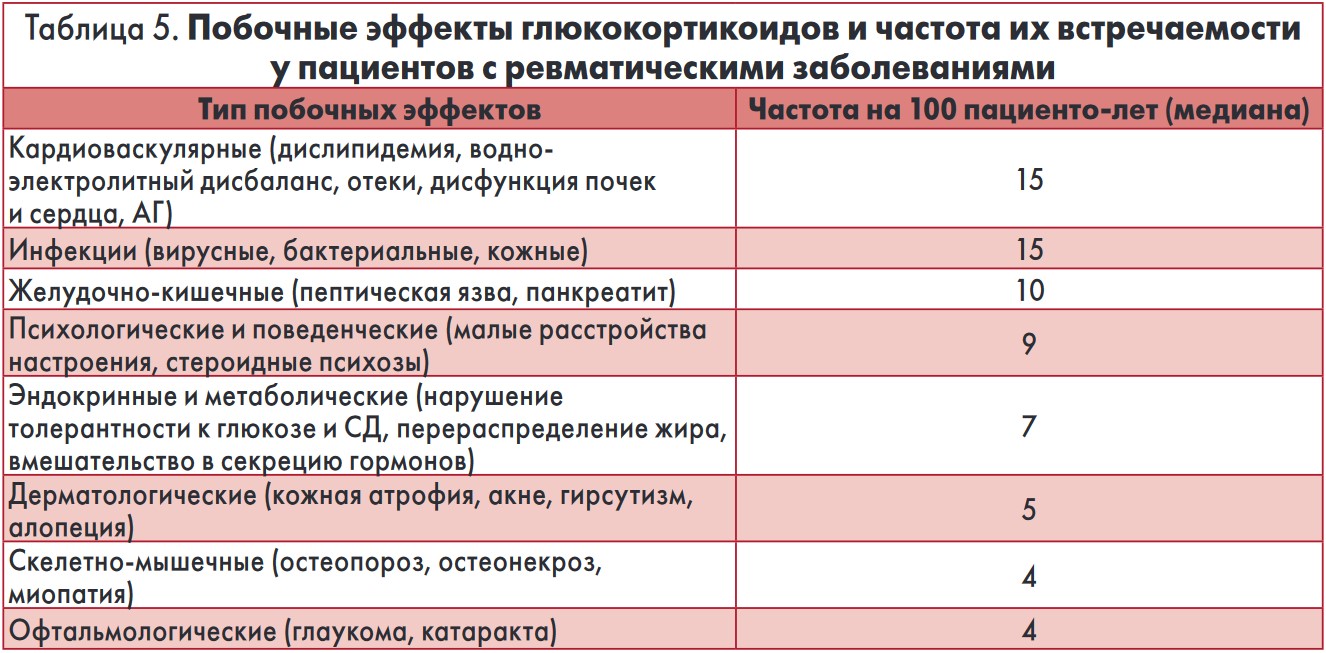
В рекомендациях Европейской противоревматической лиги (EULAR) по применению системных ГК для терапии ревматических заболеваний (Ann. Rheum. Dis. 2007; 66: 1560-1567) частота побочных эффектов ранжирована по данным рандомизированных контролируемых исследований (табл. 5). Все побочные эффекты ГК являются дозозависимыми, что прослеживается даже в диапазоне низких доз – от 5 до 7,5 мг/сут в преднизолоновом эквиваленте. Некоторые авторы выделяют минимальные опасные дозы, ниже которых развитие побочного эффекта маловероятно или незначимо (G. Ruiz-Irastorza et al. Rheumatology, 2012 Jul; 51 (7): 1145-53). Однако согласно другим данным для большинства эффектов нет нижней границы дозы, и, например, потеря минеральной плотности костной ткани происходит при приеме ГК дольше 6 мес в любых дозах (A. Kavanaugh et al. Rheumatology, 2014; 53 (10): 1742-1751).
Также побочные эффекты ГК классифицируются по времени возникновения. Например, остеопороз, гипергликемия и синдром Кушинга наблюдаются рано, с первых месяцев лечения, а катаракта относится к отсроченным кумулятивным последствиям длительного приема ГК.
В клинической практике следует отличать действительно опасные и неприемлемые побочные явления от предвзятости и стереотипов, которые ухудшают комплаенс и несут риск терапевтических неудач. Значение некоторых побочных эффектов склонны преувеличивать и драматизировать как пациенты, так и врачи. Вместе с тем с появлением более совершенных молекул ГК (в частности, метилпреднизолона) и новых результатов исследований развеян ряд мифов, касающихся побочных эффектов ГК. Нельзя автоматически переносить данные о плохом профиле переносимости высоких доз ГК на пациентов, которые принимают низкие дозы. Кроме того, в клинической практике иногда бывает трудно отличить побочные эффекты от признаков прогрессирования или осложнений заболевания, по поводу которого они назначены.
Так, увеличение массы тела, характерное для высоких доз ГК, минимизировано при использовании низких доз современных молекул ГК и может быть связано не столько с метаболическими эффектами ГК, сколько со снижением активности воспаления и уменьшением явлений ревматоидной кахексии. Похожая прибавка массы тела отмечена также у пациентов, получающих ингибиторы TNF-α (M.S. Jurgens et al. Arthritis Care Res. 2013; 65 (1): 88-93).
Согласно данным Piper и соавт. ГК реже вызывают тяжелое поражение желудочно-кишечного тракта, чем НПВП. Двукратное увеличение риска развития язв желудка, описанное на фоне лечения ГК, возможно, связано с сочетанным приемом НПВП (J.M. Piper et al. Ann. Intern. Med. 1991; 114: 735-740).
По данным исследований, риск остеопоротических переломов у пациентов с РА, принимающих ГК в средней дозе 8,6 мг/сут по преднизолону, составляет 33% в течение 5 лет. Однако воспалительная активность РА и ограничение физической активности пациентов при этом заболевании являются не менее важными факторами риска развития остеопороза, чем остеорезорбтивный эффект ГК (M.C. Van der Goes. Osteop. Int. 2013; 24: 1429-36).
Одним из опасных побочных эффектов ГК является гипергликемия, которая может привести к манифестации СД у лиц без такого диагноза или к срыву компенсации у пациентов с диагнозом СД, получающих лечение. Вместе с тем при условии тщательного мониторинга гликемического профиля это нежелательное действие ГК может быть успешно компенсировано увеличением дозы инсулина или пероральных сахароснижающих препаратов.
Актуальным и широко обсуждаемым остается вопрос оценки соотношения риска побочных явлений и пользы назначения ГК для системной терапии. На конгрессе EULAR в 2016 году был представлен перспективный инструмент оценки риска – индекс токсичности ГК (GTI), который представляет из себя суммированный показатель действия ГК на разные органы и системы (E.M. Miloslavsky et al. Ann. Rheum. Dis. 2017; 76 (3): 543-546). 19 экспертов 11 специальностей по вопросам использования ГК в результате анализа информации и консенсусного принятия решений разработали и предложили оценивать токсичность ГК по 31 показателю. Составляющими этого показателя являются оценки индекса массы тела, толерантности к глюкозе, АГ, данные липидного обмена, показатели минеральной плотности костной ткани, выраженность стероидной миопатии, кожных изменений, нейропсихиатрические изменения и инфекции.
Изменения в каждой из этих систем с помощью математических коэффициентов градуированы как улучшение, отсутствие изменений, средней степени нарушения, тяжелые нарушения. Планируется создание на основе GTI онлайн-интерфейса для использования данного показателя как в клинических исследованиях, так и в реальной клинической практике. А пока продолжается разработка и валидизация подобного клинического инструмента, экспертные общества предлагают прагматичный подход к применению ГК в ревматологической практике.
Современные принципы применения ГК
В рекомендациях EULAR (2007) по применению ГК для лечения ревматических заболеваний сформулировано 10 основных положений, которые можно кратко резюмировать в основополагающие принципы:
– индивидуальный подбор дозы ГК в зависимости от заболевания, активности воспаления, факторов риска, ответа на лечение;
– минимизация дозы и длительности приема насколько это возможно;
– учет сопутствующей патологии и факторов риска;
– назначение дополнительной терапии для противодействия или компенсации побочных эффектов ГК. Например, кальция и витамина D на фоне терапии ГК в дозах ≥7,5 мг/сут по преднизолону более 3 мес.
В 2013 году EULAR выпустила основанные на доказательствах и совместном экспертном мнении рекомендации по терапии ревматических заболеваний средними и высокими дозами ГК (Ann. Rheum. Dis. doi: 10.1136/annrheumdis‑2013-203249). Перед назначением средних/высоких доз ГК следует оценить сопутствующие заболевания и состояния, которые могут увеличивать риск побочных эффектов ГК, такие как СД, нарушенная толерантность к глюкозе, сердечно-сосудистая патология, пептическая язва желудка, рецидивирующие инфекции, иммуносупрессия, глаукома и остеопороз. При этом следует учитывать и дополнительные факторы: например, здоровое питание и физическая активность при сердечно-сосудистых заболеваниях являются превентивными факторами и уменьшают общий риск, а длительное течение заболевания, плохо контролированные гипертензия и дислипидемия повышают риск.
Следует подобрать адекватную стартовую дозу ГК для достижения необходимого терапевтического ответа, учитывая риск недостаточности терапии. В дальнейшем следует постоянно пересматривать необходимость в продолжении приема ГК и коррекции дозы в зависимости от терапевтического ответа и побочных эффектов.
Выводы
Учитывая рекомендации EULAR по проведению ГК-терапии у пациентов с ревматическими заболеваниями, с целью обеспечения более безопасного использования ГК в повседневной клинической практике является целесообразным выполнение следующих шагов.
- Больной должен быть проинформирован о возможных побочных эффектах ГК-терапии перед началом ее проведения.
- Выбор стартовой дозы препарата, а также последующей тактики при длительной ГК-терапии осуществляется с учетом вида ревматического заболевания, активности патологического процесса, наличия факторов риска и особенностей индивидуального ответа пациента на лечение; время приема ГК может быть важным ввиду циркадного ритма активации коры надпочечных желез.
- При рассмотрении целесообразности назначения ГК следует учитывать наличие сопутствующих заболеваний и факторов риска возникновения побочных реакций, а также необходимость терапевтических вмешательств с целью их предупреждения.
- При длительной ГК-терапии дозы препаратов должны быть минимальными, а в случае ремиссии или низкой активности заболевания целесообразным является уменьшение дозы.
- В зависимости от индивидуального риска пациента, дозы и длительности приема ГК во время лечения следует проводить мониторирование показателей массы тела, АГ, внутриглазного давления, уровня липидов крови и глюкозы, наличия отеков, развития симптомов сердечной недостаточности. Для оценки побочных явлений терапии ГК может использоваться новый индекс токсичности ГК (GTI).
- При начальной терапии преднизоном в дозе ≥7,5 мг/сут и при длительности лечения более 3 мес необходимо назначить препараты кальция и витамина D. Антирезорбтивная терапия бисфосфонатами с целью профилактики ГК-индуцированного остеопороза должна основываться на оценке факторов риска, в том числе на данных исследования минеральной плотности костной ткани.
- Пациентам, которые получают ГК и неселективные НПВП, следует проводить гастропротекторную терапию или применять альтернативное лечение селективными ингибиторами циклооксигеназы‑2. Нужно подчеркнуть, что исследования по оценке гастропротективных мероприятий у пациентов, которые принимают ГК, не проводились, поэтому на сегодня важным в профилактике гастроинтестинальных осложнений при одновременном применении ГК и НПВП является использование наиболее безопасных средств, в частности метилпреднизолона.
- Всем пациентам, которые получали ГК-терапию более 1 мес, при наличии показаний к хирургическому вмешательству необходимо проводить адекватную заместительную терапию с целью компенсации возможной недостаточности надпочечников.
- Прием ГК во время беременности не ассоциируется с дополнительным риском для матери и ребенка (доза не должна превышать 10 мг/сут по преднизолону). Препаратами выбора для пациенток этой категории является метилпреднизолон и преднизолон. Данные препараты интенсивно метаболизируются в плаценте, попадая в кровь плода в незначительных концентрациях (10% от принятой дозы), в то время как концентрации дексаметазона в крови плода могут быть достаточно высокими, в связи с чем его использование является целесообразным в случае необходимости стимуляции дозревания легких у плода и при уверенности, что ожидаемая польза для матери превышает возможный риск для плода.
- У детей, которые принимают ГК, следует регулярно оценивать рост, а в случае его задержки назначать заместительную терапию соматотропином.
На современном этапе использование ГК остается важным направлением в лечении ревматических заболеваний, которые требуют своевременного выявления факторов риска и тщательного мониторинга состояния пациентов в ходе лечения, а также строгого исполнения рекомендаций относительно рационального применения данных препаратов. Эти мероприятия будут способствовать повышению безопасности долгосрочной ГК-терапии, увеличению длительности и улучшению качества жизни пациентов с ревматическими заболеваниями.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 1 (56) лютий 2018 р.