17 лютого, 2020
Когнітивні порушення на тлі артеріальної гіпертензії: особливості та шляхи корекції

.jpg) Порушення когнітивної функції є однією з актуальних та невпинно зростаючих проблем сучасної медицини. За прогнозами науковців, до 2050 р. кількість пацієнтів із деменцією потроїться [1]. Як і в більшості поширених неінфекційних захворювань, розвиток когнітивних порушень і деменції зумовлений цілим переліком гетерогенних чинників. З одного боку, це генетична схильність (генотип алелі apoE-ε4 асоційований із вищим ризиком когнітивних порушень і деменції), з іншого – фактори серцево-судинного ризику (вік, артеріальна гіпертензія (АГ), діабет, дисліпідемія, ожиріння, низький рівень фізичної активності) та серцево-судинні захворювання (інсульт, тяжка кардіоваскулярна патологія).
Порушення когнітивної функції є однією з актуальних та невпинно зростаючих проблем сучасної медицини. За прогнозами науковців, до 2050 р. кількість пацієнтів із деменцією потроїться [1]. Як і в більшості поширених неінфекційних захворювань, розвиток когнітивних порушень і деменції зумовлений цілим переліком гетерогенних чинників. З одного боку, це генетична схильність (генотип алелі apoE-ε4 асоційований із вищим ризиком когнітивних порушень і деменції), з іншого – фактори серцево-судинного ризику (вік, артеріальна гіпертензія (АГ), діабет, дисліпідемія, ожиріння, низький рівень фізичної активності) та серцево-судинні захворювання (інсульт, тяжка кардіоваскулярна патологія).
Одним із провідних факторів ризику когнітивних порушень і деменції є АГ. Навіть незначно підвищений артеріальний тиск (АТ) асоціюється з погіршенням когнітивної функції, що було продемонстровано в роботі А. Shehab і А. Abdulle: у пацієнтів із так званою гіпертензією білого халата (середній вік – 42±10 років) і нормальним високим АТ (середній вік – 40±9 років) когнітивні функції в доменах «пам’ять» і «час реакції» гірші, ніж у нормотензивних осіб [2].
У низці досліджень було встановлено зв’язок між високим систолічним АТ (САТ) і діастолічним АТ (ДАТ) у середньому віці та порушеною когнітивною функцією в старшому віці. Зокрема, Фремінгемське дослідження показало, що підвищені САТ і ДАТ у середньому віці пов’язані з гіршими показниками загального когнітивного бала, а також показниками уваги та пам’яті в старшому віці [3].
Схожі дані отримані в масштабному проспективному дослідженні Honolulu Heart Program / Honolulu Asia Aging Study, яке охопило 3703 пацієнти (середній вік – 54 роки). Було продемонстровано, що наявність підвищеного САТ (>160 мм рт. ст.) у середньому віці асоціювалася зі збільшенням удвічі ризику розвитку когнітивних порушень у подальшому. Крім того, близько 18% випадків когнітивної дисфункції були пов’язані з передгіпертензією (САТ 120-<140 мм рт. ст.) у середньому віці [4].
Ця асоціація була особливо очевидною в дослідженнях, які вивчали фактори ризику розвитку судинної деменції [5, 6]. При цьому підвищений рівень САТ відіграє більш значну роль у розвитку когнітивних порушень, ніж підвищений ДАТ. Поряд із цим підвищений АТ асоційований зі швидшими темпами зниження когнітивної функції в пацієнтів з уже наявними помірними когнітивними порушеннями [7, 8].
Хоча в більшості проспективних досліджень показано роль підвищеного АТ у розвитку когнітивних порушень, користь від зниження АТ для попередження або сповільнення когнітивної дисфункції однозначно не доведена. Наявні на сьогодні рандомізовані клінічні дослідження продемонстрували гетерогенні ефекти зниження АТ на когнітивну функцію. Так, у дослідженнях SCOPE та MRC не виявлено різниці в показниках когнітивної функції в пацієнтів, які отримували антигіпертензивну терапію, та в групі плацебо [9, 10]. Проте в дослідженні Syst-Eur показано, що довготривала антигіпертензивна терапія на основі дигідропіридинового антагоніста кальцію нітрендипіну знижує ризик деменції на 55% (p<0,001) [11]. У дослідженні PROGRESS, де розвиток деменції та когнітивна дисфункція розглядалися як вторинні кінцеві точки, застосування периндоприлу й індапаміду не позначилося на ризику деменції в пацієнтів із перенесеним інсультом/ТІА [12].
Ще одним невизначеним питанням у попередженні когнітивних розладів і деменції є оптимальний цільовий рівень АТ. О. Godin і співавт. показали, що досягнення кращого контролю АТ протягом 4 років зменшує прогресування ураження білої речовини мозку та зниження загальної когнітивної здатності [13]. З іншого боку, в дослідженні SPRINT MIND не було виявлено достовірного зниження ризику деменції в пацієнтів похилого віку при інтенсивному зниженні САТ (≤120 мм рт. ст.) у порівнянні з менш інтенсивним (САТ у межах 120-140 мм рт. ст.) [14]. Проте низький рівень АТ в осіб віком понад 80 років може бути фактором розвитку когнітивних порушень і хвороби Альцгеймера [15, 16]. В інших роботах повідомляється про наявність так званої U-подібної кривої: зниження когнітивних функцій у пацієнтів похилого віку пов’язане як із підвищеним, так і з низьким рівнем АТ. У нещодавно опублікованому проспективному дослідженні, яке включало 4761 пацієнта, з періодом спостереження 24 роки та вимірюванням АТ у середньому та старшому віці було показано, що учасники з гіпертензією в середньому та старшому віці (відношення ризиків (ВР) 1,49) та особи з АГ у середньому віці та гіпотензією у старшому (ВР 1,62) мали вищий ризик розвитку деменції в порівнянні з тими, хто залишався нормотензивним [17].
Зважаючи на зростаючу поширеність когнітивних порушень і деменції в пацієнтів з АГ та обмежені можливості антигіпертензивної терапії в запобіганні цих порушень, актуальним залишається пошук додаткових шляхів попередження та сповільнення когнітивної дисфункції при АГ, яка зумовлює не тільки ремоделювання церебральних судин, а й порушення судинно-мозкових регуляторних механізмів, унаслідок чого підвищується чутливість мозку до ішемічного ушкодження, особливо у вразливих регіонах білої речовини, що є критичними для когнітивної функції. Холінергічна система головного мозку відіграє важливу роль у контролі когнітивних і мнестичних функцій, а порушення її функціонування лежить в основі холінергічної гіпотези когнітивної дисфункції. Результати досліджень [18, 19] демонструють зв’язок між рівнем ацетилхоліну в мозку та когнітивною ефективністю. Натомість холінергічні структури та специфічні ділянки мозку, такі як гіпокамп, чутливі до ішемічного ушкодження, що може бути одним із механізмів розвитку когнітивної дисфункції на тлі підвищеного АТ. Імовірна роль порушення холінергічної нейротрансмісії в патофізіології судинних когнітивних порушень є підґрунттям для вивчення можливостей препаратів із групи центральних холіноміметиків у покращенні когнітивних функцій у пацієнтів з АГ.
Нами було проведено дослідження «Клінічне підтвердження ефективності та оцінка переносимості препарату Центролін (розчин для ін’єкцій) виробництва ПАТ НВЦ «Борщагівський ХФЗ» у пацієнтів із вторинними проявами цереброваскулярної недостатності».
Метою представленого дослідження було клінічно підтвердити ефективність та оцінити переносимість холіну альфосцерату (ХАС; препарат Центролін (розчин для ін’єкцій) виробництва ПАТ НВЦ «Борщагівський ХФЗ») у пацієнтів із вторинними проявами цереброваскулярної недостатності.
Матеріали та методи
У дослідження було включено 40 пацієнтів віком від 55 до 75 років із гіпертонічною хворобою (ГХ) І-ІІІ стадії,
Критеріями включення в дослідження були:
- наявність вторинних проявів цереброваскулярної недостатності у віковому періоді від 55 до 75 років;
- призначення лікування препаратом ХАС на додаток до стандартної терапії;
- наявність когнітивних порушень <26 балів за Монреальською шкалою когнітивної оцінки (МоСА);
- підписана інформована згода на участь у дослідженні.
У дослідження не включали пацієнтів за таких умов: відома підвищена чутливість до препарату ХАС або його компонентів; психосоматичний синдром і тяжке психомоторне збудження; вторинна АГ; міокардит, вади серця, тяжка серцева недостатність; тяжке порушення периферичного кровообігу; цукровий діабет у фазі декомпенсації та/або з епізодами гіпоглікемії в анамнезі; інфекційні захворювання; вагітність і грудне вигодовування; печінкова та ниркова недостатність; злоякісні новоутворення; супутня терапія серцевими глікозидами, транквілізаторами, антидепресантами, препаратами, які впливають на когнітивну функцію, нейропротекторними засобами, які впливають на нервову систему, парасимпатоміметиками; використання лікарських засобів із подібними досліджуваному препарату фармакологічними ефектами або механізмом дії (антагоністи NMDA-рецепторів акатинол мемантин, нооджерон; інгібітори ацетилхолінестерази галантамін, ривастигмін, донепезил; антидепресанти; анксіолітики; ноотропні препарати; психостимулятори).
На етапі скринінгу всім пацієнтам були проведені реєстрація скарг, збір анамнезу, загальноклінічне обстеження, яке включало вимірювання офісного АТ за загальноприйнятою методикою, фізикальне та неврологічне обстеження, запис ЕКГ, клінічне та біохімічне дослідження крові. Когнітивну функцію оцінювали на початку та в кінці дослідження за допомогою шкали МоСА, таблиць Шульте, символ-цифрового тесту та тесту Струпа.
Стан церебрального кровотоку оцінювали за допомогою дуплексного сканування екстра- й інтракраніальних артерій, яке проводили на апараті Sonoline Omnia (Siemens, Німеччина) за стандартною методикою на початку та в кінці дослідження [19].
Визначали діаметри загальної (ЗСА), внутрішньої (ВСА) та зовнішньої (ЗоСА) сонних артерій і товщину комплексу інтима-медіа (ТКІМ) в області біфуркації ЗСА та бляшки, а також показники кровотоку по ЗСА, ВСА, ЗоСА, середній (СМА), передній (ПМА), задній (ЗМА) мозкових артеріях та основній артерії (ОА), які включали максимальну лінійну систолічну (ЛСШК), мінімальну лінійну діастолічну (ЛДШК) швидкість кровотоку, а також індекс їх резистивності (ІР).
Усі пацієнти, включені в дослідження, відповідно до протоколу надання допомоги пацієнтам з АГ, затвердженого наказом МОЗ України від 24.05.2012 № 384, отримували лікування, яке включало антигіпертензивну терапію, статини й антитромбоцитарні препарати за наявності показань. Додатково до основної терапії пацієнтам був призначений ХАС (препарат Центролін (розчин для ін’єкцій) виробництва ПАТ НВЦ «Борщагівский ХФЗ») по 1000 мг / 4 мл: внутрішньовенно краплинно (повільно) по 1 г (4 мл) на добу протягом 7 днів і внутрішньом’язово по 1 г (4 мл) на добу упродовж 8 днів.
Для порівняльного аналізу вихідних показників та зміни їх на тлі застосування ХАС були використані ретроспективні дані 20 пацієнтів із ГХ і когнітивними порушеннями, які були обстежені у відділі гіпертонічної хвороби ДУ «ННЦ «Інститут кардіології ім. М. Д. Стражеска» НАМН України» в період із листопада 2018 р. по березень 2019 р.
Пацієнти групи лікування ХАС та групи порівняння на початку дослідження були зіставні за віком, статтю, рівнем АТ, індексом маси тіла (ІМТ), показником за МоСА (табл. 1).
Отримані дані обробляли за допомогою методів варіаційної статистики з використанням програми SPSS 10.0. Для кількісних змінних висновки про наявність неоднорідності зроблені на основі порівняння за допомогою критерію Стьюдента (з поправкою Уелча) для нормально розподілених даних або критерію Манна-Уїтні, якщо дані хоча б в одній групі не розподілені нормально. Для дихотомічних змінних висновки про наявність неоднорідності зроблені на основі порівняння за допомогою критерію χ2 Пірсона (з поправкою Йейтса) або точного критерію Фішера. Кореляційний аналіз проводили за допомогою кореляції Пірсона. Кількісні показники наведені у вигляді середніх величин (М) з відповідними їм середньоквадратичними відхиленнями (СВ).
Результати та обговорення
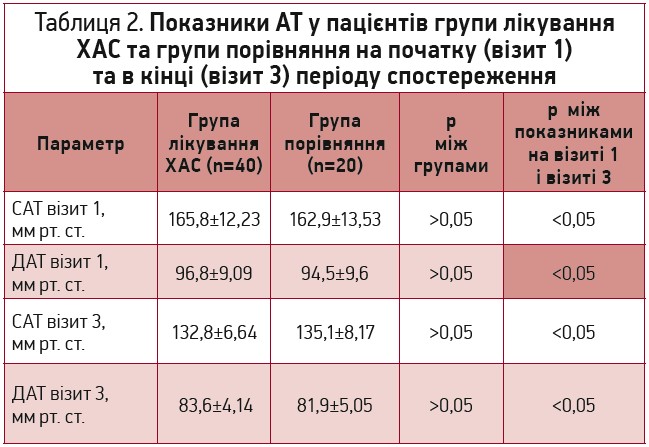 Пацієнти обох груп мали зіставний вихідний рівень АТ (табл. 2). Аналіз динаміки показників САТ і ДАТ показав відсутність достовірних відмінностей між групами у величині зниження АТ: зменшення САТ становило 32,88±12,18 мм рт. ст. у групі лікування ХАС і 27,85±12,11 мм рт. ст. у групі порівняння (р=0,137), ДАТ – відповідно 13,25±8,56 та 13,05±7,83 мм рт. ст. (р=0,93).
Пацієнти обох груп мали зіставний вихідний рівень АТ (табл. 2). Аналіз динаміки показників САТ і ДАТ показав відсутність достовірних відмінностей між групами у величині зниження АТ: зменшення САТ становило 32,88±12,18 мм рт. ст. у групі лікування ХАС і 27,85±12,11 мм рт. ст. у групі порівняння (р=0,137), ДАТ – відповідно 13,25±8,56 та 13,05±7,83 мм рт. ст. (р=0,93).
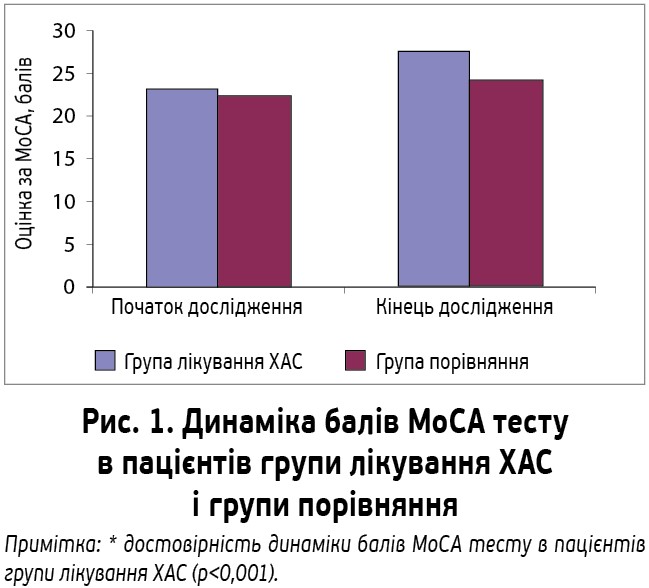
Зниження АТ супроводжувалося позитивними змінами показників когнітивних тестів. Покращення когнітивної функції проявлялося збільшенням бальної оцінки інтегрального МоСА тесту в обох групах (рис. 1). Однак у групі лікування ХАС спостерігалося достовірне збільшення показника інтегрального МоСА тесту до його нормалізації: з 22,55±1,45 до 27,3±1,18 бала (р<0,001) (збереженій когнітивній функції відповідає показник інтегрального МоСА тесту >26 балів). У групі порівняння позитивна динаміка показника інтегрального МоСА тесту була недостовірною: з 22,2±1,43 до 24,2±1,67 балу (р>0,05) (рис. 1).
 Аналіз когнітивних доменів у пацієнтів групи лікування ХАС показав, що вони мали змішане (амнестичне та неамнестичне) порушення когнітивних функцій, при цьому виявлені такі зміни доменів: увага (у 92% пацієнтів), вербальна швидкість (у 77,5% пацієнтів), відкладене повторення (у 82,5% пацієнтів), порушення зорово-конструктивного сприйняття (в 77,5% пацієнтів). У кінці дослідження покращення інтегративного показника МоСА тесту відбулося найбільше за рахунок таких доменів: зорово-конструктивне сприйняття (було знижене в кінці дослідження лише в 35% хворих), увага (була знижена в кінці дослідження лише в 10% хворих), вербальна швидкість (була знижена в кінці дослідження лише в 30% хворих). У таблиці 3 представлена динаміка когнітивних доменів на фоні терапії ХАС, який додавали до антигіпертензивної, статино- й антитромботичної терапії.
Аналіз когнітивних доменів у пацієнтів групи лікування ХАС показав, що вони мали змішане (амнестичне та неамнестичне) порушення когнітивних функцій, при цьому виявлені такі зміни доменів: увага (у 92% пацієнтів), вербальна швидкість (у 77,5% пацієнтів), відкладене повторення (у 82,5% пацієнтів), порушення зорово-конструктивного сприйняття (в 77,5% пацієнтів). У кінці дослідження покращення інтегративного показника МоСА тесту відбулося найбільше за рахунок таких доменів: зорово-конструктивне сприйняття (було знижене в кінці дослідження лише в 35% хворих), увага (була знижена в кінці дослідження лише в 10% хворих), вербальна швидкість (була знижена в кінці дослідження лише в 30% хворих). У таблиці 3 представлена динаміка когнітивних доменів на фоні терапії ХАС, який додавали до антигіпертензивної, статино- й антитромботичної терапії.
Наші дані збігаються з даними літератури про те, що при АГ більш вираженим є ураження таких когнітивних доменів, як темп пізнавальної діяльності, концентрація уваги, порушення керуючих функцій головного мозку, мнестичні розлади та зорово-просторові дисгнозія і диспраксія. В обстежених нами пацієнтів відмічалися зниження показників керуючих функцій, швидкості когнітивних процесів і їх позитивна динаміка на фоні терапії з додаванням ХАС (табл. 4).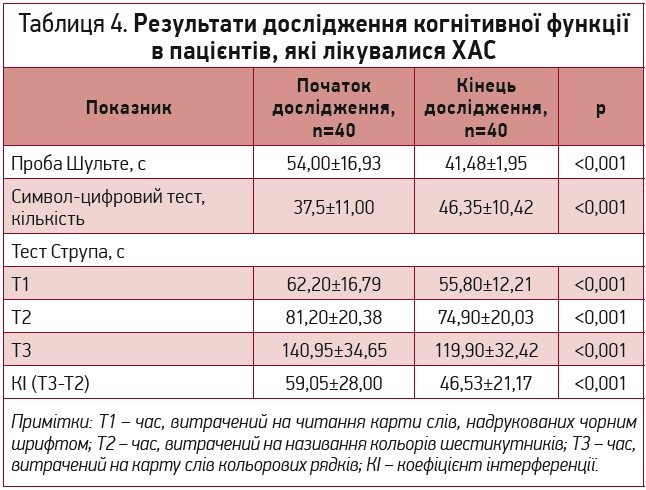
Швидкість обробки інформації та концентрацію уваги оцінювали за допомогою тесту символьно-числового кодування, обраховуючи кількість правильно закодованих чисел за 90 с. У кінці дослідження пацієнти, які отримували терапію ХАС, продемонстрували підвищення моторно-зорової швидкості та концентрації уваги, що проявлялося достовірним збільшенням кількості закодованих чисел із 37,5±11,00 до 46,35±10,42 (р<0,001) (табл. 4).
Дослідження ступеня концентрації та стійкості уваги виконували за таблицею Шульте. У ході проведеного дослідження в пацієнтів групи лікування ХАС відбулося покращення концентрації та стійкості уваги, яке проявлялося достовірним зменшенням часу, необхідного для виконання завдання. На початку дослідження середній час пошуку цифр становив 54,00±16,93 с, натомість після його завершення – 41,48±12,95 с (р<0,001) (табл. 4).
 Важливою ознакою когнітивних порушень у пацієнтів з АГ є порушення керуючих функцій головного мозку та зниження когнітивної гнучкості. Когнітивна гнучкість – розумова здатність переключатися з однієї думки на іншу, обмірковувати кілька речей одночасно. Деякі вчені визначають когнітивну гнучкість як уміння швидко міркувати, бачити суть, знаходити рішення проблем, генерувати нові проекти й ідеї, здатність намітити ціль, створити план її досягнення, контролювати кінцевий і проміжний результати діяльності, вносити корективи в попередньо створений план залежно від умов, що змінюються.
Важливою ознакою когнітивних порушень у пацієнтів з АГ є порушення керуючих функцій головного мозку та зниження когнітивної гнучкості. Когнітивна гнучкість – розумова здатність переключатися з однієї думки на іншу, обмірковувати кілька речей одночасно. Деякі вчені визначають когнітивну гнучкість як уміння швидко міркувати, бачити суть, знаходити рішення проблем, генерувати нові проекти й ідеї, здатність намітити ціль, створити план її досягнення, контролювати кінцевий і проміжний результати діяльності, вносити корективи в попередньо створений план залежно від умов, що змінюються.
При зниженні когнітивної гнучкості в пацієнта виникають труднощі при переході від вирішення однієї когнітивної задачі до іншої. Для діагностики порушення керуючих функцій ми використовували тест Струпа, який проводили за загальноприйнятою методикою, та визначали коефіцієнт інтерференції (КІ=Т3-Т2, де КІ – коефіцієнт інтерференції, Т3 – час, витрачений на карту слів кольорових рядків, Т2 – час, витрачений на називання кольорів шестикутників).
Як видно з таблиці 4, пацієнти з АГ більше часу витрачали на тест з кольором (Т2) і тест невідповідності (Т3), у якому колір шрифту та значення слова не збігалися. В останньому випадку пацієнтам необхідно було назвати колір шрифту, відхиливши невірний вибір відповіді (значення слова). У цьому випадку інтерференція була результатом конфлікту між двома процесами діяльності головного мозку – вербальними і сенсорно-перцептивними функціями. Американський психолог Джеймс Маккін Кеттелл пояснив факт інтерференції тим, що у випадку слів і букв асоціація між ідеєю та назвою має місце настільки часто, що цей процес відбувається автоматично, тоді як у випадку кольорів і картинок ми повинні довільно та із зусиллям вибирати назву.
Триваліший період опрацювання пацієнтами інформації на колірні стимули відображає такі психічні феномени, як порушення виконавчих функцій, уповільнення прийняття рішень, дефіцит уваги, стомлюваність та/або зниження спроможності до пригнічення поточних конкурентних процесів. На фоні проведеної терапії в пацієнтів з АГ спостерігалося зменшення як часу виконання всіх завдань, так і коефіцієнту інтерференції, що проявлялося збільшенням здатності гальмувати сильніші за своєю природою вербальні функції заради сприйняття кольору. Це свідчить про збільшення когнітивної гнучкості та посилення когнітивного пізнавального контролю в пацієнтів з АГ, які додатково до стандартної терапії отримували ХАС.
Отже, додавання ХАС до базисної терапії АГ (антигіпертензивні препарати, статини й антитромбоцитарні засоби в разі необхідності) сприяє покращенню когнітивних функцій, яке проявляється нормалізацією інтегрального показника МоСА тесту, а також таких доменів, як зорово-просторове сприйняття, увага, швидкість обробки інформації, керуюча функція мозку.
Відомо, що АГ є незалежним чинником прогресування атеросклерозу з формуванням атеросклеротичних бляшок у судинах великого діаметра, а також артеріосклерозу та звивистості мозкових артерій малого калібру, наслідком чого є зменшення діаметра просвіту артерій, зниження діастолічної швидкості кровотоку, підвищення судинного опору та зниження перфузії мозку.
З метою оцінки структурних параметрів і показників кровотоку пацієнтам з АГ було проведено дуплексне сканування магістральних екстра- й інтракраніальних артерій. За його результатами було встановлено, що 65% пацієнтів мали патологічні вигини внутрішніх сонних артерій, які були гемодинамічно незначимими; також 77,5% хворих мали гемодинамічно незначимі атеросклеротичні бляшки.
На фоні лікування ХАС не спостерігалося змін діаметрів сонних артерій і ТКІМ (рис. 2).
При аналізі показників кровотоку в екстра- й інтракраніальних артеріях на фоні лікування виявлено зниження судинного тонусу, яке проявлялося достовірним зниженням ІР і підвищенням ЛДШК (табл. 5).
Оцінка швидкісних показників, яка проводилася на основі порівняння з референтними значеннями, дозволила встановити, що на початку дослідження лише в 45% учасників швидкість кровотоку інтрацеребральними артеріями була в межах норми, у 25% пацієнтів відмічалося зниження швидкості кровотоку, а в 30% – підвищення. На тлі додавання ХАС до стандартної терапії спостерігали збільшення частки пацієнтів із показниками швидкості кровотоку в межах референтних значень до 82,5%, лише у 2% хворих швидкісні параметри залишилися нижчими за норму й у 12,5% – вищими за норму.
Аналіз індивідуальної динаміки показників кровотоку показав тенденцію до нормалізації, а саме у всіх хворих (n=12) із високими вихідними показниками лінійної швидкості кровотоку по СМА (≥126 см/с) на фоні проведеної терапії відбулося зниження цього показника зі 135,88±11,74 до 122,88±10,12 см/с (р>0,05), у пацієнтів (n=10) із низькими вихідними значеннями цього показника (≤90 см/с) відбулося підвищення ЛСШК із 89,20±8,26 до 102,30±10,07 см/с (р>0,05). Показники кровотоку по ЗМА й ОА відрізнялися від таких по СМА. Так, на початку дослідження серед обстежених переважали особи з підвищенням швидкості кровотоку: в 60% пацієнтів по ЗМА та 40% пацієнтів по ОА. Після лікування кількість пацієнтів із нормальними показниками кровотоку по ЗМА збільшилася до 53%, а по ОА абсолютні показники лінійної швидкості кровотоку зменшилися з 99,94±8,41 до 87,19±5,78 см/с (р>0,05). Нормалізація показників кровотоку по інтракраніальних артеріях може бути пов’язана з покращенням метаболізму та відновленням контролю за мозковим кровотоком відповідних зон мозку.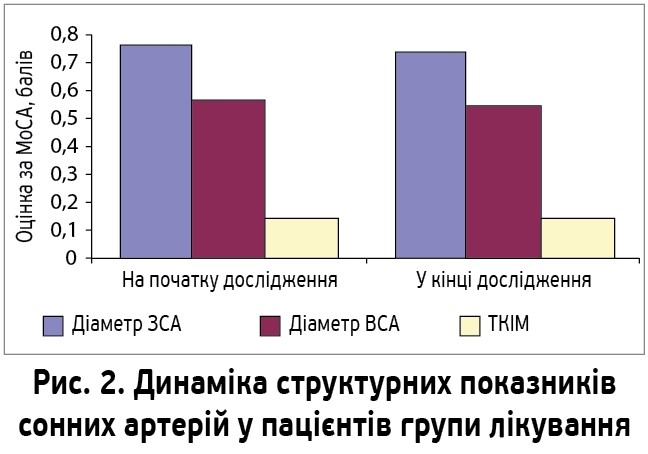
Отже, додавання ХАС до стандартної терапії в пацієнтів із ГХ і когнітивними порушеннями сприяє нормалізації мозкового кровотоку, яка проявляється підвищенням швидкості кровотоку при його початковому зниженні або, навпаки, зниженням при його початковому підвищенні, а також зниженням судинного опору.
Про вплив наявної макроангіопатії у хворих на ГХ на формування когнітивних порушень свідчить також виявлений нами зворотний кореляційний зв’язок між показником МоСА в кінці дослідження та індексом периферичного опору ЗСА на початку (r= -0,349; р=0,027) та в кінці дослідження (r= -0,339; р=0,032).
Проведений кореляційний аналіз також виявив тісний прямий достовірний кореляційний зв’язок інтегративного показника МоСА як на початку дослідження, так і після його завершення з діастолічною швидкістю кровотоку по ОА та ЗМА (табл. 6).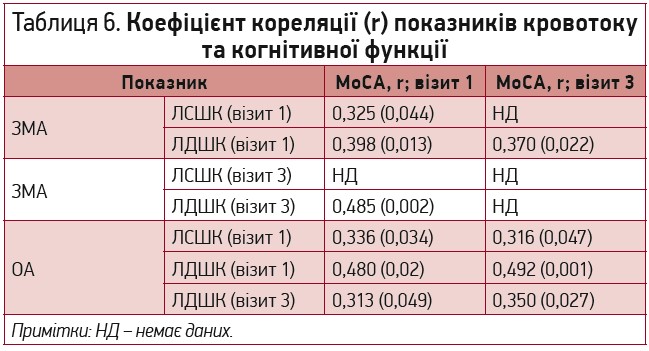
Є декілька теорій розвитку когнітивних порушень при АГ, одна з яких пов’язана з гіпоперфузією головного мозку, зумовленою макро- та мікроангіопатією. Включені в наше дослідження пацієнти мали макроангіопатію, яка проявлялася ремоделюванням сонних артерій зі збільшенням їхнього діаметра, атеросклеротичним ураженням і порушенням геометрії судин, підвищенням судинного опору, про що опосередковано свідчить зниження діастолічної швидкості кровотоку та підвищення судинного опору, наслідком чого є гіпоперфузія головного мозку.
Лікування препаратом ХАС пацієнтами з АГ переносилося добре. В одного хворого спостерігалася побічна реакція у вигляді почервоніння обличчя під час першої внутрішньовенної ін’єкції, яке минуло самостійно і не потребувало відміни препарату. Після закінчення лікування ХАС усі пацієнти відмітили суб’єктивне покращення самопочуття, що проявлялося зменшенням головного болю, запаморочення, підвищенням працездатності та покращенням пам’яті.
Результати наявних клінічних досліджень свідчать про позитивний вплив ХАС на когнітивну функцію за умови тривалого (≥3 міс) застосування. Зокрема, в багатоцентровому відкритому проспективному дослідженні впливу ХАС у формі для орального застосування по 600 мг 2 р/день упродовж 3 міс у 283 пацієнтів із різними формами деменції встановлено достовірний позитивний вплив препарату на когнітивні функції. При цьому також було виявлено покращення показників електроенцефалограми та кровотоку на інтракраніальному рівні [21]. В іншому багатоцентровому рандомізованому плацебо-контрольованому дослідженні з подвійним контролем за участю пацієнтів (n=261) із деменцією при хворобі Альцгеймера лікування ХАС значно зменшило погіршення пізнавальної здатності [22].
У нашому дослідженні позитивний вплив на когнітивну функцію спостерігався вже через 15 днів застосування ін’єкційної форми препарату. Позитивна динаміка когнітивної функції в досліджених нами пацієнтів з АГ є наслідком комплексного підходу, який передбачав додавання ХАС до ефективної антигіпертензивної терапії на тлі застосування статинів та антитромбоцитарних препаратів (за показаннями).
Висновки
- Когнітивні порушення в пацієнтів із ГХ проявляються ураженням таких когнітивних доменів, як зорово-конструктивне сприйняття, увага, вербальна швидкість і відкладене повторення, контролююча функція мозку.
- Пацієнтам із ГХ за наявності когнітивних порушень притаманні ознаки гіпертензивної макро- та мікроангіопатії у вигляді зміни геометрії сонних артерій, їх атеросклеротичного ураження та підвищення судинного опору.
- Когнітивна дисфункція у хворих на ГХ асоціюється з дисбалансом швидкісних показників кровотоку по мозкових артеріях, про що свідчить наявність кореляційного зв’язку між сумою балів за МоСА та лінійною швидкістю кровотоку по середніх, задніх мозкових та основній артеріх.
- Додавання ХАС до антигіпертензивної терапії покращує когнітивну функцію та мозковий кровоток у пацієнтів із ГХ та когнітивними порушеннями.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 2 (471), січень 2020 р.


