15 травня, 2019
Серцеві аритмії при ішемічній хворобі серця

До вашої уваги представлено короткий огляд національних клінічних рекомендацій щодо ведення пацієнтів з ішемічною хворобою серця (ІХС) та серцевими аритміями, створених Шотландською міжуніверситетською мережею з розробки клінічних керівництв (SIGN). Розглянуто методи, спрямовані на запобігання раптовій серцевій смерті (РСС) внаслідок аритмій. Крім того, наведено деякі етіологічні чинники, фактори ризику (ФР) та сучасні напрями ведення осіб з аритміями, асоційованими із зупинкою серця, гострим коронарним синдромом (ГКС), хронічною ІХС, дисфункцією лівого шлуночка (ЛШ).
Аритмії, асоційовані з зупинкою серця
ІХС є причиною приблизно 70% випадків РСС, що є первинним результатом як для пацієнтів без розпізнаної заздалегідь ІХС, так і для тих, у кого ІХС діагностовано. Причому в обох випадках вона пов’язана з однаковими ФР, такими як цукровий діабет (ЦД), гіпертензія і гіпертрофія ЛШ, гіперліпідемія, дієтичні фактори, надмірне вживання алкоголю, гіподинамія та куріння.
Зусилля, спрямовані на запобігання РСС, мають включати:
- корекцію ФР в осіб, які мають високий ризик розвитку ІХС;
- заходи щодо зміцнення здоров’я та заохочення до фізичної активності середньої інтенсивності у загальній популяції.
Аритмії, асоційовані з ГКС
Фібриляція передсердь
Нові випадки фібриляції передсердь (ФП) трапляються у 7‑10% осіб із ГКС, які отримували тромболітичну терапію. У більшості цих пацієнтів синусовий ритм буде підтримуватися на момент виписки незалежно від курсу лікування. При ГКС ФП зустрічається частіше в осіб старшого віку, хворих зі значними порушеннями гемодинаміки за класифікацією Кілліпа та з дисфункцію ЛШ. ФП є незалежним фактором ризику смерті та підвищеного ризику розвитку інсульту.
Рецидиви ФП спостерігаються орієнтовно у 20% пацієнтів. Не з’ясовано, чи доцільно використовувати профілактичну антиаритмічну терапію пацієнтам із ГКС, у яких після перенесеного ФП відновився синусовий ритм.
Антиаритмічна фармакотерапія/кардіоверсія
Нині накопичено певні докази щодо користі застосування аміодарону у пацієнтів із ФП внаслідок ГКС. У рандомізованому дослідженні було показано, що ефективність аміодарону для відновлення синусового ритму є порівнянною з ефективністю дигоксину.
Безпека препаратів класу Ic та їхня ефективність для лікування ФП у пацієнтів із ГКС потребують перевірки у масштабних випробуваннях.
Було показано, що флекаїнід асоціювався з підвищеною смертністю в осіб із частими шлуночковими екстрасистоліями та дисфункцією ЛШ унаслідок ГКС. Ефективність пропафенону в контексті лікування ГКС не досліджували.
Брадикардія
Не виявлено публікацій щодо рандомізованих випробувань, присвячених порівнянню різних стратегій ведення пацієнтів із порушеннями провідності внаслідок ГКС. Усі рекомендації базуються на попередніх консенсусних настановах та експертних висновках щодо досліджень серії випадків, деякі з них було описано до рутинного використання реперфузії.
Синусова брадикардія (<40 уд./хв) зустрічається приблизно у 28% пацієнтів із ГКС під час або відразу після первинного черезшкірного коронарного втручання (ЧКВ). Якщо вона є безсимптомною і переноситься без порушень гемодинаміки, потреби в лікуванні немає. У разі симптоматичної брадикардії зазвичай ефективне застосування атропіну, а також припинення прийому препаратів, що уповільнюють серцевий ритм. Атріовентрикулярна блокада високого ступеня зустрічається у 5‑10% хворих на ГКС з елевацією сегмента ST; у пацієнтів із кардіогенним шоком – частіше.
Пацієнтам із симптоматичною брадикардією / порушенням провідності слід припинити терапію, яка провокує брадикардію (наприклад, прийом β-блокаторів, дигоксину, верапамілу).
Шлуночкові аритмії
Стійкі шлуночкові аритмії – шлуночкова тахікардія та/або шлуночкова фібриляція – зустрічаються у 20% осіб із ГКС. У госпіталізованих пацієнтів із ГКС з елевацією сегмента ST найпоширенішою стійкою шлуночковою аритмією є первинна шлуночкова фібриляція, яка виникає у 3‑5% випадків протягом перших декількох годин після початку інфаркту (у 75% із них упродовж першої години).
Рання (<48 годин) постінфарктна первинна шлуночкова фібриляція пов’язана з підвищеною внутрішньолікарняною смертністю. Але пацієнти, які вижили, на момент виписки зі стаціонара мають результат, аналогічний такому у хворих без первинної шлуночкової фібриляції.
Профілактика вентрикулярних аритмій і раптової смерті
Хоча накопичено чимало даних про переваги препаратів стосовно виживаності після ГКС, первинним результатом є зазвичай загальна смертність, а вторинним – РСС, або ж застосовується субаналіз. Головні докази щодо користі від лікування накопичено для стратегій, які сприяють зниженню загальної смертності, частково за рахунок зменшення раптової смерті, а саме для реперфузії, терапії β-блокаторами, інгібіторами ангіотензинперетворювального ферменту (іАПФ) та статинами.
Вплив антиаритмічних препаратів (аміодарон, лідокаїн) на загальну смертність незначний. Проте доведено, що вони сприяють значному зниженню смертності, спричиненої аритміями, у пацієнтів із ГКС.
Немає чітких доказів того, що збільшення застосування жирних кислот омега‑3 запропоноване як захисний елемент. Але споживання жирної риби у вигляді дієтичної добавки зменшує ризик серцево-судинних захворювань. У метааналізі, де вивчали вплив жирних кислот омега‑3 на профілактику ГКС у пацієнтів з ІХС, переваги спостерігалися лише у тих, які отримували субоптимальне медичне лікування. Поточні дієтичні рекомендації передбачають споживання 140 г порції риби двічі на тиждень.
Чітких доказів на користь того, що збільшення споживання жирів омега‑3 (які вважаються захисними елементами при споживанні жирної риби) у вигляді харчових добавок сприяє зменшенню ризику серцево-судинних захворювань, немає. Метааналіз результатів рандомізованих клінічних випробувань, у яких вивчали вплив жирних кислот омега‑3 на профілактику РСС в осіб із ССЗ, показав переваги лише для пацієнтів, які отримували субоптимальне лікування.
Також наявні певні дані щодо використання антагоністів альдостеронових рецепторів у таких пацієнтів. Результати дослідження EPHESUS (Pitt et al., 2003) за участю пацієнтів із гострим ІМ, дисфункцією ЛШ (фракція викиду [ФВ] ≤40%) та серцевою недостатністю (СН) або ЦД показали, що антагоніст альдостеронових рецепторів еплеренон сприяє відносному зниженню раптової смерті на 21%, загальної смертності – на 15% порівняно із плацебо. Разом із цим, серед хворих, що приймали еплеренон, спостерігалося певне зростання частоти серйозної гіперкаліємії: вміст калію у сироватці крові >6,0 ммоль/л (5,5 проти 3,9% у групі плацебо).
Таким чином, пацієнти, які нещодавно перенесли ІМ та демонструють ФВ ЛШ ≤40% або страждають на ЦД і мають клінічні ознаки СН, повинні отримувати еплеренон, якщо у них немає протипоказань через наявність ниркової недостатності (хронічна хвороба нирок, стадія ≥4‑5) та/або підвищеної сироваткової концентрації калію >5,0 ммоль/л.
Профілактика шлуночкових аритмій і раптової смерті
У всіх пацієнтів із ГКС з елевацією сегмента ST слід оцінити функцію ЛШ для стратифікації ризику принаймні за шість тижнів після гострої події. Неінвазивна оцінка вірогідності розвитку шлуночкових аритмій поза функцією ЛШ може бути розглянуто, але не рекомендовано. Інвазивні електрофізіологічні дослідження не рекомендуються у плановому порядку хворим після ГКС.
Аритмії, пов’язані з хронічною ІХС та дисфункцією ЛШ
Миготлива аритмія
ФП характеризується відсутністю узгодженої електричної активності передсердь. Це призводить до втрати скоординованої передсердної контракції та нерегулярних шлуночкових реакцій, опосередкованих атріовентрикулярною вузловою (АВ) провідністю. У таких пацієнтів це зумовлює стаз крові в неконтрактильних передсердях і подальший ризик розвитку тромбоемболічного інсульту, мінливої симптоматики серцебиття і задишки, пов’язаної з нерегулярним і часто пришвидшеним шлуночковим ритмом.
ФП являє собою значне навантаження на здоров’я та асоційована з істотним підвищенням ризику інсульту й раптової смерті. Незважаючи на те що ФП є частим ускладненням ІХС, більшість досліджень щодо тактики лікування даного розладу охоплюють також пацієнтів із ФП, зумовленою іншими причинами, зокрема захворюванням клапанів серця та гіпертензією. Це ускладнює створення доказової бази для терапії хворих із пароксизмами ФП, що викликані ІХС.
Антиаритмічна терапія
Аміодарон і соталол ефективно запобігають рецидиву ФП. За даними масштабного рандомізованого подвійного сліпого дослідження за участю 665 пацієнтів, аміодарон і соталол були однаково ефективними щодо відновлення синусового ритму, але аміодарон перевершував соталол у запобіганні рецидиву ФП (Singh B.N. et al., 2005).
Слід розглянути можливість призначення аміодарону, якщо необхідна профілактика рецидиву ФП. У хворих, в яких прийом препарату дозволяє успішно контролювати прояви аритмії, необхідно титрувати дозу до найменшої ефективної. Пацієнти, які приймають аміодарон, повинні контролювати функцію щитоподібної залози та печінки на початку дослідження та кожні 6 місяців надалі. Перед початком терапії слід провести рентгенографічне дослідження грудної клітки. В осіб із проявами кашлю чи задишки під час прийому аміодарону варто оцінювати респіраторну функцію та інформувати їх щодо можливих побічних ефектів.
Дронедарон слід розглядати як засіб для запобігання рецидиву ФП у пацієнтів, що не досягли контролю при терапії аміодароном або соталолом чи не переносять ці препарати, а також які не мають систолічної дисфункції ЛШ або СН. Хворим, які приймають дронедарон, слід проводити електрокардіографію (ЕКГ) принаймні кожні шість місяців, щоб виключити постійну ФП. У пацієнтів, котрі застосовують цей препарат, потрібно контролювати функцію печінки до початку лікування, через тиждень, через місяць, щомісяця протягом півроку, через 9 і 12 місяців і періодично надалі. Стан хворих, які приймають дронедарон, слід оцінювати на наявність ознак СН, рекомендувати їм повідомляти про такі симптоми, а також контролювати їх на предмет розвитку систолічної дисфункції ЛШ.
Шлуночкові аритмії
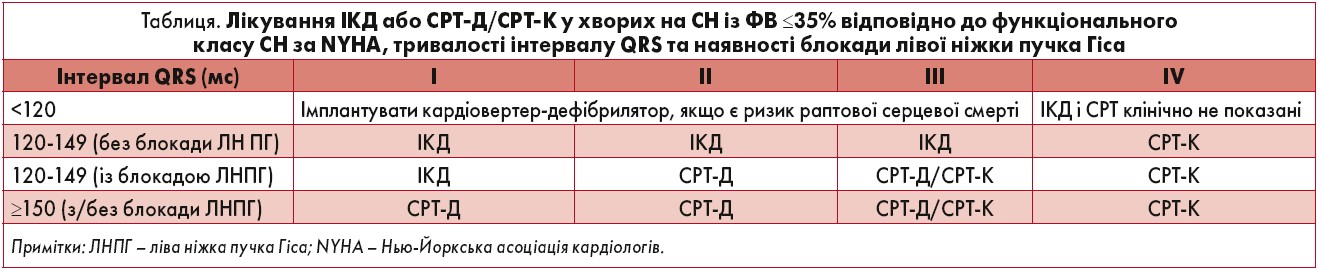
Імплантовані кардіовертери-дефібрилятори (ІКД), серцева ресинхронізаційна терапія з імплантованим кардіовертером-дефібрилятором (СРТ-Д) або кардіостимулятором (СРТ-К) рекомендовані як варіанти лікування пацієнтів із СН зі зниженою ФВ ЛШ ≤35% (табл.). Пацієнтам, які отримують СРТ та/або ІКД, слід провести попереднє консультування, зокрема обговорити з ними можливі технічні проблеми та дезактивацію пристрою.
Аміодарон/β-блокатори
Аміодарон або β-блокатори, зокрема соталол, сприяють зниженню частоти ФП після операції аортокоронарного шунтування (АКШ). Зниження потенційного відносного ризику розвитку ФП при терапії аміодароном становить 46%, а β-блокаторами – 35%. Аміодарон можна застосовувати, коли профілактика ФП і шлуночкових аритмій показана після операції АКШ. Розпочату перед операцією терапію β-блокаторами слід відновити, як тільки це стане безпечним після втручання.
Блокатори кальцієвих каналів
Блокатори швидких кальцієвих каналів, наприклад верапаміл і дилтіазем, є ефективними для зниження частоти серцевих скорочень після операції, а дигідропіридини – ні. Верапаміл і дилтіазем можуть бути використані для профілактики ФП після операції АКШ.
Дигоксин
Дигоксин не знижує частоту ФП після операції АКШ. Відповідно, його не слід використовувати для профілактики ФП після операції АКШ.
Глюкоза, інсулін, калій
Режим глюкоза + інсулін + калій не слід використовувати для профілактики ФП після операції АКШ.
Підготувала Наталія Поваляшко
Із повним текстом рекомендацій можна ознайомитися на сайті www.sign.ac.uk
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» №1 (62), березень 2019 р.