Нові методи лікування сепсису
 15-16 лютого на базі Тернопільського державного медичного університету ім. І. Горбачевського відбулася IV Науково-практична конференція з міжнародною участю «Галицькі анестезіологічні читання: актуальні питання анестезіології та інтенсивної терапії». Як було зазначено на відкритті заходу, анестезіологи відіграють вирішальну роль у захисті хворих від операційного стресу, забезпеченні їхньої життєдіяльності, попередженні та лікуванні критичних станів, які загрожують життю. Насамперед це стосується сепсису, який є однією з головних причин захворюваності та смертності в усьому світі.
15-16 лютого на базі Тернопільського державного медичного університету ім. І. Горбачевського відбулася IV Науково-практична конференція з міжнародною участю «Галицькі анестезіологічні читання: актуальні питання анестезіології та інтенсивної терапії». Як було зазначено на відкритті заходу, анестезіологи відіграють вирішальну роль у захисті хворих від операційного стресу, забезпеченні їхньої життєдіяльності, попередженні та лікуванні критичних станів, які загрожують життю. Насамперед це стосується сепсису, який є однією з головних причин захворюваності та смертності в усьому світі.
Враховуючи постійний ріст антибіотикорезистентності та критичний стан проблеми створення нових антибактеріальних препаратів, смертність від сепсису буде прогнозовано зростати. Які потенційно перспективні методи лікування сепсису залишаються на озброєнні в лікарів, які існують на сьогодні положення світової науки і практики в питаннях профілактики, запобігання, діагностики та інтенсивної терапії сепсису? Ці та інші питання стали темою доповіді завідувача кафедри анестезіології та реанімації Національного медичного університету ім. О.О. Богомольця (м. Київ), члена-кореспондента НАМН України, доктора медичних наук, професора Фелікса Семеновича Глумчера.
Щодня реєструється понад 1400 смертельних випадків тяжкого сепсису, і ця кількість продовжує зростати. Згідно з даними багатьох досліджень, летальність при тяжкому сепсисі коливається в межах 36-60%. Навіть у разі сприятливого перебігу сепсису й одужання проблеми пацієнта на цьому не закінчуються. Сьогодні зростає розуміння того, що у хворих, які переносять (або перенесли) сепсис, часто виникають віддалені фізичні, психологічні та когнітивні розлади.
У наступні десятиліття можна чекати значного поширення захворюваності на сепсис. До 2050 р. у США прогнозують збільшення в 2 рази частоти випадків сепсису (від фактичних 800 тис до 1,6 млн випадків щорічно) при зростанні кількості населення на 30%.
Згідно із сучасним визначенням сепсис – це загрозлива для життя органна дисфункція, викликана дизрегулятивною відповіддю організму на інфекцію. Органна дисфункція ідентифікується за наявності ≥2 пунктів за шкалою SOFA (Sepsis-related Organ Failure). Сепсис, який потребує застосування вазопресорів і при якому рівень лактату за умови нормоволемії перевищує 2 ммоль/л, називається септичним шоком (СШ).
На жаль, до сьогодні відсутні будь-які патогенетичні методи лікування сепсису, і лікарі мають покладатися лише на антибіотикотерапію, відновлення об’єму рідини та вазопресори. Але навіть така стратегія дозволила суттєво знизити кількість ранніх летальних випадків у септичних пацієнтів і покращити їх загальне виживання. Але, незважаючи на ці очевидні успіхи, СШ, як і раніше, супроводжується високими показниками летальності, що перевищують 30%.
Важливою складовою терапії СШ є підтримувальна інфузійна терапія. Згідно з останніми міжнародними рекомендаціями з ведення сепсису та СШ (2016) у разі СШ із недостатньою перфузією необхідно провести переливання не менше ніж 30 мл/кг кристалоїдного розчину протягом перших 3 год (сильна рекомендація).
Після початкової ресусцитації рідиною подальша інфузійна терапія має проводитися під контролем гемодинамічного статусу. Для визначення реакції на введення рідини рекомендовано використовувати динамічні, а не статичні зміни. Наприклад, це може бути визначення динаміки серцевого викиду, систолічного об’єму. Визначення центрального венозного тиску є малоінформативним, тому не рекомендується для застосування.
На практиці це виглядає наступним чином. Після переливання 500 мл ізотонічного розчину визначаємо один із перелічених показників і під час подальшої інфузії спостерігаємо за його динамікою. У разі покращення гемодинамічих показників інфузію слід продовжувати.
Якщо подальшої динаміки не відбувається, інфузію кристалоїду необхідно припинити. За необхідності для підвищення артеріального тиску можна перейти на введення вазопресорів і кардіотоніків.
Рання ефективна ресусцитація рідиною є критичною для стабілізації викликаної сепсисом недостатньої перфузії тканин або СШ. Спровокована сепсисом недостатня перфузія може призвести до гострої дисфункції органів, тому цей фіксований об’єм рідини (30 мл/кг) дозволяє клініцистам почати реанімацію без застосування розширеного моніторингу гемодинаміки.
У патогенезі сепсису важлива роль відводиться імунній системі. Раніше вважалося, що перебіг сепсису є біфазним і включає початкову гіперзапальну фазу (SIRS) з наступною антизапальною, або імуносупресивною, фазою (компенсаторний антизапальний синдром – CARS), що переходить в імунопараліч (MARS). Сьогодні доведено, що гіперзапальна та антизапальна фази можуть збігатися в період протікання сепсису. Тобто імуносупресія починає розвиватися вже під час гіперзапалення.
Якщо в цій фазі в терапії допускають помилки (неадекватний вибір антибактеріальних препаратів, неповна санація інфекційного вогнища), з великою вірогідністю виникне виражена імуносупресія або імунопараліч. Сьогодні дослідники шукають способи модифікації впливу на імунну систему під час сепсису.
Встановлено, що в багатьох септичних пацієнтів гіперзапальна фаза є відносно нетривалою, тому застосування протизапальних препаратів може бути ефективним протягом досить невеликого проміжку часу. Лікарські засоби, призначені для усунення гіперзапалення, мають діяти нетривалий час, застосовуватися вчасно і тільки у хворих із підвищеними рівнями прозапальних цитокінів (фактор некрозу пухлини-α (ФНП-α), інтерлейкін (ІЛ)-1 або ІЛ‑6).
Результати досліджень пригнічення гіперзапальної фази продемонстрували лише часткову користь від такої терапії при її використанні на ранній стадії сепсису в обмежених групах септичних пацієнтів. Водночас ці препарати можуть бути потенційно шкідливими для інших пацієнтів із сепсисом, в яких прогресує імунний параліч.
І все ж таки застосування протизапальних препаратів дає змогу покращити прогноз. Хоча якась частина хворих все ще помирає під час початкової фази сепсису, нові протоколи лікування рятують життя більшості пацієнтів у цій фазі. На жаль, у багатьох із них в подальшому розвивається стан імунної супресії (Schorr С.А., Dellinger R.P., 2014).
Більшість пацієнтів із сепсисом помирають через тиждень внаслідок імуносупресії, яка сприяє розвитку вторинних інфекцій, у тому числі й полірезистентних госпітальних інфекцій.
Були спроби застосування антагоністів ФНП-α, IЛ‑1, блокаторів Toлл-подібних рецепторів, інгібіторів тромбоцитактивуючого фактору, антикоагулянтів, антагоністів ендотоксину, гемофільтрації для видалення розчинних ендотоксинів і цитокінів, та все це не продемонструвало ефективності, а в деяких випадках навіть погіршувало результат (Hotchkiss R.S. et al., 2013; Cohen J. et al., 2013).
Виділяють 3 основні причини погіршення функції адаптивної імунної системи за наявності сепсису:
- апоптоз, який викликає виснаження імунних клітин, покликаних боротися з інфекцією;
- підвищена регуляція інгібуючих рецепторів або низький рівень регуляції есенціальних ко-стимулюючих рецепторів на поверхні клітин;
- зниження реакції цитокінів.
Це потенційні мішені імуномодуляції при сепсисі. За допомогою апоптозу, який відомий також як «запрограмована смерть клітин», імунна система підтримує гомеостаз, ліквідуючи активовані клітини.
Наприклад, імунна клітина, що нейтралізувала інфекційний патоген, стає нежиттєздатною і підлягає апоптозу. Це фізіологічний процес, який відбувається під час нормального росту й розвитку клітин. Але під час сепсису апоптоз набуває надмірного характеру і призводить до загибелі життєздатних імунних клітин (перш за все лімфоцитів), що покликані боротися з інфекцією. Це стає причиною несприятливих наслідків для виживання організму.
Центральними регуляторами апоптозу є каспази, що являють собою цистеїнові протеази. Вони сприяють деградації клітинних білків і транскрипційного фактору NF-kB, що активує транскрипцію обох генів – проапоптотичного та гена виживання. Гіперзапальна реакція при сепсисі з продукцією прозапальних цитокінів потребує активації NF-kB шляхом активації каспаз, при цьому NF-kB і каспази одночасно викликають апоптоз адаптивних імунних клітин (Senftleben U. et al., 2002; Weighardt Н. et al., 2007). Як було показано в дослідженнях, апоптотична реакція виникає на тлі сепсису паралельно з прозапальною реакцією у фазі гіперзапалення і в подальшому є основною причиною імуносупресії.
Необхідність застосування імунотерапії сепсису не викликає сумнівів, однак донині ми не маємо ефективних препаратів для цього. Стагнація в розробці нових антибіотиків, широке розповсюдження резистентних до антибіотиків інфекційних патогенів та невдачі клінічних випробувань з корекції прозапальної фази сепсису є основними чинниками, які стимулюють дослідників до розробки та впровадження в клінічну практику імуномодуляторів, дія яких спрямована передусім на зменшення імуносупресії під час сепсису.
Для того щоб застосовування імуномодулюючих препаратів виявилося успішним, необхідно обов’язково використовувати точні критерії стану імунної системи хворого на момент застосування. Прокальцитонін, С-реактивний білок і лактат є неспецифічними маркерами сепсису. Зараз проводиться чимало досліджень з визначення сепсис-специфічних біомаркерів, що надзвичайно важливо для своєчасної персоніфікованої таргетної терапії та прийняття вірних клінічних рішень.
Так, допомогти у визначенні імунопаралічу в критичних хворих у режимі реального часу може використання кількісної полімеразної ланцюгової реакції. Інший новітній маркер – пресепсин (розчинний підтип CD‑14) може використовуватися не тільки в якості раннього діагностичного маркера сепсису, але й маркера ступеня тяжкості сепсису та його прогнозу.
Сьогодні для діагностики інфекцій кровотоку використовують посіви крові з ідентифікацією нуклеїнових кислот збудників. Багато перспективних досліджень фокусуються на створенні мікрорідинних лабораторій на чипі, що зможуть забезпечувати швидкий аналіз зразків крові від пацієнта з підозрою на сепсис. Наразі є обнадійливі результати стосовно створення одноразового пристрою для швидкої високочутливої діагностики сепсису в пацієнтів відділень інтенсивної терапії вже найближчим часом.
C. Meisel і співавт. (2009) показали, що контроль за експресією HLA-DR в якості індикатора імунної функції дозволив покращити результати лікування сепсису. Тому комбінація потокової цитометрії (Flow Cytometry) для визначення експресії поверхневих рецепторів на лімфоцитах (HLA-DR, PD‑1), функціональні тести з кількісного визначення секреції цитокіну IFN-γ при госпітальних інфекціях може дозволити персоніфікувати імунну терапію.
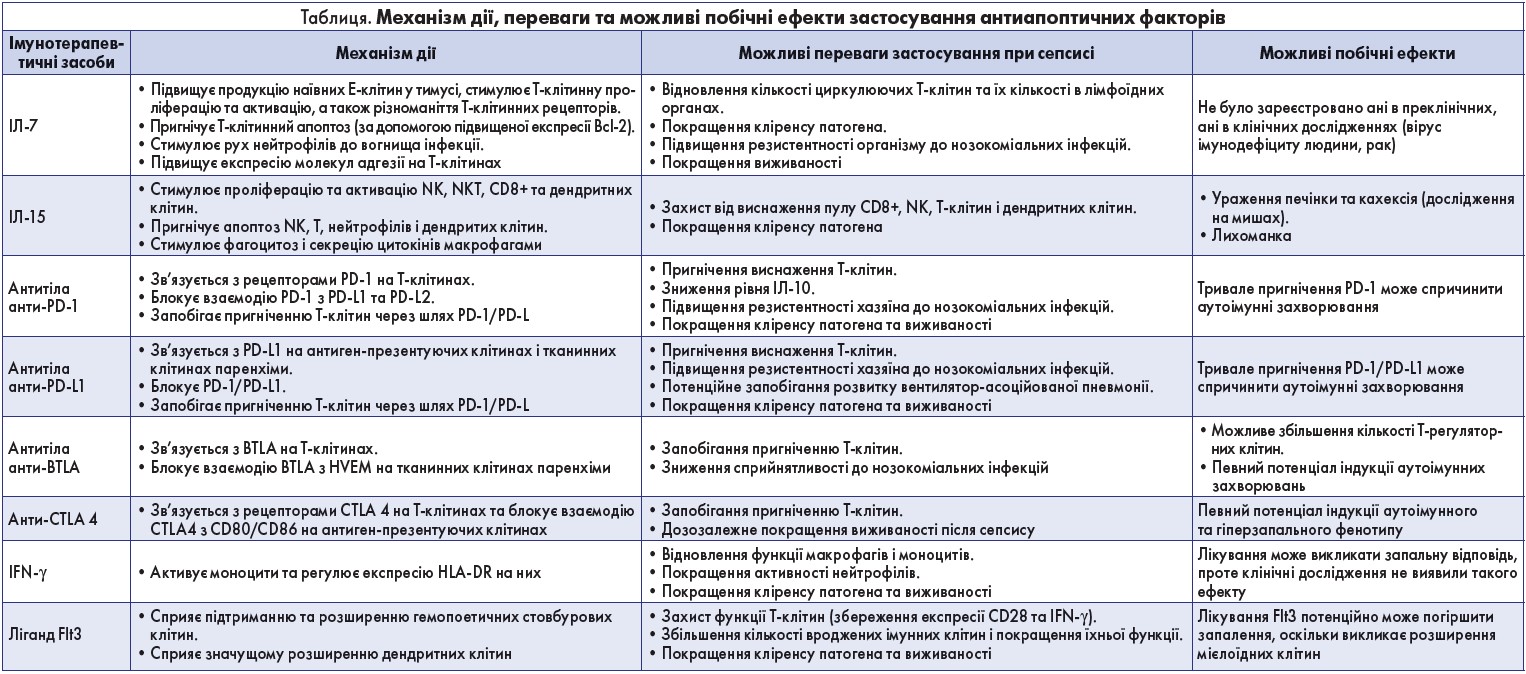
Зараз проводиться вивчення антиапоптичних факторів IЛ‑7, IЛ‑15, антитіл до анти-PD‑1, анти-PD-L1, анти-BTLA, анти-CTLA 4, через які реалізується апоптоз, IFN-γ, ліганд Flt3. Вивчений механізм дій і можливі побічні ефекти зазначених чинників представлено в таблиці.
У більшості септичних хворих збільшується експресія PD‑1 на Т-лімфоцитах, що сприяє переходу з гіперзапалення до гіпозапалення.
Стимуляція PD‑1 інгібує проліферацію Т-лімфоцитів, збільшує секрецію IL‑10, викликає апоптоз та анергію, інгібує цитотоксичність SD8 T-клітин (Keir М.Е. et al., 2008). Руйнування осі PD‑1 PD-L або фармакологічна блокада збільшували виживання на тлі бактеріального та грибкового сепсису в мишей (Brahmamdam Р., 2010; Zhang Y. et al., 2010). N.K. Patil і співавт. (2016) вважають, що імунотерапевтичні стратегії, спрямовані на стимулювання імунної системи, здатні повністю змінити викликану сепсисом імуносупресію та покращити результати лікування, однак це ще потрібно довести клінічно.
У цілому імунотерапія може бути успішною в лікуванні сепсису, якщо вона ґрунтуватиметься на персоніфікованому підході до кожного пацієнта. Імуномодулюючі засоби, наприклад IЛ‑7 та антитіла, які блокують інгібітори Т-лімфоцитів (анти-PD‑1, анти-PD-L1), мають значний потенціал у боротьбі з тяжким сепсисом.
Але важливо не забувати, що імунотерапія може бути небезпечною через майбутні негативні наслідки. Йдеться насамперед про стимуляцію надмірної запальної відповіді, яка може призвести до фульмінантного гіперзапалення та швидкої смерті під час сепсису. Тому важливо ідентифікувати хворих на основі імунного статусу і застосовувати імунотерапію персоніфіковано.
Нові й унікальні перспективи відкриває генотерапія сепсису. Генетичний профіль окремих пацієнтів дозволяє визначити певні зміни, які характерні для збільшеної чутливості до інфекції. Прогнозується, що в майбутньому вдасться визначити шлях до генетичного управління Т-лімфоцитами для лікування сепсису, оскільки генетично модифіковані Т-лімфоцити можуть бути скеровані проти певних антигенів.
При сепсисі генетично модифіковані Т-лімфоцити, резистентні до апоптозу і поліклональні для багатьох патогенів, у тому числі бактеріальні, грибкові та вірусні, можуть бути застосовані для корекції імунної дисфункції. Отже, вчені намагаються створити специфічний імунітет завдяки методам генної інженерії. Чи виправдаються ці оптимістичні прогнози, покаже час.
Підготував В’ячеслав Килимчук
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 2 (32), травень 2018 р.
СТАТТІ ЗА ТЕМОЮ Хірургія, ортопедія та анестезіологія
Дисфагія є поширеним явищем у пацієнтів відділення інтенсивної терапії (ВІТ), але вона часто залишається недостатньо розпізнаною та неконтрольованою, незважаючи на те що пов’язана з небезпечними для життя ускладненнями, тривалим перебуванням у ВІТ та госпіталізацією. Запропонований у статті експертний висновок щодо діагностики й лікування дисфагії розроблений на основі доказових клінічних рекомендацій та думок лікарів-практиків. Автори рекомендують прийняти ці клінічні алгоритми для надання стандартизованої та високоякісної допомоги, яка передбачає своєчасний систематичний скринінг, оцінку та лікування дисфагії в екстубованих пацієнтів і пацієнтів із трахеостомою у ВІТ. ...
Больовий синдром при хронічних ранах є рутинним явищем хірургічної практики. Рана вважається такою, що тривало не загоюється, якщо, незважаючи на відповідну терапію та достатній термін лікування (4-6 міс), відсутні або практично відсутні ознаки загоєння. Неопіоїдні та опіоїдні анальгетики є основними препаратами, що застосовуються для лікування больового синдрому при ранах. На науково-практичній конференції «Міждисциплінарний підхід у лікуванні коморбідних хірургічних пацієнтів», що відбулася наприкінці 2023 року, тему менеджменту хронічної ранової хвороби представив у доповіді «Контроль болю в хірургії ран та трофічних дефектів м’яких тканин різної етіології» завідувач кафедри хірургії та судинної хірургії Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Іванович Саволюк. Ключові слова: ранова хвороба, трофічна виразка, ВАК-терапія, больовий синдром, нестероїдні протизапальні препарати, Дексалгін®....
Актуальність проблеми переломів на сьогодні не залишає сумнівів, зокрема в контексті старіння населення та поширеності остеопорозу. Кальцій та вітамін D, виконуючи ключову роль у формуванні та підтриманні щільності кісткової тканини, є необхідними елементами для успішної профілактики переломів, особливо у вразливих груп населення. Також важливим є достатній рівень кальцію та вітаміну D в організмі для оптимального зрощення переломів і посттравматичної зміни кісток. У цьому контексті велике значення має вибір конкретного комплексу Са + D із позицій ефективності, безпеки та високого комплаєнсу. Ключові слова: остеопороз, крихкість кісток, кальцій, вітамін D, профілактика переломів. ...
З установленням центральних венозних катетерів (ЦВК) пов’язані різноманітні ускладнення, включаючи ті, що зумовлені безпосередньо введенням і/або доступом, через який уводиться катетер, а також віддалені (>1 тижня) ускладнення, такі як дисфункція катетера, стеноз або тромбоз центральної вени та розвиток інфекції. Кількість і тяжкість ускладнень зростають зі збільшенням розміру катетера, кількості використовуваних катетерів та часу їх перебування в організмі. У статті наведено огляд сучасних даних щодо ускладнень, пов’язаних із ЦВК, а також стратегії їх профілактики та лікування. Ключові слова: центральний венозний катетер, ускладнення, пункція артерії, пневмоторакс, тромбоз центральної вени, інфекції кровотоку, дисфункція катетера. ...