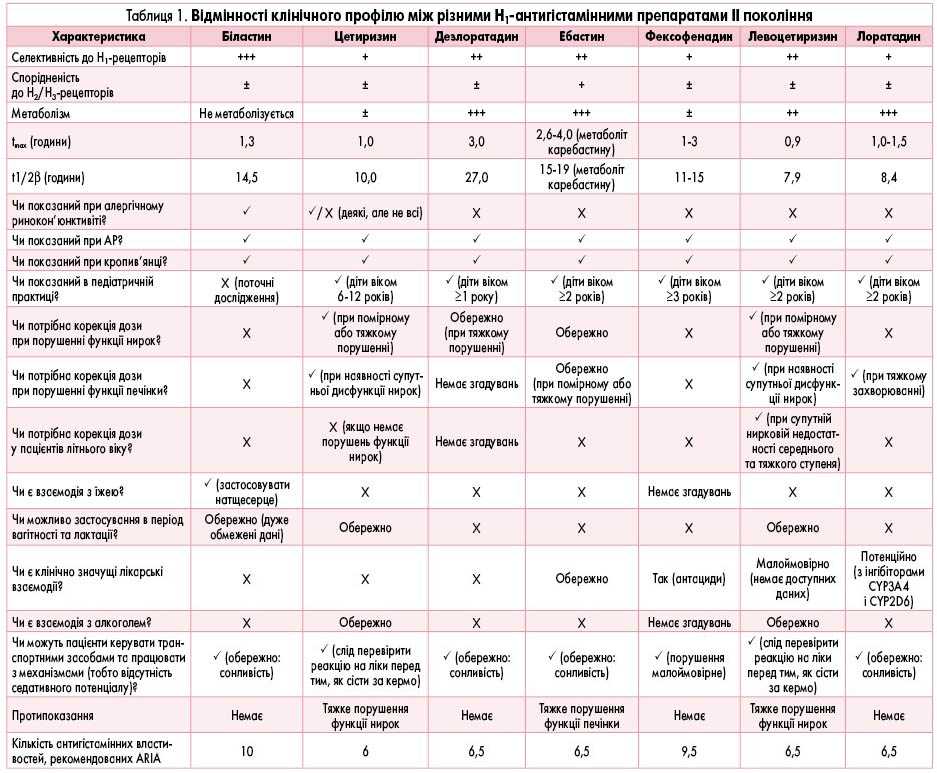
Лікування алергічного риніту та кропив’янки: огляд новітнього антигістамінного препарату біластину
Поширеність і вплив алергічних захворювань часто недооцінюють [1]. Ключовим фактором алергічної відповіді є імуноглобулін (Ig) Е, присутній на поверхні тучних клітин і базофілів. Взаємодія алергену з IgЕ та його рецепторним комплексом призводить до активації цих клітин і вивільнення речовин, у тому числі гістаміну, які викликають симптоми алергії [2]. Враховуючи ключову роль гістаміну в розвитку алергічних реакцій, при багатьох алергічних станах, включаючи алергічний риніт і кропив’янку, пацієнту призначають антигістамінні препарати [3, 4]. У статті проаналізовано сучасні дані щодо тягаря алергічного риніту і кропив’янки, розглянуто фармакологічні характеристики і клінічні результати застосування біластину – антигістамінного препарату, високоселективного до Н1-гістамінових рецепторів.
Алергічний риніт
Алергічний риніт (АР) – це симптоматичний стан, спричинений впливом алергену та IgE-опосередкованим запаленням. За характером перебігу АР класифікують на інтермітуючий та персистуючий, за тяжкістю виділяють легку, помірну і тяжку форми [5].
АР часто відмічають у практиці первинної медичної допомоги. Пацієнти повідомляють, що АР має помітний негативний вплив на їхній сон, соціальну взаємодію, якість життя, відвідуваність і функціонування у школі й на роботі [6]. Інша проблема полягає в тому, що АР зазвичай співіснує з іншими формами або алергічними захворюваннями. Існують клінічні та епідеміологічні докази щодо зв’язку АР і бронхіальної астми (БА) [7]. Так, до 75% пацієнтів з БА мають АР і приблизно 1/3 пацієнтів з АР мають БА [8, 9]. Задокументовані коморбідні зв’язки між АР і синуситом, кон’юнктивітом, середнім отитом і поліпозом носа, хоча масштаби цих зв’язків не з’ясовані [10].
АР є проблемою охорони здоров’я в усьому світі, його поширеність становить 10-30% [11]. За оцінками, захворювання впливає на життя >500 млн людей в усьому світі [6]. Тягар особливо великий в Азійсько-Тихоокеанському регіоні, де багато людей живуть у перенаселених містах із високим рівнем забруднення навколишнього середовища [12].
Кропив’янка
Ще одним поширеним захворюванням є кропив’янка. Проявляється пухирями на шкірі, ангіоневротичним набряком тощо [4, 13]. Зазвичай близько половини всіх пацієнтів із кропив’янкою мають асоційований ангіоневротичний набряк [14]. Якщо стан триває ≤6 тиж, його вважають гострим; якщо зберігається протягом 0,6 тиж або рецидивує – це хронічне захворювання. Симптоми розладу можуть тривати декілька місяців або років [15]. Найпоширенішими причинами гострої кропив’янки, яка може вражати до 15-25% людей протягом життя, є вірусні інфекції (особливо ті, що вражають верхні дихальні шляхи), харчова алергія та побічні реакції на ліки [13]. Фізичний вплив, системні захворювання або тривала інфекція також можуть призвести до розвитку кропив’янки/ангіоневротичного набряку [15, 16]. У пацієнтів із хронічною кропив’янкою стан часто є ідіопатичним (причина невідома у 55-80% випадків), його визначають як хронічну спонтанну кропив’янку [14]. Її аналогом є хронічна індукована кропив’янка, спричинена такими фізичними подразниками, як холод, тепло, сонце або тиск [4].
Поширеність хронічної спонтанної кропив’янки в усьому світі становить 0,5-1,0% [1, 17]. Піковий вік зазвичай припадає на 20-40 років, а типова тривалість захворювання становить 1-5 років, хоча у багатьох випадках може бути більше. Як і у випадку з АР, хронічна кропив’янка може мати серйозний негативний вплив на якість життя пацієнтів. Через емоційний дистрес пацієнти з хронічною спонтанною кропив’янкою часто мають тривогу, депресію та соматоформні розлади. Як наслідок, суспільний тягар захворювання є великим з точки зору як прямих, так і непрямих витрат на охорону здоров’я [17, 18].
Роль гістаміну та H1-рецепторів у розвитку IgE-опосередкованих алергічних захворювань
Гістамін відіграє ключову роль у патофізіології алергічного запалення. Після контакту з алергеном у генетично схильних осіб виробляються специфічні антитіла типу імуноглобуліну Е (IgE), які взаємодіють з рецепторами на поверхні базофілів і тучних клітин. Наслідком цього є серія внутрішньоклітинних реакцій, що завершуються екзоцитозом і вивільненням гістаміну та інших медіаторів запалення, таких як фактор активації тромбоцитів і цитокіни. Наслідки вивільнення гістаміну включають рецептор-опосередковане скорочення клітин гладких м’язів у шлунково-кишковому тракті (ШКТ) та дихальних шляхах, стимуляцію сенсорних нервів, розширення судин, екстравазацію плазми та рекрутування клітин. Ці ефекти призводять, серед іншого, до розвитку еритеми, почервоніння, закладеності носа і свербежу [4, 19]. Окрім медіаторної активності при ранній алергічній відповіді, гістамін сприяє пізній алергічній відповіді, стимулюючи вироблення молекул клітинної адгезії, антигенів класу II та цитокінів [19].
Існують 4 основних підтипи гістамінових рецепторів: H1, H2, H3 і H4. Вони передають позаклітинні сигнали через G-білки, що діють як посередники між рецепторами клітинної поверхні і внутрішньоклітинними вторинними месенджерами (рис. 1). Рецептори H1 і H2 доволі поширені в організмі, підтип H3 локалізується переважно в центральній нервовій системі (ЦНС), а підтип Н4 – у кровотворних тканинах [19]. Алергічна відповідь в основному опосередкована підтипом рецептора Н1.
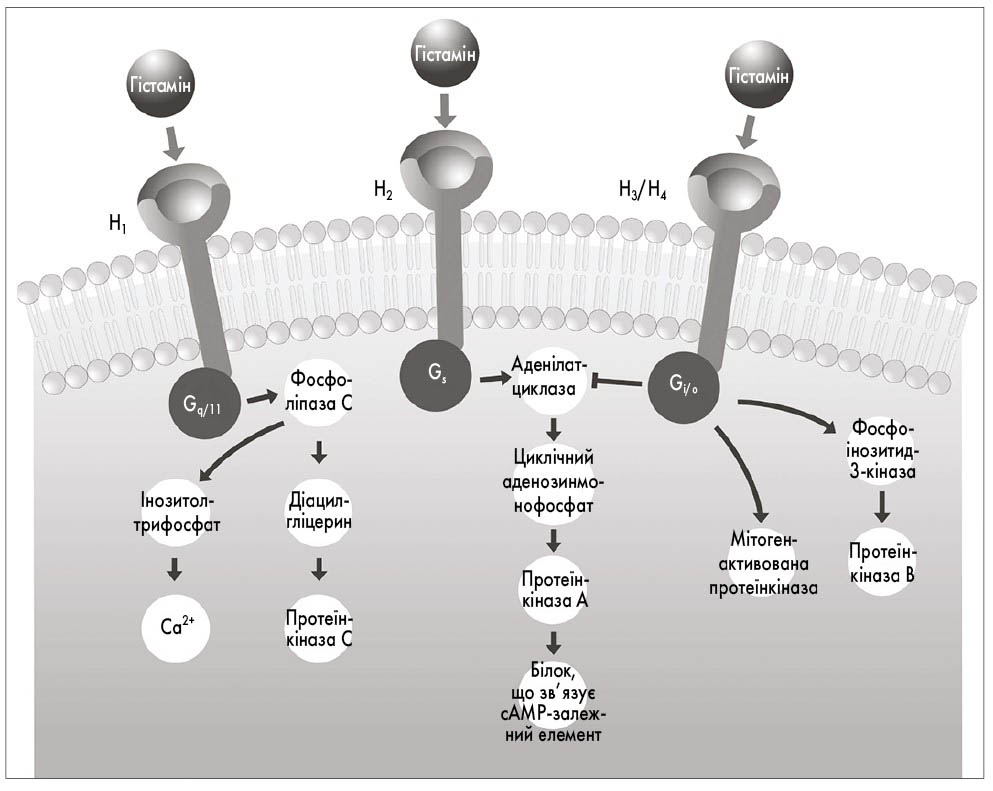 Рис. 1. Внутрішньоклітинні сигнальні процеси, опосередковані G-білками, після взаємодії гістаміну з рецепторами кожного підтипу
Рис. 1. Внутрішньоклітинні сигнальні процеси, опосередковані G-білками, після взаємодії гістаміну з рецепторами кожного підтипу
H1-рецептори є всюдисущими і знаходяться у мозковій речовині наднирникових залоз, ЦНС, ендотеліальних та епітеліальних клітинах, серці, імунних клітинах, сенсорних нервах і гладких м’язах. У ЦНС більшість постсинаптичних дій гістаміну опосередковується H1-рецепторами. Це призводить до активності в циклах «сон – неспання» і, ймовірно, пояснює седативну дію антигістамінних препаратів I покоління, які перетинають гематоенцефалічний бар’єр. Через H1-рецептори гістамін також спричиняє скорочення клітин гладких м’язів ШКТ і дихальних шляхів і стимуляцію сенсорних нервів. Наслідки цього включають свербіж, чхання, підвищення проникності судин і набряк [16, 19].
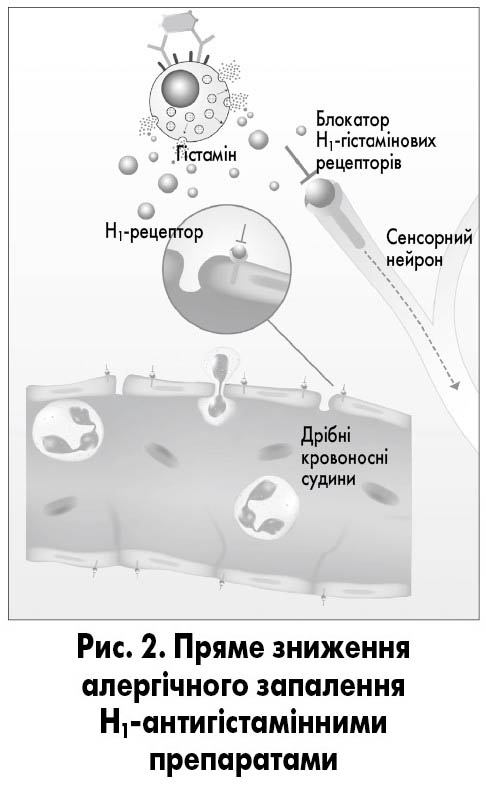 Антигістамінні препарати структурно не пов’язані з гістаміном і не є конкурентними антагоністами зв’язування гістаміну з H1-рецепторами; скоріше, антигістамінні препарати зв’язуються з іншими ділянками на рецепторах H1 [20]. Коли H1-антигістамінні препарати зв’язуються з H1-рецепторами, вони перешкоджають дії гістаміну на сенсорні нейрони і дрібні кровоносні судини, безпосередньо знижуючи алергічне запалення (рис. 2). Це також відбувається опосередковано через ядерний транскрипційний фактор-κB і канали іонів кальцію [21].
Антигістамінні препарати структурно не пов’язані з гістаміном і не є конкурентними антагоністами зв’язування гістаміну з H1-рецепторами; скоріше, антигістамінні препарати зв’язуються з іншими ділянками на рецепторах H1 [20]. Коли H1-антигістамінні препарати зв’язуються з H1-рецепторами, вони перешкоджають дії гістаміну на сенсорні нейрони і дрібні кровоносні судини, безпосередньо знижуючи алергічне запалення (рис. 2). Це також відбувається опосередковано через ядерний транскрипційний фактор-κB і канали іонів кальцію [21].
Властивості «ідеального» антигістамінного препарату
Рекомендації «Алергічний риніт і його вплив на бронхіальну астму» (Allergic Rhinitis and its Impact on Asthma, ARIA) передбачають, що перш ніж призначити фармакотерапію, слід розглянути наступні відповідні фактори: ефективність, безпеку, економічну ефективність лікування, переваги для пацієнта, цілі лікування, очікуване дотримання лікування, тяжкість захворювання та контроль, а також наявність супутніх захворювань [6]. Рекомендації також надають детальний перелік властивостей, яким повинні відповідати пероральні H1-антигістамінні препарати. Фундаментальними серед них є сильна та вибіркова блокуюча активність щодо Н1-рецепторів, швидкий початок дії та її тривалість, ефективність при алергічному ринокон’юнктивіті (зняття усіх симптомів, включаючи закладеність носа), відсутність взаємодії з цитохромом CYP450, відсутність седативного впливу, когнітивних або психомоторних порушень, антихолінергічної активності, занепокоєння щодо безпеки з боку серця і відсутність потенціалу тахіфілаксії [6].
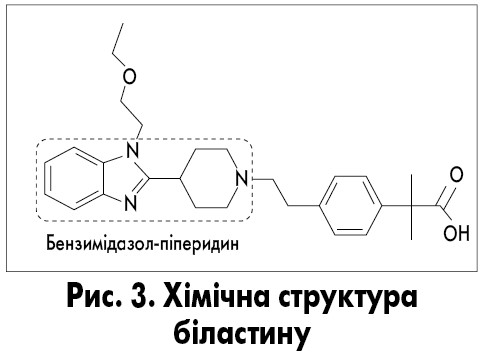
Біластин – сучасний H1-антигістамінний препарат II покоління, який має найбільшу кількість бажаних властивостей серед сучасних антигістамінних препаратів, відповідно до міжнародних рекомендацій ARIA (рис. 3, табл. 1).
 Фармакокінетичний профіль біластину
Фармакокінетичний профіль біластину
У здорових добровольців, які отримували одноразову дозу біластину 20 мг перорально, середня пікова концентрація препарату в плазмі крові (Cmax) становила 220 мкг/л і була досягнута через 1,3 год після прийому (tmax). Об’єм розподілу становив 1,29 л/кг, кінцевий період напіввиведення (t1/2β) – 14,5 год, загальний кліренс – 18,1 л/год; біластин зв’язувався з білками плазми крові на 84-90% [22].
Біодоступність біластину при пероральному прийомі становить близько 60% [23]. Однак у здорових добровольців, які отримували разову дозу 20 мг, одночасний прийом їжі знижував біодоступність препарату на 30% (їжа з високим вмістом жиру) або 25% (їжа з низьким вмістом жиру) порівняно з прийомом натщесерце. Одночасний прийом грейпфрутового соку також знижує біодоступність біластину на 30%. Тому препарат рекомендують приймати натщесерце.
Біластин суттєво не взаємодіє ні як інгібітор, ні як індуктор з ферментною системою CYP [24] і не піддається значному метаболізму в організмі людини.
Біластин можна призначати перорально пацієнтам незалежно від швидкості клубочкової фільтрації [25]. Пацієнтам із легким, помірним або тяжким порушенням функції нирок коригувати дозу не потрібно. Однак пацієнтам із помірно-тяжкою нирковою недостатністю, які отримують лікування інгібіторами Р-глікопротеїну (циклоспорином, дилтіаземом та ін.), біластин не слід призначати; ці препарати можуть підвищувати рівень біластину в плазмі крові та ймовірність виникнення побічних ефектів. Корекція дози пацієнтам із порушенням функції печінки не потрібна [26].
Ефективність біластину
Сезонний АР
У двох багатоцентрових рандомізованих подвійних сліпих плацебо-контрольованих дослідженнях за участю 1402 пацієнтів із сезонним АР ефективність біластину порівнювали з цетиризином [27] і дезлоратадином [28].
В одному дослідженні [27] протягом 2-тижневого періоду лікування пацієнтів біластин і цетиризин продемонстрували однакову ефективність: обидва препарати значно знизили загальну оцінку симптомів порівняно із плацебо. Зниження частоти і вираженості симптомів, а саме закладеності носа, ринореї, чхання та свербежу, порівняно з вихідним рівнем було достовірно вищим (р<0,001) при прийомі біластину (42,4%) і цетиризину (48,2%), ніж плацебо (26,9%). Те саме було вірно для таких симптомів, як сльозотеча, почервоніння, свербіж: відповідні зміни від вихідного рівня становили 49,8, 51,0 та 27,6%. В іншому дослідженні [28] отримані результати подібні до результатів першого дослідження для біластину і дезлоратадину порівняно із плацебо протягом 2-тижневого періоду лікування. Середнє значення первинної кінцевої точки дослідження – площі під кривою (area under the curve, AUC) за шкалою загальних симптомів (total symptom score, TSS; AUCTSS) було значно нижчим (р<0,001) для біластину (98,4) і дезлоратадину (100,5), ніж для плацебо (118,4).
У дослідженні Vienna Challenge Chamber study, проведеному поза сезоном пилку у 75 осіб із безсимптомним сезонним АР, антигістамінний препарат або плацебо вводили безпосередньо перед провокацією алергеном [29]. Три досліджувані антигістамінні препарати – біластин, цетиризин і фексофенадин – були статистично значуще ефективними (р<0,001) щодо середнього зниження назальних симптомів порівняно із плацебо в усі періоди, включаючи ранні (1-4 год) і пізні (22-26 год) після прийому дози. Проте в останній момент часу біластин (р=0,0012) і цетиризин (р<0,001) були значно ефективнішими, ніж фексофенадин [27]. Це свідчить про те, що біластин і цетиризин мають біль тривалу дію, ніж фексофенадин [29].
Біластин показаний при алергічному ринокон’юнктивіті, у той час як не всі антигістамінні препарати мають це специфічне показання (табл. 1). Аналіз клінічних випробувань біластину показав, що цей препарат значно ефективніший, ніж плацебо, для полегшення очних симптомів (р<0,001), включаючи такі симптоми, як свербіж, сльозотеча та почервоніння кон’юнктиви [30].
Цілорічний АР
У рандомізованому подвійному сліпому плацебо-контрольованому дослідженні, проведеному в Європі, Аргентині та Південній Африці, порівнювали ефективність біластину з цетиризином і плацебо протягом 4 тиж у 651 пацієнта з цілорічним АР. У відкриту продовжену фазу 513 пацієнтів отримували біластин у дозі 20 мг 1 раз на день протягом 12 міс, що є найтривалішим на сьогодні аналізом будь-якого антигістамінного препарату. Не виявлено статистично значущої різниці між групами в AUCTSS від вихідного рівня до 28-го дня. Проте ефект залежав від регіону: первинна ефективність була значно кращою в групах застосування антигістамінних препаратів порівняно із плацебо в Європі та Аргентині (р=0,039). Суттєвої різниці в Південній Африці не виявлено; пацієнти повідомили про відносно високий рівень відповіді на плацебо. При продовженні терміну дослідження продемонстровано, що біластин був безпечним і добре переносився під час тривалого застосування [31]. Доведена ефективність біластину при цілорічному АР важлива для регіону Південно-Східної Азії, враховуючи велику кількість осіб зі стійким АР у цій частині світу.
Кропив’янка
У 4-тижневому багатоцентровому рандомізованому подвійному сліпому плацебо-контрольованому дослідженні порівнювали ефективність біластину і левоцетиризину у 525 пацієнтів із хронічною ідіопатичною кропив’янкою [32]. Біластин і левоцетиризин були однаково ефективними і значно ефективнішими, ніж плацебо (р<0,001), щодо зниження тяжкості свербежу, кількості і максимального розміру пухирців протягом 2 тиж і 4 тиж. Більш значні покращення, ніж при прийомі плацебо, відзначені при оцінці дерматологічного індексу якості життя (Dermatology Life Quality Index): 9,45, 8,94 і 5,93 для біластину, левоцетиризину та плацебо відповідно.
Біластин є більш ефективним, ніж цетиризин, щодо обмеження ранньої алергічної відповіді, згідно з результатами дослідження [33]. У дослідженні добровольці отримували одноразову пероральну дозу біластину 20 мг, цетиризину 10 мг або плацебо до провокування шкірних пухирів та алергічної відповіді. Через 1,5 год після провокації спостерігали значно більше пригнічення реакції серед тих, хто отримував біластин, ніж у тих, хто отримував цетиризин або плацебо (р<0,02).
Спонтанна кропив’янка є найпоширенішою формою, у той час як близько 25% пацієнтів із кропив’янкою мають індуковану форму [34]. У рандомізованому подвійному сліпому плацебо-контрольованому 7-денному дослідженні біластин оцінювали в різних дозах, від рекомендованої дози 20 мг до 4-кратної (80 мг 1 раз на день), у пацієнтів із набутою холодовою кропив’янкою. Кількість пацієнтів без симптомів становила 60%. Частота побічних ефектів при застосуванні біластину в усіх дозах (20, 40 і 80 мг) була подібною до плацебо, що демонструє, що біластин добре переноситься навіть при застосуванні в дозах, які у 2-4 рази перевищують рекомендовану добову.
Застосування супратерапевтичних доз біластину у пацієнтів із холодовою кропив’янкою відповідає рекомендаціям міжнародних настанов. Спільні рекомендації Європейської академії алергології та клінічної імунології (European Academy of Allergy and Clinical Immunology, EAACI), Глобальної європейської мережі з алергії та бронхіальної астми (Global Allergy and Asthma European Network, GA2 LEN), Європейського дерматологічного форуму (European Dermatology Forum, EDF) і Всесвітньої алергологічної організації (World Allergy Organization, WAO) чітко визначають, що «сучасні H1-антигістамінні препарати II покоління застосовують як лікування 1-ої лінії кропив’янки» [4]. Крім того, рекомендовано «випробувати до 4-кратної дози сучасних H1-антигістамінних препаратів II покоління як терапію 2-ої лінії в алгоритмі лікування» з метою досягнення повного контролю над симптомами, оскільки більше однієї третини пацієнтів із хронічною кропив’янкою не піддаються терапії стандартними дозами антигістамінних препаратів [11].
Порівняння даних клінічних випробувань антигістамінних препаратів II покоління при хронічній кропив’янці свідчить, що доза біластину 80 мг/добу значно ефективніша, ніж супратерапевтичні дози дезлоратадину і левоцетиризину [35]. Однак застосування цих препаратів у дозах, що в 4 рази перевищують стандартну, безумовно, може викликати занепокоєння щодо безпеки (підвищення седативного потенціалу, подовження інтервалу QTc). У той самий час біластин у терапевтичних і супратерапевтичних дозах у здорових добровольців не мав значного впливу на реполяризацію шлуночків. Не виявлено клінічно значущого впливу на інтервал QTc при застосуванні препарату у дозах 20 і 100 мг.
Безпека біластину
База даних щодо безпеки біластину включає >5000 осіб, які брали участь у добре спланованих клінічних дослідженнях. Загалом >3000 пацієнтів отримували біластин зазвичай у дозі 20 мг 1 раз на день протягом 2-4 тиж [36]. Частота побічних ефектів, пов’язаних з лікуванням, помітно не відрізнялася між біластином (12,7%) і плацебо (12,8%) та іншими антигістамінними препаратами: цетиризином (14,3%), дезлоратадином (11,6%) і левоцетиризином (15,8%). Частота побічних явищ, пов’язаних із лікуванням, з боку ЦНС була подібною між біластином і плацебо. Головний біль і запаморочення показали однакову частоту в усіх групах активного лікування і плацебо. Сонливість виникала з однаковою частотою в отримувачів біластину (3,5%) і плацебо (2,9%). Однак застосування цетиризину асоціювалося з вищою частотою сонливості (7,6%; р<0,001), ніж прийом біластину, а левоцетиризину – з вищою частотою (6,1%; р<0,05), ніж плацебо.
У широкомасштабному рандомізованому подвійному сліпому дослідженні за участю 683 пацієнтів із сезонним АР прийом біластину порівняно з цетиризином асоціювався зі значно меншою частотою всіх пов’язаних із прийомом препарату подій (14,5 проти 24,6%; р≤0,01), втомлюваності (0,4 проти 4,8%; р≤0,01) і сонливості (1,8 проти 7,5%) [27]. Ці дані свідчать про те, що в повсякденній клінічній практиці біластин має кращий профіль безпеки і терапевтичний індекс, ніж цетиризин.
Біластин у високих дозах (40 або 80 мг 1 раз на день), відповідно до рекомендацій EAACI/GA2 LEN/EDF/WAO 4, продемонстрував ефективність у лікуванні кропив’янки [34]. У пацієнтів із набутою холодовою кропив’янкою біластин добре переносився без збільшення частоти седації при застосуванні в дозі до 80 мг/день.
Вплив біластину в дозі 80 мг на ЦНС також оцінювали на здорових добровольцях [37]. Хоча результати об’єктивних тестів виявили незначні порушення, високі дози біластину істотно не змінили суб’єктивні результати. Ефекти біластину в дозі 80 мг були еквівалентними таким стандартної дози гідроксизину.
Відсутність седації
У кількох дослідженнях з використанням «групи активного контролю», що включала препарат I покоління гідроксизин, біластин у стандартній (20 мг 1 раз на день) і вищій дозі (40 мг 1 раз на день) в одному дослідженні [38] та разовій дозі 80 мг в іншому [37] не мав значного впливу на психомоторні показники і здатність керувати автомобілем. Крім того, при застосуванні біластину водночас з лоразепамом ступінь психомоторних порушень був подібним до такого, коли лоразепам застосовували окремо [36]. Не виявлено жодної взаємодії між вживанням алкоголю і застосуванням біластину у стандартній дозі.
Дослідження із застосуванням позитронно-емісійної томографії зайнятості H1-рецепторів головного мозку за участю 12 здорових добровольців показало, що цей параметр був близький до нуля для біластину (–3,92%), отже, подібний до плацебо. Навпаки, препарат I покоління гідроксизин мав значно більшу зайнятість (+54%) [39]. Це підтверджує, що біластин має відносно обмежений потенціал для проходження через гематоенцефалічний бар’єр і взаємодії з H1-рецепторами ЦНС. Беручи до уваги опубліковані дані щодо інших агентів, виходить, що біластин має найнижчий рівень зайнятості H1-рецепторів головного мозку з усіх доступних антигістамінних препаратів (табл. 2), тому має мінімальну здатність викликати побічні ефекти з боку ЦНС.
|
Таблиця 2. Зайнятіость H1рецепторів головного мозку після перорального прийому антигістамінних препаратів за даними позитронноемісійної томографії |
||
|
Препарат |
Доза, мг |
Середня зайнятість H1рецепторів, % |
|
Біластин |
20 |
–3,92 |
|
Фексофенадин |
120 |
–0,1 |
|
Ебастин |
10 |
9,914,4 |
|
Терфенадин |
60 |
12,117,2 |
|
Азеластин |
1 |
20,3 |
|
Цетиризин |
20 |
26,0 |
|
dхлорфенірамін |
1 |
40,4 |
|
Гідроксизин |
25 |
53,95 |
|
dхлорфенірамін |
2 |
60,476,8 |
|
dхлорфенірамін |
5 |
85,5 |
Відсутність подовження QTc
Сьогодні біластин є єдиним комерційно доступним антигістамінним препаратом, який пройшов випробування за суворими критеріями Міжнародної конференції з гармонізації технічних вимог до фармацевтичної продукції (International Conference on Harmonization, ICH) щодо впливу на інтервал QT. Підтверджено, що біластин у стандартній дозі має хороший профіль кардіологічної безпеки, а підвищення дози до 220 мг або введення препарату з інгібіторами CYP450 або Р-глікопротеїну не змінює цей профіль безпеки [40, 41]. У клінічних дослідженнях застосування біластину не асоціювалося з жодним клінічно значущим подовженням інтервалу QTc [36].
Застосування біластину у дітей
Ефективність і безпека біластину у дітей віком <12 років, які часто мають алергічні розлади, наразі не встановлені. Для реєстрації лікарської форми біластину для дорослих клінічний план розроблений відповідно до рекомендацій Європейського агентства з лікарських засобів (European Medicines Agency), тому граничний вік застосування препарату становить 12 років.
Висновок
Наразі існує низка незадоволених потреб у лікуванні алергічних станів, причому багато пацієнтів відмічають седацію при застосуванні «старих» антигістамінних препаратів. Після того як у 1980-х роках були представлені H1-антигістамінні препарати II покоління, вони зробили революцію в лікуванні алергічних розладів через відсутність або мінімальний седативний потенціал.
Доведена ефективність і профіль безпеки біластину, його низький потенціал щодо впливу на ЦНС при одночасному застосуванні з алкоголем, метаболічної взаємодії між лікарськими засобами та відсутність необхідності коригування дози підтверджують, що цей препарат посідає перше місце серед H1-антигістамінних препаратів II покоління в лікуванні кропив’янки та АР, включаючи алергічний ринокон’юнктивіт.
Огляд підготовлено за матеріалами: X.Y. Wang, M. Lim-Jurado, N. Prepageran et al. Treatment of allergic rhinitis and urticaria: a review of the newest antihistamine drug bilastine. Ther. Clin. Risk Manag., 2016; 12: 585-597.
doi: 10.2147/TCRM.S105189.
Cписок літератури знаходиться в редакції.
Підготувала Віталіна Хмельницька
Тематичний номер «Педіатрія» № 1 (72) 2024 р.
СТАТТІ ЗА ТЕМОЮ Алергія та імунологія
Серед препаратів, які мають велику доказову базу щодо лікування пацієнтів із захворюваннями дихальних шляхів з алергічним компонентом, особливий інтерес становлять антагоністи лейкотрієнових рецепторів (АЛТР). Ці препарати мають хорошу переносимість у дорослих та дітей, а також, на відміну від інгаляційних кортикостероїдів (ІКС), характеризуються високим комплаєнсом, тому посідають чільне місце в лікуванні пацієнтів із респіраторною патологією. У лютому відбувся міждисциплінарний конгрес із міжнародною участю «Життя без алергії International» за участю провідних вітчизняних міжнародних експертів. Слово мав президент Асоціації алергологів України, професор кафедри фтизіатрії та пульмонології Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук Сергій Вікторович Зайков із доповіддю «Місце АЛТР у лікуванні пацієнтів із респіраторною патологією». ...
Розбір клінічного випадку...
Організм людини – це складна жива система, функціонування якої визначається безліччю змінних і задіює величезну кількість механізмів. Зовнішні і внутрішні чинники здатні порушувати регуляцію її діяльності. Однак є механізми, які допомагають ефективно усувати «поломки» в організмі і нормалізувати його стан. Така здатність має назву біорегуляції. Основою біорегуляційної медицини є комплексні біорегуляційні препарати, серед яких одним із найвідоміших є Ехінацея Композитум С. ...
Проблема гострих запальних захворювань верхніх дихальних шляхів (ВДШ), гострого риносинуситу (ГРС) зокрема, є однією з найактуальніших у сучасній клінічній медицині. Останніми роками спостерігають зростання частоти захворювань носа і приносових пазух, що проявляється збільшенням як абсолютних (захворюваності та поширеності), так і відносних (частка в структурі оториноларингологічної патології) показників. В Україні поширеність гострих ринітів, риносинуситів та ринофарингітів сягає 489,9 випадку на 10 тис. населення, а захворюваність – 5-15 випадків на 1 тис. населення залежно від сезону. Такі хворі становлять 60-65% амбулаторних пацієнтів лікарів-отоларингологів. Уніфікований клінічний протокол первинної та спеціалізованої медичної допомоги (УКПМД) призначений забезпечити організацію надання медичної допомоги пацієнтам із ГРС на всіх етапах медичної допомоги для своєчасного виявлення, профілактики та лікування ГРС. ...