Мелатонін у лікуванні розладів сну після травматичного ушкодження головного мозку
Черепно-мозкова травма (ЧМТ) є однією з основних причин захворюваності та смертності в усіх країнах світу. Щороку ≈69 млн людей отримують ЧМТ, а рівень глобальної захворюваності за цим показником становить майже 1/100 [1, 2]. Пацієнти із ЧМТ відчувають складну сукупність симптомів, які сильно відрізняються між окремими особами та зберігаються протягом декількох років після початкової травми [3, 4].
Порушення нормального режиму сну після ЧМТ будь-якого ступеня тяжкості є однією з найпоширеніших скарг як у гострій, так і в хронічній фазах одужання; спостерігається в 30-70% пацієнтів [5-7]. З огляду на високу поширеність та негативний вплив розладів сну на здоров’я після ЧМТ втручання, які оптимізують сон, можуть надати одну з найкращих можливостей для покращення довгострокових результатів.
Доклінічні дослідження мелатоніну
Незважаючи на щоразу більше розуміння важливості дисфункції сну після ушкодження центральної нервової системи (ЦНС), детальні патогенетичні механізми цих порушень залишаються здебільшого невідомими, оскільки вони, ймовірно, є багатовимірними залежно від характеру травми та індивідуальних супутніх захворювань. Ідеальний терапевтичний засіб для лікування таких станів має пом’якшувати один або декілька механізмів ушкодження, а також водночас характеризуватися високим профілем безпеки й ефективності. Протягом останніх двох десятиліть одним із таких засобів є мелатонін, адже це потужний антиоксидант, який має функції сигнального гормона, регулюючи сон і циркадні фізіологічні процеси [13-15].
У нещодавньому дослідженні із залученням лабораторних тварин учені констатували, що лікування мелатоніном (як антиоксидантним агентом) чинить нейропротекторний ефект, одночасно долаючи окислювальний стрес і виснаження енергії та зменшуючи нейрозапалення й нейродегенерацію [178]. Моделлю ЧМТ у цьому дослідженні були лабораторні миші-самці, яким у ході роботи вводили мелатонін. Дослідники зауважили, що ЧМТ зумовлює енергетичний дисбаланс мозку, знижує виживання нейрональних клітин, а лікування мелатоніном долає енергетичне виснаження через регуляцію мітохондріальної системи, захищає від ушкодження ЦНС регулювальні сигнальні шляхи. Під час проведення іншого випробування вчені також помітили нейропротекторну дію препарату та довели, що внутрішньочеревне введення мелатоніну було пов’язано з ослабленим вторинним ушкодженням мозку після внутрішньомозкового крововиливу на моделях щурів [161]. Переваги включали значне зниження показників окислювального стресу, запалення та ушкодження ДНК, зниження прозапальних цитокінів, підвищення рівня антиоксидантного білка, зменшення розміру інфаркту, покращення сенсомоторного функціонального дефіциту на ранніх термінах [160, 161].
В іншій роботі, присвяченій доклінічній оцінці дії мелатоніну на ЦНС, дослідники вивчали його вплив на регенерацію коркових нейронів у щурів із ЧМТ [180]. Виявилося, що церебральний кровоток у групі тварин із ЧМТ, що отримували мелатонін, був вищим, ніж у групі з ЧМТ без препарату. Когнітивні функції щурів виявилися кращими в групі ЧМТ + мелатонін, ніж у групі ЧМТ (p<0,05). Показники окисного стресу в групі ЧМТ + мелатонін були нижчими, ніж у групі ЧМТ (p<0,05).
Саме через те, що мелатонін є потужним нейропротекторним і протизапальним засобом, він демонструє перспективні результати при ЧМТ. У великому метааналізі австралійські вчені провели систематичну оцінку доклінічної та клінічної літератури щодо ефективності мелатоніну [36]. Вони проаналізували результати 17 досліджень (15 доклінічних, 2 клінічних). Аналіз доклінічних даних виявив загальний позитивний вплив на нейроповедінковий результат – стандартизована різниця середніх (СРС) склала 1,51 (95% довірчий інтервал (ДІ) 1,06-1,96). Лікування мелатоніном чинило сприятливий вплив на неврологічний статус (СРС 1,35; 95% ДІ 0,83-1,88) і когнітивні функції (СРС 1,16; 95% ДІ 0,4-1,92). З огляду на це дослідники дійшли висновку, що лікування мелатоніном після ЧМТ значно покращує як поведінкові, так і окремі неврологічні результати.
ЧМТ і розлади сну
Розлади сну є поширеними після ЧМТ. Доведено, що ризик розвитку безсоння, обструктивного апное уві сні, порушень циркадного ритму «сон – неспання» підвищується після ЧМТ [60]. В огляді наявних літературних даних американські вчені виявили таку поширеність розладів сну в пацієнтів із ЧМТ: апное сну (23%), посттравматична гіперсомнія (11%), періодичні порушення рухів кінцівок (7%) і нарколепсія (6%) [63]. Однією особливо важливою змінною, пов’язаною з початком і тяжкістю дисфункції сну після ЧМТ, є хронізація, за якої спостерігаються виражені відмінності між гострою та хронічною фазами. Гостро після травми скарги на сон спостерігаються в ⅓ пацієнтів протягом перших 10 днів, збільшуючись до половини хворих упродовж 6 тиж [67, 68]. В окремому дослідженні визначено, що 84% пацієнтів із тяжкою ЧМТ підтвердили дисфункцію сну під час госпіталізації, яка зберігалася в 66% хворих через 1 міс після травми [72]. Було виявлено, що ті пацієнти, які демонструють гостру дисфункцію сну, мають підвищений ризик головних болів, депресії та дратівливого настрою.
Патофізіологія дисфункції сну, асоційованої з ЧМТ
Механізми, що лежать в основі дисфункції сну після ЧМТ, можна розподілити за хронізацією та подальшими мікроскопічними чи макроскопічними ефектами. При гострому ушкодженні відбуваються зсув аксонів і дифузне переривання функціональних мереж, теоретично включаючи такі, що пов’язані з неспанням і сном [73]. Відтерміновані механізми, що провокують ушкодження, містять гіпоксемію, гіпотензію, підвищення внутрішньочерепного тиску, судоми та утворення гематом.
Після ЧМТ спостерігається інтенсивне вивільнення запальних цитокінів, які функціонують як вроджений механізм для стабілізації паренхіматозного мікрооточення ЦНС [74, 75]. Після первинного ушкодження вивільняються медіатори запальних каскадів, які, своєю чергою, сприяють активації та інтеграції імунних клітин і сигнальних молекул у церебральне мікрооточення [75]. Вторинні ушкодження можуть подовжити лікування та завадити повному своєчасному одужанню.
Фізіологія мелатоніну
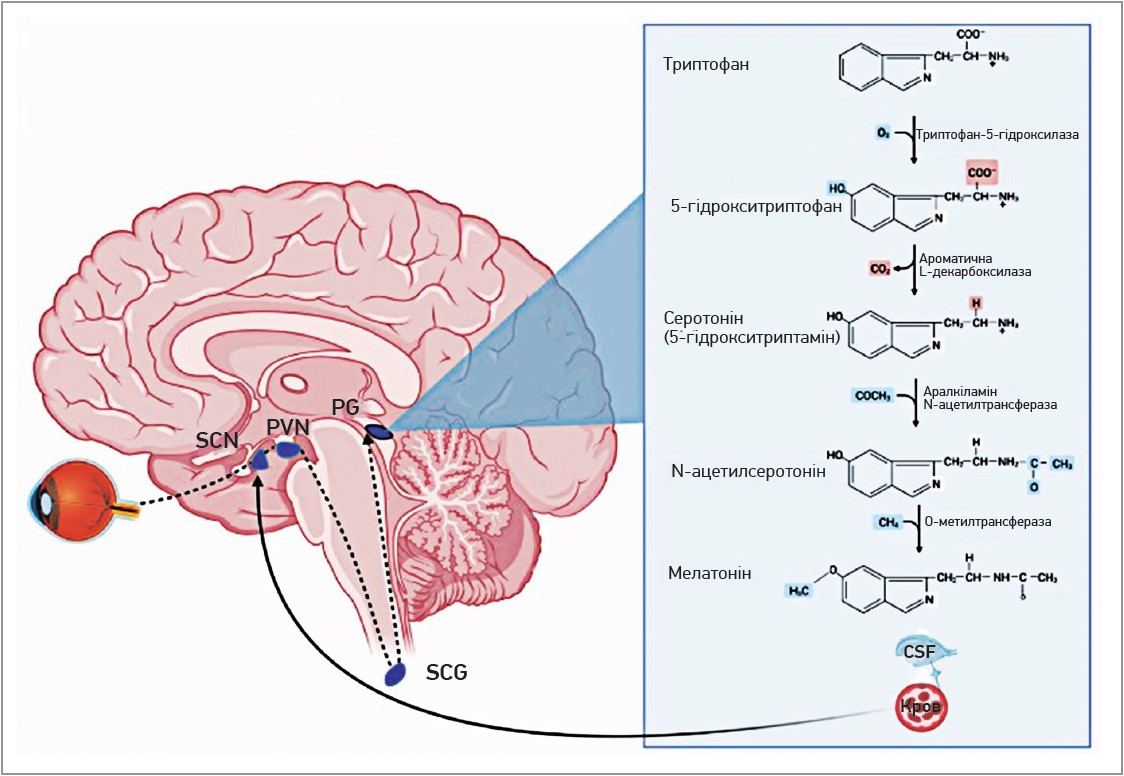
Мелатонін, спочатку виділений дерматологами в 1958 році з шишкоподібної залози великої рогатої худоби, був названий завдяки своїй здатності відбілювати клітини шкіри шляхом інгібування гормона, що стимулює меланоцити [82]. Залежне від світла гальмування синтезу мелатоніну є порівняно новим еволюційним розвитком, а шишкоподібна залоза – єдиний ендокринний орган, на який впливає активність нейронів (від фотоперіоду), переважно секретуючи мелатонін у найвищих концентраціях уночі (рис. 1).
Рис. 1. Нейроендокринний шлях, коли світло проходить через сітківку, супрахіазматичне ядро (SCN), паравентрикулярне ядро (PVN), верхній шийний ганглій (SCG) і шишкоподібну залозу (PG)
Примітка: CSF – спинномозкова рідина.
Мелатонін синтезується в усіх тканинах і типах клітин, причому більшість виробляється мітохондріями [83], меншою мірою – в цитозолі [84]. Схоже, що пул сироваткових і тканинно-залежних концентрацій отримує внесок від шишкоподібної залози, їжі, мікробіоти та невидимого ближнього інфрачервоного випромінювання [87]. Останнє проникає на декілька сантиметрів у людське тіло, викликаючи залежне від дози збільшення вироблення мелатоніну, ймовірно, для протидії УФ‑ушкодженню від сонця [88]. Так, 4-годинний період важких фізичних вправ на свіжому повітрі викликає пік мелатоніну приблизно втричі вищий, ніж нічний циркадний пік, зі швидкістю збільшення в ≈33 рази [89]. Схоже, що цей зв’язок свідчить про кореляцію між метаболічними процесами / діяльністю та рівнями мелатоніну, як показано на рисунку 2.
Рис. 2. Рівень мелатоніну в плазмі як функція часу під час важких фізичних вправ і циркадних часових змін [89]
Вплив мелатоніну на ДНК, поглинання вільних радикалів передували його впливу на сон на ≈2,5 млрд років, про що свідчить його виробництво в безхребетних, рослинах і одноклітинних [90]. Вироблення вільних радикалів необхідне для декількох фізіологічних процесів, включаючи продукування енергії у мітохондріях, клітинний апоптоз, ремоделювання цитоскелета після травми, нормальну функцію вродженої та адаптивної імунної системи. Протизапальні властивості мелатоніну зменшують шкідливе нейрозапалення, яке порушує нормальну функцію мозку [76, 102, 103] через цитокінетичну дію й опосередковане зниження медіаторів запалення, як-от оксид азоту та малоновий діальдегід [104].
Вплив ЧМТ на синтез мелатоніну
Було показано, що в пацієнтів із ЧМТ вироблення мелатоніну ввечері знижується на 42% порівняно зі здоровими особами з контрольної групи [130], що спричиняє вищий поріг чутливості для початку та підтримки сну, причому найвираженішим ефектом на архітектуру сну є зниження загальної фази швидкого сну. Численні дослідження демонструють зміну секреції мелатоніну порівняно з контрольною групою як у гострій, так і в хронічній фазах відновлення [31, 130, 131], однак ці випробування є невеликими та відносно обмежені тяжкою ЧМТ.
Хоча дані свідчать про зниження як мелатоніну, так і його рецепторів після ЧМТ, механізм цього зниження залишається незрозумілим [31, 130, 131]. Імовірно, це пов’язано з тим, що мелатонін може метаболізуватися швидше після ЧМТ завдяки поглинанню вільних радикалів. Можливо, він виходить через ушкоджений гематоенцефалічний бар’єр або руйнується після ЧМТ. Окрім того, сама шишкоподібна залоза може бути чутливою до травматичних ушкоджень, що порушує найбільший внесок системного мелатоніну в організм [134].
Терапевтичний потенціал мелатоніну за ЧМТ: циркадні розлади та порушення сну
Потенціал мелатоніну як терапевтичного засобу для лікування дисфункції сну після ЧМТ пояснюється його здатністю змінювати циркадні ритми й індукувати сон, опосередковуючи нейрозапалення. Загальні режими дозування за безсоння можуть варіюватися від 1 до 5 мг [141], але можуть бути від 200 мкг до 50 мг [142]; зазвичай приймаються за деякий час до сну через його швидке всмоктування та нетривалий період напіврозпаду. В нещодавно проведеному огляді, який включав 5 рандомізованих контрольованих досліджень (РКД), учені не виявили серйозних побічних ефектів прийому мелатоніну в дорослих чи підлітків [42]. Докази впливу мелатоніну на людей з і без ЧМТ неоднозначні. В популяції без ЧМТ прийом мелатоніну надає незначну користь для початку сну, але не забезпечує його підтримки [36, 144]. Ці результати ускладнюються різницею в дозах, часу з моменту травми та індивідуальними фізіологічними відмінностями, які впливають на розмір ефекту. Проте було показано, що мелатонін є ефективним у лікуванні дітей із безсонням, пов’язаним із ЧМТ [145], а також має нейропротекторний ефект у педіатричних пацієнтів із ЧМТ [36].
Одне РКД продемонструвало, що прийом мелатоніну може бути ефективним для відновлення циклу сну та неспання з позитивним впливом на денну втому [43]. Виявлено, що мелатонін регулює ритм сну та неспання, є корисним при розладах сну після ЧМТ [40]. Отже, терапевтичний потенціал мелатоніну для лікування розладів сну та неспання після ЧМТ є перспективним.
Терапевтичний потенціал мелатоніну при ЧМТ: антиоксидант і протизапальний засіб
Прийом мелатоніну після ЧМТ може надати користь через його потужні протизапальні та антиоксидантні властивості. Ушкодження ЦНС часто спричиняє широкомасштабне порушення клітинних процесів, що включає метаболічні каскади, масове вивільнення нейромедіаторів і вільних радикалів, посилений окисний стрес, мітохондріальну дисфункцію. Мелатонін діє як донор електронів і здатний знижувати концентрацію вільних радикалів у періоди окисного стресу [76].
Час і шлях введення мелатоніну можуть відігравати вирішальну роль у фізіологічній реакції на травму та лікування. Результати дослідження впливу внутрішньокоронарного та внутрішньовенного введення мелатоніну в пацієнтів, які перенесли черезшкірне коронарне втручання після інфаркту міокарда, продемонстрували потенційний «золотий період», коли ушкодженню вільними радикалами можна запобігти [50]. Пілотне РКД із подальшим спостереженням продемонструвало підвищення рівня виживаності серед реципієнтів мелатоніну, виміряного за показниками смертності та повторної госпіталізації через серцеву недостатність через 2 роки [51]. Це може свідчити про те, що більшість переваг мелатоніну є очевиднішими в довгостроковій перспективі (потенційно – через покращені механізми відновлення, а не запобігання ушкодженню) [52].
Ці дані мають значення для терапевтичного використання мелатоніну як антиоксиданту після ЧМТ. Більшість методів лікування ЧМТ здебільшого спрямовано на лікування симптомів до їх самостійного вирішення [166]. Більшість препаратів, які зараз використовуються для лікування ЧМТ (за винятком кортикостероїдів, циклоспорину, прогестерону), не показали різниці порівняно із плацебо щодо безпеки та ефективності. Безпечність і позитивний ефект мелатоніну, навпаки, було продемонстровано в новонароджених [162, 164], дітей/підлітків [143] і дорослих за допомогою різних шляхів введення, включаючи пероральний, внутрішньовенний, інтракоронарний [50, 52, 174, 175].
Отже, доклінічні дослідження щодо ефективності використання мелатоніну при ЧМТ при лікуванні дисфункції сну продемонстрували загальний позитивний вплив на покращення поведінкових факторів, сну та рухових результатів. У численних роботах отримано результати щодо сну та психічного здоров’я, а також докази, що підтверджують корисність мелатоніну як антиоксиданту і сигнальної молекули. Загалом сприятлива дія мелатоніну значно переважає його шкоду; наявні докази підтверджують його перспективність як терапевтичного засобу для пом’якшення не лише розладів сну та циркадних розладів, а й запальних ускладнень після ЧМТ.
Довідка «ЗУ»
Епіфізарний гормон, який має вплив на весь організм, краще вживати у вигляді лікарського засобу від перевіреного виробника (гарантія ефекту та безпеки). При цьому в аптеках багато мелатоніну у вигляді дієтичних добавок від невідомих виробників. З 1998 року в Україні наявний вітчизняний лікарський препарат Віта-мелатонін®, який містить мелатонін. За цей час лікарями різних спеціальностей було доведено ефективність і безпеку Віта-мелатоніну при цілій низці показань, у тому числі при порушеннях сну та біологічних ритмів (в авіапасажирів, сліпих, змінних робочих); симптомах психоемоційного стресу; гіпертонічній хворобі (в поєднанні з іншими гіпотензивними препаратами); в комплексній терапії клімаксу, за порушень менструального циклу.
Віта-мелатонін® (АТ «Київський вітамінний завод») – перевірений вітчизняний лікарський засіб, що містить мелатонін!
За матеріалами: Bell A., Hewins B., Bishop C., Fortin A., Wang J., Creamer J. L., Collen J., Werner J. K. Jr. Traumatic Brain Injury, Sleep, and Melatonin – Intrinsic Changes with Therapeutic Potential. Clocks & Sleep 2023, 5, 177-203. https://doi.org/10.3390/clockssleep5020016.
Підготувала Юлія Котикович
Медична газета «Здоров’я України 21 сторіччя» № 20 (557), 2023 р
СТАТТІ ЗА ТЕМОЮ Неврологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Після десятиліть, а часом і запеклих суперечок про переваги та недоліки застосування глюкокортикоїдів (ГК) досягнута певна конвергенція. Сучасні рекомендації лікування таких захворювань, як ревматоїдний артрит (РА), ревматична поліміалгія (РПМ) та васкуліт великих судин відображають поточний стан консенсусу терапії ГК. Однак залишаються відкритими питання щодо можливості тривалого лікування дуже низькими дозами ГК у пацієнтів із РА, а також успішності пошуку інноваційних ГК (лігандів ГК-рецепторів) із покращеним співвідношенням користь/ризик....
Серед препаратів, які мають велику доказову базу щодо лікування пацієнтів із захворюваннями дихальних шляхів з алергічним компонентом, особливий інтерес становлять антагоністи лейкотрієнових рецепторів (АЛТР). Ці препарати мають хорошу переносимість у дорослих та дітей, а також, на відміну від інгаляційних кортикостероїдів (ІКС), характеризуються високим комплаєнсом, тому посідають чільне місце в лікуванні пацієнтів із респіраторною патологією. У лютому відбувся міждисциплінарний конгрес із міжнародною участю «Життя без алергії International» за участю провідних вітчизняних міжнародних експертів. Слово мав президент Асоціації алергологів України, професор кафедри фтизіатрії та пульмонології Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук Сергій Вікторович Зайков із доповіддю «Місце АЛТР у лікуванні пацієнтів із респіраторною патологією». ...
Розбір клінічного випадку...





![Рис. 2. Рівень мелатоніну в плазмі як функція часу під час важких фізичних вправ і циркадних часових змін [89]](/multimedia/userfiles/images/2023/ZU_20_2023/ZU_20_2023_st44-45_pic2.jpg)