Фармакологічне лікування мігрені
Мігрень – найпоширеніша тяжка форма первинного головного болю (ГБ), на яку страждає майже що сьома людина у світі (Steiner et al., 2013). Водночас мігрень часто лишається недіагностованою або хибно діагностованою (наприклад, як синусит) і недостатньо лікованою, як на первинній, так і на вторинній ланці (Schreiber et al., 2004). Останнім часом у діагностуванні й лікуванні мігрені спостерігається значний прогрес, а саме нові підходи до її лікування та профілактики. Пропонуємо до вашої уваги огляд клінічної настанови, розробленої Шотландською міжуніверситетською мережею з розробки клінічних настанов (SIGN, 2018) й оновленої в березні 2023 року. Основну увагу автори приділили медикаментозній терапії дорослих пацієнтів із нападами мігрені та профілактичному лікуванню осіб з епізодичною, хронічною та пов’язаною з надмірним застосуванням ліків мігренню. Дані досліджень щодо дітей із мігренню до настанови не увійшли, проте запропоновано рекомендації, які можуть бути розглянуті для лікування підлітків із мігренню.
Класифікація головного болю
За Міжнародною класифікацією ГБ (2013) (МКГБ‑3), мігрень поділяють на таку з/ без аури, епізодичну / хронічну (IHS, 2013). Епізодична мігрень виникає впродовж <15 днів на місяць та може бути додатково поділена на таку з низькою (1‑9 днів на місяць) та високою частотою (10‑14 днів на місяць).
Хронічна мігрень розвивається протягом ≥15 днів на місяць. У перших двох версіях МКГБ це трактувалося як наявність ≥15 нападів мігрені на місяць, але таке визначення не описує більшості клінічних випадків у пацієнтів із хронічним ГБ за епізодичної мігрені. Переважно пацієнти з хронічною мігренню мають фоновий ГБ, на який накладаються напади мігрені. Зокрема, 2007 року було прийнято консенсусну заяву з новим визначенням хронічної мігрені, яким послуговувалися в усіх подальших дослідженнях хронічної мігрені (Headache Classification Committee, Olesen et al., 2006).
Тепер хронічна мігрень визначають за наявністю ГБ упродовж ≥15 днів на місяць у поєднанні з нападами мігрені ≥8 днів на місяць протягом ≥3 місяців. Це визначення додатково уточнено в МКГБ‑3: напади мігрені можуть бути із/без аури, а також додано напади, які, на думку пацієнта, є мігренню і за яких є відповідь на невідкладне її лікування. ГБ, пов’язаний із надмірним прийманням лікарських засобів, (ГБЛЗ) визначається як ГБ упродовж ≥15 днів на місяць, що розвинувся на тлі частого застосування знеболювальних препаратів щонайменше протягом 3 місяців. Здебільшого у пацієнтів ГБЛЗ є ускладненням мігрені (IHS, 2013).
Лікування мігрені поділяють на невідкладне (за гострого нападу) та профілактичне. Невідкладне лікування мігрені слід розпочинати якомога раніше у фазі ГБ для переривання нападу. Зокрема, застосовують одноразове приймання препарату з можливим повторенням за дві години (того самого або іншого) за недостатнього ефекту.
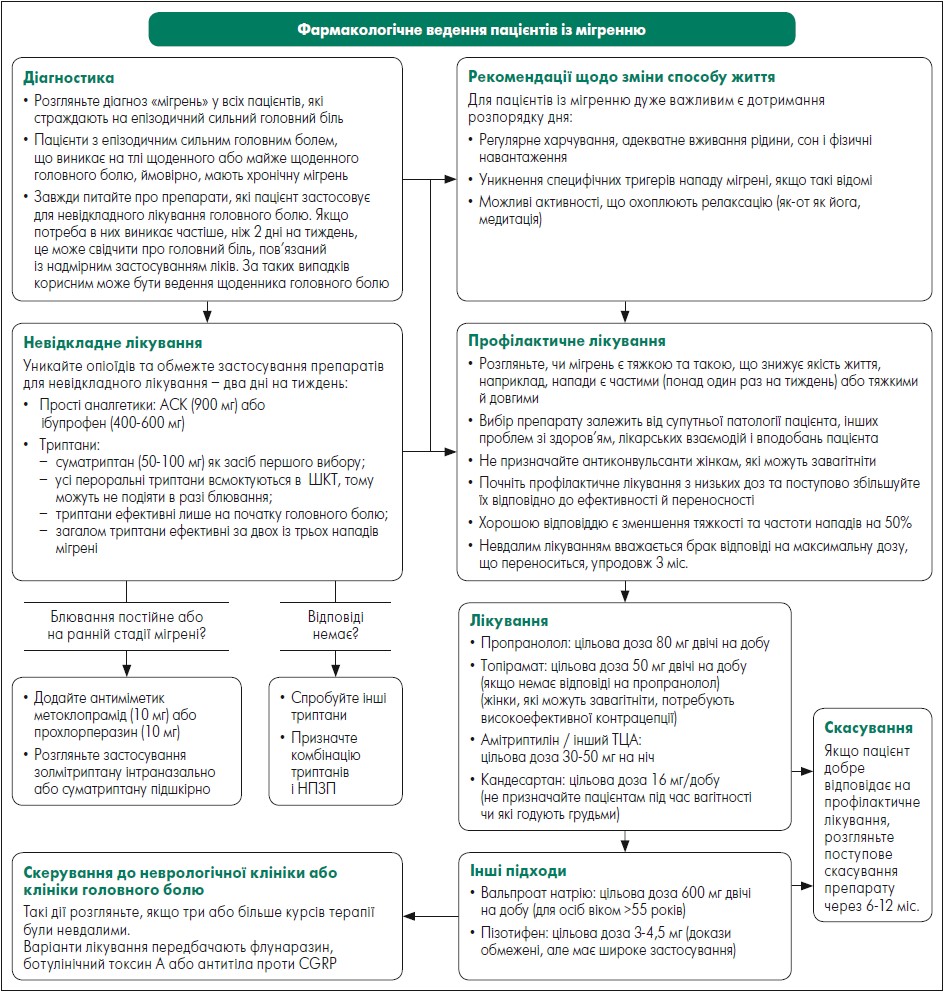
Профілактичне лікування здійснюють безперервно для зниження частоти і тяжкості нападів мігрені. Часто на практиці потрібно поєднувати невідкладне та профілактичне лікування. Обираючи терапію, необхідно брати до уваги тяжкість і частоту нападів, інші наявні симптоми, побажання пацієнта, історію його лікування та супутню патологію. Алгоритм фармакологічного ведення пацієнтів із мігренню наведено на рисунку.
Рис. Алгоритм фармакологічного ведення пацієнтів із мігренню
Адаптовано за Pharmacological management of migraine. SIGN155. A national clinical guideline. First published February 2018. Revised March 2023.
Деякі рекомендації можуть стосуватися призначень лікарських засобів поза затвердженими показаннями («off-label»), зокрема в іншій дозі чи для іншої групи пацієнтів. Потреба в таких призначеннях виникає, коли клінічна ціль не може бути задоволена завдяки застосуванню відповідних ліцензованих лікарських засобів.
У разі призначенні препаратів «off-label» рекомендовано:
- упевнитися, що немає препарату з відповідними показаннями в реєстраційному посвідченні, який задовольнив потребу пацієнта;
- переконатися, що є достатньо доказів або досвіду застосування препарату, які підтверджують його безпеку та ефективність;
- взяти на себе відповідальність за призначення препарату та нагляд за станом пацієнта;
- робити записи про всі призначені препарати і причини застосування ліків «off-label» (GMC, 2017).
Менеджмент мігрені
Лікування нападу мігрені
Рекомендації:
- Ацетилсаліцилову кислоту (АСК) (900 мг) розгляньте як препарат першої лінії у пацієнтів із гострим нападом мігрені.
- Ібупрофен (400 мг) розгляньте як препарат першої лінії у пацієнтів із гострим нападом мігрені. У разі недостатнього ефекту збільшіть дозу до 600 мг.
- Триптани розгляньте як препарат першої лінії у пацієнтів із гострим нападом мігрені. Перший вибір – суматриптан (50‑100 мг), у разі неефективності суматриптану призначте інші триптани.
- Комбінацію суматриптану (50‑85 мг) і напроксену (500 мг) розгляньте для лікування пацієнтів із гострим нападом мігрені.
Профілактика мігрені
Рекомендації:
- Пропранолол (80‑160 мг/день) розгляньте як профілактичне лікування першої лінії пацієнтам з епізодичною або хронічною мігренню.
- Топірамат (50‑100 мг/день) розгляньте як профілактичне лікування пацієнтам з епізодичною або хронічною мігренню.
- Амітриптилін (25‑150 мг на ніч) розгляньте як засіб профілактичного лікування у пацієнтів з епізодичною або хронічною мігренню.
- Кандесартан (16 мг/день) можливо розглянути як засіб профілактичного лікування для пацієнтів з епізодичною або хронічною мігренню.
Ботулінічний токсин А розгляньте як профілактичне лікування у разі хронічної мігрені, якщо вирішено питання надмірного приймання ліків і пацієнт отримував належне лікування трьома або більше пероральними препаратами для профілактики мігрені.
Еренумаб, фреманезумаб, галканезумаб і ептінезумаб розгляньте для профілактичного лікування пацієнтів із хронічною мігренню, якщо вирішено питання надмірного застосування ліків і пацієнт не мав користі внаслідок приймання трьох або більше пероральних препаратів для профілактики мігрені за належної тривалості та дозувань.
Фреманезумаб, галканезумаб і ептінезумаб можливо розглянути як засоби профілактичного лікування для пацієнтів з епізодичною мігренню, якщо вирішено питання надмірного використання ліків і немає користі внаслідок застосування курсів трьома або більше пероральними препаратами для профілактики мігрені за належної тривалості та дозувань.
На початку профілактичного лікування слід застосовувати низьку дозу препарату, поступово збільшуючи її до досягнення мінімальної ефективної дози, яка може відрізнятися у різних пацієнтів. Потребу в постійній профілактиці слід оцінити через 6‑12 місяців.
Головний біль, пов’язаний із надмірним застосуванням лікарських засобів
Рекомендація
- У пацієнтів, що надмірно приймають лікарські засоби для невідкладного лікування мігрені, передусім слід вирішити питання щодо надмірного застосування препаратів.
- Призначаючи препарати для невідкладного лікування мігрені, попередьте пацієнта про ризик розвитку ГБЛЗ.
- Розгляньте ефективний підхід лікування, який оснований на клінічному досвіді групи розробників настанови.
Лікування пацієнтів із гострим нападом мігрені
Невідкладне лікування призначають або для припинення нападу мігрені, або для значного зменшення тяжкості ГБ та інших симптомів. Щойно пацієнт усвідомить, що у нього розвивається мігренозний напад, застосовують невідкладне лікування. Якщо напад супроводжується аурою, рекомендовано приймати триптани на початку ГБ, а не аури (якщо вони виникають не одночасно) (BASH, 2017). Лікування триптаном відбувається одноразово з можливим повторенням через дві години (тим самим або іншим препаратом) у разі недостатньої відповіді. Відповіддю на лікування вважають зникнення болю впродовж двох годин та його відсутність упродовж 24 годин. Дані щодо кількості осіб, яких необхідно пролікувати (number needed to treat – NNT) для втамування ГБ протягом двох годин, наведено в таблиці.
|
Таблиця. Порівняння ефективності препаратів для невідкладного лікування мігрені |
|
|
Препарат |
NNT |
|
Прості аналгетики |
|
|
АСК 900 мг або 1000 мг (Kirthi et al., 2013) |
8,1 |
|
Диклофенак натрію 50 мг (Derry et al., 2013) |
8,9 |
|
Ібупрофен 400 мг (Rabbie et al., 2013) |
7,2 |
|
Ібупрофен 200 мг (Rabbie et al., 2013) |
9,7 |
|
Напроксен 500 мг або 825 мг (Law et al., 2013) |
11 |
|
Парацетамол 1000 мг (Derry et al., 2013) |
12 |
|
Триптани для перорального застосування |
|
|
Суматриптан 50 мг (Derry et al., 2014) |
6,1 |
|
Суматриптан 100 мг (Derry et al., 2014) |
4,7 |
|
Золмітриптан 5 мг (Bird et al., 2014) |
4,8 |
|
Золмітриптан 2,5 мг (Bird et al., 2014) |
5,0 |
|
Триптани для інтраназального застосування |
|
|
Суматриптан 20 мг (Derry et al., 2014) |
4,7 |
|
Золмітриптан 5 мг (Bird et al., 2014) |
3,0 |
|
Триптани для підшкірного застосування |
|
|
Суматриптан 6 мг (Derry et al., 2014) |
2,3 |
|
Комбінована терапія |
|
|
Суматриптан 50‑85 мг і напроксен 500 мг (Law et al., 2016) |
4,9 |
|
Примітки: NNT – кількість осіб, яких необхідно пролікувати для позбавлення від ГБ упродовж двох годин; наведено дані щодо NNT для позбавлення від помірного / тяжкого болю впродовж двох годин порівняно з плацебо; перелік препаратів є неповним. |
|
Адаптовано за Pharmacological management of migraine. SIGN155. A national clinical guideline. First published February 2018. Revised March 2023.
Лікування може бути покроковим або стратифікованим (BASH, 2017). Покрокова терапія передбачає спочатку застосування АСК або ібупрофену, а в разі їхньої неефективності під час трьох епізодів ГБ – перехід на триптани. Стратифіковане лікування полягає у застосуванні, наприклад, високої дози АСК за помірного ГБ і триптану – за тяжчого ГБ. Вибір стратегії лікування має відбуватися, зважаючи на побажання пацієнта (BASH, 2017).
Пацієнти по-різному відповідають на триптани, тому для вибору ефективного підходу варто спробувати різні препарати. Невідкладне лікування може бути дієвим не за кожного нападу мігрені. За таких клінічних випадків слід запропонувати альтернативний варіант, наприклад підшкірну ін’єкцію суматриптану. Із кожним пацієнтом, якому призначають препарати для невідкладного лікування нападу мігрені, слід обговорити ризик розвитку ГБЛЗ.
Як зазначають автори настанови, усі ородисперсні триптани всмоктуються в шлунку, тому для пацієнтів, у яких на початку мігренозного нападу спостерігається блювання, слід розглянути застосування форм триптанів для інтраназального або підшкірного введення (BASH, 2017).
Значна частина дози триптану, введеного інтраназально, все одно всмоктується в шлунку. Для осіб, у яких напад мігрені супроводжується нудотою і блюванням, необхідно розглянути застосування протиблювотних препаратів. У пацієнтів із нападом від помірного до тяжкого може бути доцільним приймання комбінації триптану з АСК або нестероїдним протизапальним препаратом (НПЗП), а також застосування триптанів для інтраназального або підшкірного введення (BASH, 2017).
АСК
За даними Кокранівського огляду (13 досліджень за участю 4222 учасників), АСК у дозах 900 і 1000 мг є ефективною для усунення болю впродовж двох годин порівняно з плацебо (NNT=8,1). Для стійкого позбавлення від болю на 24 год NNT для АСК у дозі 1000 мг становить 6,6 (Kirthi et al., 2013).
Монотерапія АСК має ефективність, подібну до дії суматриптану в дозі 50 мг, а в дозі 100 мг він був ефективніший за комбінацію АСК із метоклопрамідом (Kirthi et al., 2013). Такі супутні симптоми як нудота, блювання, фотофобія (NNT=7,7) і фонофобія (NNT=6,6) краще усувалися завдяки АСК порівняно з плацебо. Додавання метоклопраміду надалі зменшувало нудоту (NNT=2,6) і блювання (Kirthi et al., 2013).
АСК – потенційний подразник шлунково-кишкового тракту і може спричиняти шлунково-кишкову кровотечу, проте побічні ефекти за короткотривалого застосування є м’якими і тимчасовими (Kirthi et al., 2013). Не слід застосовувати АСК у пацієнтів віком до 16 років через ризик розвитку синдрому Рея (BNF, 2017).
Також необхідно уникати застосування АСК у високих дозах під час вагітності (Briggs et al., 2017). Крім того, АСК протипоказано застосовувати пацієнткам у третьому триместрі вагітності (BNF, 2017).
Рекомендація
- АСК (900 мг) розгляньте як препарат першої лінії у пацієнтів із гострим нападом мігрені.
- АСК у дозах, рекомендованих для лікування мігрені, не є знеболювальним препаратом вибору у вагітних і не слід застосовувати у третьому триместрі вагітності (BNF, 2017).
НПЗП
Як зазначено у Кокранівському огляді, ефект ібупрофену (200‑600 мг) перевершує плацебо щодо усунення болю впродовж двох годин і стійкого позбавлення від нього на 24 год у пацієнтів із нападом мігрені з ГБ від помірного до тяжкого. Для усунення ГБ упродовж 2 годин NNT для ібупрофену становила 9,7 (доза 200 мг) і 7,2 (доза 400 мг) (Rabbie et al., 2013).
Продемонстровано ефективність напроксену для втамування болю впродовж двох годин порівняно з плацебо у пацієнтів із нападом мігрені (NNT=11). На результат не мала впливу зміна дози від 500 до 825 мг (Law et al., 2013).
Диклофенак натрію (50 мг) має відносні переваги порівняно з плацебо, відносний ризик становить 2,0 (95% довірчий інтервал [ДІ] 1,6‑2,6), NNT=8,9 для зменшення болю протягом двох годин у пацієнтів із нападом мігрені (Derry et al., 2013).
Напроксен та ібупрофен були ефективними для позбавлення від супутніх симптомів мігрені (нудоти, фото- і фонофобії, функціональної неспроможності) порівняно з плацебо (Rabbie et al., 2013; Law et al., 2013). У цих дослідженнях не повідомлялося про серйозні побічні ефекти (Rabbie et al., 2013; Law et al., 2013; Derry et al., 2013).
За тривалого використання НПЗП можуть спричиняти шлунково-кишкові проблеми. Також слід НПЗП застосовувати з обережністю у пацієнтів з астмою, оскільки ці засоби можуть погіршити їхній стан (BNF, 2017).
Під час вагітності ібупрофен є протизапальним засобом першого вибору до 28-го тижня гестації, а після цього терміну слід уникати повторного його приймання (Schaefer et al., 2014). Ібупрофен – єдиний НПЗП, ліцензований для пацієнтів із гострим нападом мігрені.
Рекомендація
- Ібупрофен (400 мг) розгляньте як препарат першої лінії для пацієнтів із гострим нападом мігрені. За недостатнього ефекту збільшити дозу ібупрофену до 600 мг.
Парацетамол
У Кокранівському огляді (три дослідження, за участю 717 учасників) зазначено, що відносна користь парацетамолу (1000 мг) становила 1,8 (95% ДІ 1,2‑2) порівняно з плацебо, NNT=12, у пацієнтів із гострим нападом мігрені від помірної до тяжкої (Derry et al., 2013). У двох дослідженнях (1140 учасників із гострими нападами мігрені) комбінація парацетамолу (1000 мг) і метоклопраміду (10 мг) мала ефект, подібний до суматриптану (100 мг), для полегшення ГБ упродовж двох годин (про це повідомили 39% осіб, які приймали парацетамол і метоклопрамід, і 42% тих, хто використовував суматриптан) (Derry et al., 2013). Щодо відсутності болю 24 години, парацетамол виявився ефективнішим за плацебо, але не перевершив дію ризатриптану. У цьому дослідженні не повідомлялося про серйозні побічні реакції. Пацієнти краще переносили парацетамол, аніж НПЗП або триптани (Derry et al., 2013). Парацетамол широко застосовують у жінок впродовж усього періоду вагітності, хоча слід уникати систематичного приймання препарату (Briggs et al., 2017; Schaefer et al., 2014).
Рекомендація
Парацетамол (1000 мг) розгляньте для лікування пацієнтів із гострим нападом мігрені, які не можуть отримувати інше невідкладне лікування мігрені.
Завдяки сприятливому профілю безпеки парацетамол є препаратом першого вибору для короткочасного застосування для полегшення помірного чи тяжкого ГБ у всіх триместрах вагітності (Briggs et al., 2017; Schaefer et al., 2014).
Протиблювотні засоби
Метоклопрамід (10 мг, перорально) у комбінації з АСК (900 мг) був ефективний, подібно до суматриптану (100 мг) для полегшення ГБ упродовж двох годин (Kirthi et al., 2013). Ці результати отримано для комбінації парацетамолу (1000 мг) і метаклопраміду (10 мг) порівняно із суматриптаном (Derry et al., 2013). Однак АСК і метоклопрамід ефективніше усували супутні симптоми (NNT=2,6), особливо – блювання (NNT=2,1) (Kirthi et al., 2013).
У РКД, у яких порівнювали різні дози метоклопраміду, застосування препарату у всіх дозах поліпшувало відповідь щодо ГБ, який визначали за 11-бальною рейтинговою шкалою оцінювання болю (NRS). Більшість пацієнтів відчула полегшення на >50%, зокрема для метоклопраміду в дозі 10 мг воно становило 4,7 бала, для 20 мг – 4,9 бала, для 40 мг – 5,3 бала за NRS (Friedman et al., 2011). За результатами метааналізу фенотіазини перевершували плацебо щодо повного усунення ГБ упродовж години після приймання препарату (відношення ризиків (ВР) 15,02; 95% ДІ 7,57‑29,82). Порівняно з метоклопрамідом значної різниці щодо повного втамування болю не виявлено (Kelly et al., 2009). Як прохлорперазин (10 мг), так і метоклопрамід (20 мг), які застосовували разом із дифенгідраміном і вводили внутрішньовенно, виявилися ефективними для полегшення болю протягом години у пацієнтів із гострою мігренню, що встановлено за шкалою NRS. Через дві години після лікування прохлорперазином оцінка ГБ становила 6,4 бала за NRS (на вихідному рівні – 8,4 бала), а для метоклопраміду – 5,9 бала за NRS (на вихідному рівні – 8,8 бала). Загальна різниця становила 0,6 бала (95% ДІ від -0,6 до 1,8), із NNT=17 для усунення ГБ за дві години (Friedman et al., 2008). Побічні ефекти здебільшого були незначними (Kirthi et al., 2013). За даними досліджень метоклопраміду і прохлорперазину, у 5‑9% учасників виникала акатизія, а також сонливість і запаморочення. Зі збільшенням дози метоклопраміду спостерігалося більше випадків вибуття пацієнтів із дослідження (Friedman et al., 2008, 2011).
Рекомендації:
- Метоклопрамід (10 мг) або прохлорперазин (10 мг) розгляньте для лікування ГБ у пацієнтів із гострим нападом мігрені, які можна застосовувати як перорально, так і парентерально, залежно від симптомів та клінічного випадку.
- Метоклопрамід (10 мг) або прохлорперазин (10 мг) розгляньте для пацієнтів із симптомами, пов’язаними з мігренню, зокрема з нудотою або блюванням. Препарати можливо застосовувати як перорально, так і парентерально, залежно від симптомів та клінічного випадку.
- Метоклопрамід не застосовуйте регулярно через ризик розвитку екстрапірамідних побічних ефектів.
Триптани
У пацієнтів із гострим нападом мігрені триптани перевершують плацебо щодо полегшення болю, знеболення впродовж двох годин і відсутності болю 24 години (Bird et al., 2014; Cameron et al., 2015; Derry et al., 2014; Hu et al., 2013; Pringsheim et al., 2008).
За даними аналізу Кокранівських оглядів, суматриптан – ефективний засіб лікування за мігренозних епізодів (Derry et al., 2014). Підшкірне введення є найефективнішим щодо полегшення болю від помірного до тяжкого впродовж 2 год, із NNT=2,5 для дози суматриптану 4 мг і NNT=2,3 для дози 6 мг. Ефективність суттєво підвищується, якщо лікування відбувається на ранній стадії, поки ГБ має слабкий характер. За перорального застосування суматриптану (50 мг) NNT для полегшення ГБ упродовж двох годин становила 6,1 для болю від помірного до тяжкого і 4,4 – для слабкого. Для застосування суматриптану (100 мг) NNT для втамування болю впродовж двох годин становила 4,7 – від помірного до тяжкого і 2,4 – слабкого. Суматриптан для інтраназального введення також є ефективним для полегшення болю впродовж двох годин (NNT=3,1) (Derry et al., 2014).
У дослідженнях, у яких порівнювали ефект суматриптану з іншими триптанами, для золмітриптану та альмотриптану продемонстровано схожу користь (Derry et al., 2014). Зокрема, ризатриптан (10 мг) перевершував суматриптан в усіх дозах за ефективністю усунення болю впродовж двох годин. Ризатриптан (5 мг) мав подібну дію до суматриптану (50 мг).
Елетриптан (40 і 80 мг) перевершував суматриптан в обох дозах за показником відсутності болю через дві години і був пов’язаний зі зниженням потреби в препаратах невідкладної терапії (Derry et al., 2014). Щодо усунення болю впродовж двох годин суматриптан (100 мг) перевершував комбінацію АСК (900 мг) і метоклопраміду (10 мг) або парацетамолу (1000 мг) і метоклопраміду (10 мг). Крім того, щодо втамування болю впродовж двох годин суматриптан перевершував АСК (1000) мг у формі розчинних таблеток (Derry et al., 2014).
У пацієнток із мігренню, пов’язаною з менструацією (МПМ), суматриптан мав терапевтичний ефект: 25% позбулися болю за дві години після приймання суматриптану в дозі 50 мг і 34% – у дозі 100 мг порівняно з плацебо (Pringsheim et al., 2008). Застосування ризатриптану, фроватриптану і золмітриптану є ефективними для невідкладного лікування пацієнток із МПМ (Hu et al., 2013; Pringsheim et al., 2008).
Побічні ефекти, описані в зазначених вище клінічних дослідженнях, за тяжкістю були від слабких до помірних. Серйозні небажані явища виникали вкрай рідко (Derry et al., 2014; Bird et al., 2014). Зокрема, пацієнтам, які отримують ризатриптан і пропранолол, ризатриптан слід призначати у дозі до 5 мг через ризик взаємодії, при цьому останній необхідно приймати з інтервалом <2 годин після приймання пропранололу (BNF, 2017).
У дослідженні серцево-судинних (СС) наслідків застосування триптанів ВР становив 0,86 (95% ДІ 0,52‑1,43) для серйозних СС подій (Roberto et al., 2015). Триптани протипоказано пацієнтам із неконтрольованою артеріальною гіпертензією (АГ) та за симптомів СС і цереброваскулярних захворювань (BNF, 2017). Дослідження застосування триптанів переважно сфокусовані на популяції віком 18‑65 років, тому бракує інформації щодо застосування триптанів в осіб >65 років. Вік не є протипоказанням до застосування триптанів, але перед їх призначенням пацієнтам віком >65 років слід брати до уваги чинники судинного ризику (BNF, 2017).
Після кількох повідомлень про випадки серотонінового синдрому в пацієнтів, які приймали триптани та селективні інгібітори зворотного захоплення серотоніну (СІЗЗС), Управління з контролю за якістю харчових продуктів та лікарських засобів США (FDA) опублікувало відповідні попередження. Втім, Американське товариство головного болю (AHS) заявило, що клінічних даних у звіті FDA недостатньо, щоб визначити, чи є підвищений ризик розвитку серотонінового синдрому в пацієнтів, які приймають триптани та СІЗЗС одночасно, порівняно з тими, хто приймали тільки СІЗЗС. Зважаючи на частоту такого одночасного призначення, будь-який ризик є дуже малим. Тож доцільно призначати триптани пацієнтам, які приймають СІЗЗС (Evans et al., 2010).
Дані реєстрів надають усе більше певності щодо застосування триптанів під час вагітності. Так, за метааналізом даних щодо застосування триптанів, наприклад суматриптану, пацієнтками на всіх стадіях вагітності порівняно з жінками з мігренню, які їх не приймали під час виношування, приймання зазначених препаратів не було пов’язане з підвищеним ризиком серйозних вроджених вад розвитку плода або недоношеності (Marchenko et al., 2015).
Це підтвердило додаткове когортне дослідження. Зокрема, у метааналізі зазначено, що ризик спонтанних абортів у вагітних, які приймали триптани, був вищим (ВР 1,41; 95% ДІ 1,11‑1,80), але таке оцінювання здійснювали не у всіх дослідженнях і воно базувалося на невеликій кількості пацієнток. Результати ще одного масштабного когортного дослідження (432 жінки) підтвердили відсутність підвищеного ризику спонтанних абортів у разі застосування вагітними триптанів (Spielmann et al., 2017).
Відповідно до даних когортного дослідження, у якому жінки заповнювали валідовані опитувальники з питаннями про свою дитину у віці 18 і 36 місяців, пренатальне застосування триптану (переважно в першому триместрі) може бути пов’язане з екстерналізованими проблемами поведінки (підвищення ризику в 1,36 раза) (Wood et al., 2016).
Отримані дані можуть бути неоднозначними, тож їх слід обережно інтерпретувати. З огляду на ефективність, профіль безпеки та вартість суматриптан є препаратом вибору. Для пацієнтів із блюванням на початку мігрені триптан для інтраназального або підшкірного введення може бути дієвішим. Також ефективними є золмітриптан (5 мг) для інтраназального застосування і суматриптан (6 мг) для підшкірного введення. Якщо лікування парацетамолом (у всіх триместрах) або ібупрофеном (лише в першому та другому триместрах) не дає результатів, можна розглянути можливість використання триптанів, зокрема суматриптану, на всіх стадіях вагітності. Жоден із триптанів не класифіковано як нетератогенний.
Рекомендації:
- Триптани розгляньте як засіб лікування першої лінії пацієнтів із нападом мігрені. Препаратом першого вибору є суматриптан (50‑100 мг), але в разі його неефективності запропонуйте інші засоби.
- Для пацієнтів із тяжким нападом мігрені або блюванням на ранній стадії нападу розгляньте призначення золмітриптану для інтраназального застосування або суматриптану для підшкірного введення.
- Триптани розгляньте для лікування пацієнтів із гострою мігренню, пов’язаною з менструацією.
- Суматриптан можливо розглянути для лікування гострого нападу мігрені у вагітних жінок на всіх стадіях вагітності. Перед початком лікування обговоріть ризики, пов’язані із застосуванням препарату.
Комбінована терапія
Комбінація суматриптану (50‑85 мг) і напроксену (500 мг) є кращою, ніж плацебо або монотерапія препаратами порівняння у пацієнтів із нападом мігрені (Law et al., 2016). Зокрема, 50% осіб із легким болем не відчували його через дві години після комбінованої терапії проти 18% у групі плацебо (NNT=3,1; 95% ДІ 2,9‑3,5). Якщо біль був від помірного до сильного, NNT становив 4,9 (95% ДІ 4,3‑5,7) порівняно з плацебо (Law et al., 2016). Супутні симптоми нудоти, світлобоязні, фонофобії та функціональної недієздатності також вдавалося краще контролювати за комбінованої терапії проти плацебо або монотерапії (Law et al., 2016).
Відносна користь комбінованої терапії порівняно із суматриптаном становила 1,4; NNT=10. Проте порівняно з одним лише напроксеном ефективність комбінованої терапії була кращою, із відносною користю 2,0; NNT=6,1. Небажані ефекти траплялися частіше за комбінованої терапії, ніж у разі приймання плацебо або тільки напроксену, але мали легкий характер (Law et al., 2016).
Рекомендація
- Комбіновану терапію із застосуванням суматриптану (50‑85 мг) та напроксену (500 мг) розгляньте для лікування пацієнтів із нападом мігрені.
Стероїди
За даними двох метааналізів, користь використання стероїдів (преднізолону або дексаметазону) додатково до інших засобів невідкладної терапії була незначною для зменшення ГБ від помірного до тяжкого характеру на 24‑72 год (NNT=10) (Huang et al., 2013; Singh et al., 2008). Дослідження, які увійшли до метааналізу, були немасштабними і в деяких із них не виявлено статистично значущої різниці порівняно з плацебо. Крім того, у них використовували різні засоби додаткової терапії нападу мігрені. Об’єднані дані шести досліджень, у яких повідомлялося про вторинний результат – повне зникнення мігрені, не підтвердили значної переваги застосування стероїдів проти плацебо (Singh et al., 2008). Побічні ефекти були незначними й тимчасовими (Huang et al., 2013; Singh et al., 2008). В усіх дослідженнях, крім одного, стероїди вводили внутрішньовенно пацієнтам, які перебували у відділенні невідкладної допомоги. Стероїди для внутрішньовенного застосування не є прийнятним варіантом у рутинній практиці.
Фармакологічна профілактика мігрені
Більшість наявних доказів ґрунтується на даних досліджень популяції пацієнтів з епізодичною мігренню, а не хронічною. Тож у рекомендаціях припущено, що хронічна та епізодична мігрень належать до одного спектра захворювань, і пацієнти з хронічною мігренню можуть отримати користь внаслідок терапії, яка була ефективною для профілактики епізодичної мігрені.
Мігрень може чинити значний вплив на якість життя та повсякденні функції людини. Незначне зменшення частоти або тяжкості ГБ за мігрені може мати значну користь для пацієнта. Успішним результатом досліджень вважається зменшення тяжкості та/або частоти ГБ на 30‑50%. Рішення про те, коли починати профілактику мігрені, слід приймати, визначивши вплив мігрені на конкретного пацієнта, а не просто орієнтуючись на абсолютну кількість нападів на місяць. Наприклад, кілька тяжких нападів мігрені на місяць, що призводять до втрати працездатності, можуть потребувати профілактичного лікування, тоді як частіші, але легші напади, які не мають вагомого впливу на повсякденні функції, можуть не потребувати його. Надмірне вживання ліків під час нападу може обмежити ефективність профілактичного лікування (Zeeberg et al., 2006). Профілактичне лікування має тривати щонайменше три місяці в максимальній переносимій дозі, перш ніж буде вирішено, чи є воно ефективним. У багатьох пацієнтів профілактичні препарати можна успішно скасувати, а потребу у подальшій профілактиці розглянути через 6‑12 міс. (Diener et al., 2007).
Рішення щодо того, який препарат слід спробувати в першу чергу, залежить від доказів його ефективності, супутніх захворювань, інших чинників ризику, лікарських взаємодій та вподобань пацієнта. Важливо забезпечити адекватну контрацепцію під час профілактичної терапії, оскільки деякі препарати пов’язані з тератогенним ризиком, а інші потенційно можуть завдати шкоди ненародженим дітям. Оскільки мігрень без аури часто полегшується під час вагітності, жінкам слід намагатися припинити профілактичне лікування до настання вагітності. Мігрень з аурою зазвичай триває без змін (MacGregor, 2007). Перед початком лікування слід обговорити потенційні шкідливі ефекти терапії із жінками, які є вагітними або можуть завагітніти. Не виявлено доказів, які уможливили б надання рекомендації щодо профілактичного лікування мігрені у жінок під час вагітності.
β-Адреноблокатори
У систематичному огляді виявлено велику кількість досліджень застосування β-адреноблокаторів для профілактики мігрені, проведених переважно в 1980-х роках. Окремі з них оцінено як низькоякісні та короткотривалі (<3 міс.) (Shamliyan et al., 2013). Пропранолол (80‑160 мг) знижував частоту епізодичної мігрені на ≥50% порівняно з плацебо (NNT=4; 95% ДІ 3‑7) (Shamliyan et al., 2013). Метопролол (200 мг/добу, форма пролонгованої дії) зменшував тяжкість мігрені, але не мав суттєвих переваг щодо зменшення частоти мігрені або використання аналгетиків для невідкладного лікування нападів (Shamliyan et al., 2013).
Атенолол (50‑200 мг/добу) зменшував частоту епізодичної мігрені та застосування засобів для невідкладного лікування нападів (Shamliyan et al., 2013). Прямі порівняльні дослідження ефективності пропранололу з іншими препаратами, що використовують для профілактики мігрені у пацієнтів з епізодичною та хронічною мігренню, були низької якості. Через ці обмеження ймовірність зниження частоти ГБ на 50% не відрізнялася для пропранололу і топірамату. Ефективність пропранололу була кращою, ніж ніфедипіну, але не виявлено чітких доказів, що він дієвіший за інші β-адреноблокатори, як-от метопролол і тимолол. Аналогічно не виявлено різниці порівняно з амітриптиліном чи нортриптиліном. Ефективність застосування комбінованого трициклічного антидепресанту і пропранололу не була кращою, ніж монотерапії пропранололом (Shamliyan et al., 2013).
Застосування пропранололу супроводжувалося побічними ефектами частіше, ніж плацебо. Серед специфічних небажаних явищ, що призводили до припинення лікування, нудота (43 на 1000 пролікованих) і діарея (89 на 1000 пролікованих) (Shamliyan et al., 2013). Зокрема, β-адреноблокатори слід обережно застосовувати у пацієнтів з астмою в анамнезі (BNF, 2017). Пацієнтам, які застосовують ризатриптан і пропранолол, слід призначати ризатриптан у дозі до 5 мг, оскільки пропранолол підвищує концентрацію ризатриптану в плазмі. Ризатриптан не слід приймати протягом двох годин після приймання пропранололу (BNF, 2017).
Рекомендація
- Пропранолол (80‑160 мг/добу) розгляньте як засіб першої лінії для профілактичного лікування пацієнтів з епізодичною або хронічною мігренню.
Топірамат
У трьох систематичних оглядах повідомлялося про дію топірамату порівняно з плацебо у пацієнтів з епізодичною та хронічною мігренню (Shamliyan et al., 2013; Guo et al., 2012; Linde et al., 2013). За даними об’єднаного аналізу дев’яти РКД (1700 пацієнтів; тривалість лікування 4‑52 тижні), у яких порівнювали ефективність топірамату та плацебо, вдвічі більше пацієнтів повідомляли про зниження частоти ГБ на ≥50% (ВР 2,02, 95% ДІ 1,57‑2,60; NNT=4, 95% ДІ 3‑6), зменшення кількості нападів ГБ за 28 днів на один, а також поліпшення якості життя внаслідок застосування топірамату (Linde et al., 2013). Низькоякісні докази в пацієнтів із хронічною мігренню свідчать, що топірамат зменшує кількість днів із мігренню на місяць, частоту асоційованих симптомів та є ефективнішим для зменшення щомісячних нападів мігрені на 25% порівняно з плацебо (Shamliyan et al., 2013).
Топірамат (50‑200 мг/добу) ефективний для зменшення частоти щомісячних нападів мігрені та кількості днів мігрені на ≥50% (абсолютне зменшення кількості днів із мігренню на місяць – на 5 для топірамату в дозі 100 мг/добу) (Shamliyan et al., 2013). Метааналіз даних трьох досліджень, у яких використовувалися різні дози топірамату, продемонстрував, що 200 мг/добу не є ефективнішою за 100 мг/добу (Linde et al., 2013). Зокрема, повідомлялося про покращення показників якості життя, загального стану здоров’я, самооцінки життєздатності та зменшення вживання препаратів для невідкладного лікування мігрені (Shamliyan et al., 2013).
У семи дослідженнях ефективності топірамату та препарату порівняння (амітриптилін, флунаризин, пропранолол, вальпроат натрію та реланіум) топірамат виявився не кращим за будь-який препарат порівняння, за винятком невеликої, але значущої переваги над вальпроатом натрію. Однак ці дослідження були недостатньо якісними, і для підтвердження цих висновків потрібні додаткові докази (Linde et al., 2013). Лікування топіраматом (100 мг/добу) було пов’язане з вищою частотою виникнення побічних ефектів, ніж приймання плацебо, проте вони були легкими або помірними (Guo et al., 2012; Linde et al., 2013). Серед небажаних явищ – нудота, парестезія, анорексія та втрата ваги (Guo et al., 2012; Linde et al., 2013; Donegan et al., 2015). Поширеними є когнітивні побічні ефекти, які різняться за ступенем тяжкості, мають тенденцію залежати від дози і часто визначають переносимість препарату (Shank and Maryanoff, 2008). Оскільки пригнічення настрою також належить до поширених небажаних реакцій, топірамат слід обережно застосовувати пацієнтам із депресією (BNF, 2017). Використання топірамату під час першого триместру вагітності пов’язане з підвищеним ризиком аномального розвитку розщелини піднебіння у немовлят (ВР 6,2; 95% ДІ 3,13‑12,51) (Alsaad et al., 2015).
Діти, які зазнали впливу топірамату внутрішньоутробно, мають високий ризик серйозних порушень розвитку (ВР 3,53; 95% ДІ 1,42‑8,74 для порушень інтелектуального розвитку та ВР 2,73; 95% ДІ 1,34‑5,57 для розладів спектра аутизму) (Bjork et al., 2022). Топірамат не слід застосовувати жінкам, які годують грудьми, оскільки він може проникати у грудне молоко (BNF, 2017). Пацієнтки, які приймають топірамат і можуть завагітніти, мають використовувати високоефективні засоби контрацепції.
Рекомендації:
- Топірамат (50‑100 мг/добу) розгляньте як засіб для профілактичного лікування пацієнтів з епізодичною або хронічною мігренню.
- Перед початком лікування жінок слід поінформувати про:
- ризики, пов’язані з прийманням препарату під час вагітності;
- потенційно шкідливий вплив топірамату, який може виникнути до того, як жінка дізнається про свою вагітність;
- необхідність використання високоефективних засобів контрацепції;
- додаткову консультацію щодо профілактики мігрені в разі вагітності або планування вагітності.
Трициклічні антидепресанти
За результатами систематичного огляду, у пацієнтів з епізодичною мігренню (у середньому 4,7 напади на місяць), які отримували трициклічні антидепресанти (ТЦА), виявлено зменшення кількості епізодів ГБ – на 1,4 на місяць (Jackson et al., 2010). Тривалість досліджень варіювала від 4 до 24 тижнів, і вони оцінені як пов’язані з високим ризиком упередженості (Jackson et al., 2010). Середня застосовувана доза ТЦА становила 50% максимальної. Здебільшого дози титрували. Наявні певні докази того, що вищі дозування сприяли більшій користі, але різниця між вищими і нижчими дозами не була значущою. Пацієнти з епізодичною мігренню, які застосовували ТЦА, мали значущий (80%) шанс на полегшення ГБ на 50% (ВР 1,80; 95% ДІ 1,24‑2,62) порівняно з тими, що приймали плацебо. Встановлено невелике постійне зниження частоти ГБ за тривалого лікування ТЦА (Jackson et al., 2010).
Дані подальшого метааналізу засвідчили, що амітриптилін (100 мг) був ефективнішим, ніж плацебо, у зниженні частоти ГБ на ≥50%, але більшою мірою у пацієнтів із вищою частотою ГБ. Це було визначено на підставі низькоякісних доказів (Shamliyan et al., 2013).
У порівняльних дослідженнях низькі дози (середня доза амітриптиліну 50 мг) ТЦА з більшою ймовірністю сприяли зменшенню частоти ГБ за епізодичної мігрені щонайменше на 50%, ніж СІЗЗС. Результати досліджень, у яких порівнювали β-адреноблокатори і ТЦА, амітриптилін і топірамат, а також амітриптилін і флунаризин, не підтвердили різниці щодо ймовірності зменшення частоти нападів ГБ на 50%. Однак таких досліджень проводили відносно мало, і більшість із них були недостатньо потужними для визначення клінічної еквівалентності (Shamliyan et al., 2013). Зокрема, у 37 дослідженнях застосування різних ТЦА лише сухість у роті та сонливість фіксували частіше в групі їх приймання, ніж плацебо. Деякі ТЦА мали меншу седативну дію за інші (BNF, 2017). Частота відмов від лікування через побічні реакції була подібною у пацієнтів, які приймали як плацебо, так і ТЦА (Jackson et al., 2010). Власне, останні не ліцензовано для лікування пацієнтів із мігренню.
Рекомендації:
- Амітриптилін (25‑150 мг на ніч) розгляньте як засіб профілактичного лікування для пацієнтів з епізодичною або хронічною мігренню.
- Для пацієнтів, які не переносять амітриптилін, розгляньте можливість призначення ТЦА з меншим седативним ефектом.
Кандесартан
Результати систематичного огляду (два РКД середньої якості, які продемонстрували ефективність кандесартану (16 мг) для профілактики мігрені (Jackson et al., 2015). В одному з досліджень повідомлялося про відносне скорочення на 26% днів із ГБ (Tronvik et al., 2003). А в іншому дослідженні кандесартан мав ефективність, подібну до пропранололу (160 мг) щодо вторинного результату – скорочення на ≥50% днів із мігренню (частки респондентів: 43% – кандесартану, 40% – пропранололу і 23% – плацебо) (Stovner et al., 2014). Кандесартан зазвичай добре переноситься (Tronvik et al., 2003). Через тератогенні ефекти рекомендовано уникати застосування кандесартану під час вагітності та годування грудьми (BNF, 2021). Доказова база для кандесартану невелика, і подальші дослідження навряд чи будуть проводити. Однак кандесартан є широко застосовуваним і недорогим препаратом зі сприятливим профілем безпеки і без потенційного впливу на когнітивні функції.
Рекомендації:
- Кандесартан (16 мг на добу) розгляньте як засіб профілактичного лікування для пацієнтів з епізодичною або хронічною мігренню.
- Уникайте призначення кандесартану під час вагітності та годування грудьми. Жінкам, які застосовують кандесартан і планують завагітніти або є вагітними, слід проконсультуватися зі своїм лікарем щодо переходу до іншої терапії.
Вальпроат натрію
У пацієнтів з епізодичною мігренню вальпроат натрію є ефективнішим, ніж плацебо, забезпечуючи зниження частоти ГБ на ≥50% упродовж 8‑12 тижнів (ВР 2,83; 95% ДІ 1,27‑6,31; NNT=3; 95% ДІ 2‑9) за об’єднаними даними двох невеликих досліджень (n=63) при застосуванні доз 400‑1500 мг на добу (Linde et al., 2013). Не виявлено різниці щодо ефективності вальпроату натрію порівняно з флунаризином, і вальпроат натрію (500 мг) не був так само ефективним, як топірамат у високих дозах (400 мг) в об’єднаному аналізі двох невеликих досліджень (Linde et al., 2013). За даними досліджень, які увійшли до Кокранівського огляду, побічні ефекти були легкими, але поширеними, як-от втома, запаморочення, тремор і збільшення ваги (Linde et al., 2013).
Діти, які зазнали впливу вальпроату натрію внутрішньоутробно, мають високий ризик серйозних порушень розвитку та вроджених вад. Тому його не слід застосовувати пацієнткам під час вагітності. Окрім того, є ризик тимчасового порушення фертильності у чоловіків. Комісія з лікарських засобів рекомендує призначати вальпроати пацієнтам (чоловікам і жінкам) віком до 55 років лише, якщо два спеціалісти незалежно розглянуть ситуацію і документально засвідчать, що немає іншого ефективного лікування, яке добре переноситься. Для пацієнтів віком до 55 років, які нині отримують вальпроат, два фахівці мають незалежно розглянути цей випадок і документально засвідчити, що бракує іншого ефективного / переносного лікування, або його ризики не є релевантними (MHRA, 2023). Вальпроат натрію не ліцензовано для лікування пацієнтів із мігренню.
Рекомендації:
- Вальпроат натрію (400‑1500 мг/добу) розгляньте як засіб профілактичного лікування для пацієнтів віком від 55 років з епізодичною або хронічною мігренню.
- Вальпроати не рекомендовано призначати пацієнтам віком до 55 років, тих, хто продовжує їх приймання і відповідає вимогам агентства щодо регулювання обігу лікарських засобів і виробів медичного призначення Великої Британії (MHRA), поінформуйте про ризики для дітей, які зазнали впливу вальпроатів внутрішньоутробно, і про необхідність застосування ефективних засобів контрацепції.
Блокатори кальцієвих каналів (БКК)
За даними досліджень низької якості, переважно 1980-х років, продемонстровано певну, але нестійку перевагу використання верапамілу, німодипіну, ніфедипіну або нікардипіну над плацебо в пацієнтів з епізодичною або хронічною мігренню (Shamliyan et al., 2013; Jackson et al., 2015). Результати метааналізу даних семи невеликих досліджень флунаразину (10 мг/добу) підтвердили його помірну користь у пацієнтів з епізодичною мігренню порівняно з плацебо. Стандартизована середня різниця щодо зменшення частоти ГБ становила -0,60 (95% ДІ від -1,2 до 0,005) через вісім тижнів і -0,84 (95% ДІ від -1,3 до 0,34) через 12 тижнів. Не виявлено значної користі в разі застосування флунаразину протягом чотирьох тижнів (Jackson et al., 2015).
Дані порівняльних досліджень були обмежені, але є деякі докази того, що флунаразин має ефективність, подібну до пропранололу, топірамату та вальпроату натрію (Jackson et al., 2015; NICE, 2014). Флунаразин пацієнти здебільшого добре переносили (NICE, 2014). Пригнічений настрій є можливим побічним ефектом, тому його слід обережно застосовувати у пацієнтів із депресією (NICE, 2014; IPHA, 2017). На думку експертів, слід уникати застосування флунаризину під час вагітності (Gonzalez-Garcia et al., 2022).
Рекомендація
- Флунаризин (10 мг на добу) розгляньте як засіб профілактичного лікування для пацієнтів з епізодичною або хронічною мігренню.
- Уникайте призначення флунаразину пацієнтам під час вагітності та годування грудьми. Жінкам, які застосовують флунаразин і планують завагітніти або є вагітними, слід проконсультуватися зі своїм лікарем щодо переходу до іншої терапії.
Пізотифен
Пізотифен – ліцензований профілактичний засіб, який широко використовують у Великій Британії. Більшість досліджень пізотифену було проведено в 1970-х роках із використанням доз 1,5‑6 мг/день. Зокрема 30‑50% пацієнтів повідомили, що застосування пізотифену зменшує частоту нападів мігрені (Cleland et al., 1997). Було проведено два багатоцентрових дослідження: одне подвійне сліпе контрольоване плацебо (дослідження 1), а інше – відкрите (дослідження 2) для оцінювання того, чи зменшує профілактика пізотифеном (1,5 мг/день) частоту нападів мігрені. Медіана місячної частоти нападів мігрені була нижчою у пацієнтів, які отримували пізотифен і суматриптан, ніж у тих, хто приймав плацебо і суматриптан (дослідження 1; 3,5 проти 3,9), або тільки суматриптан (дослідження 2; 2,9 проти 3,2). Автори дійшли висновку, що пізотифен краще призначати пацієнтам, які мають чотири або більше нападів мігрені на місяць (Cleland et al., 1997). Доказів на підтримку рекомендації недостатньо, але пізотифен – засіб лікування, що добре зарекомендував себе та широко використовується у клінічні практиці.
Габапентин і прегабалін
Є обмежені дані двох невеликих досліджень габапентину, які свідчать, що високі дози препарату (1800‑2400 мг) є значно ефективнішими за плацебо для пацієнтів з епізодичною мігренню. Хоча об’єднані дані шести досліджень габапентину (1000 пацієнтів) не підтверджують його стійку перевагу над плацебо для профілактики епізодичної мігрені у дорослих пацієнтів у будь-якій дозі (Linde et al., 2013). Побічні ефекти були поширеними, особливо в разі застосування високих доз габапентину, як-от втома, запаморочення, грипоподібні симптоми, сонливість і когнітивні розлади (Linde et al., 2013). Доказів щодо застосування прегабаліну в пацієнтів з епізодичною мігренню недостатньо (Linde et al., 2013). Терапія габапентином або прегабаліном пов’язана з підвищеним ризиком розвитку залежності (Health and Social Care Board, 2017).
Рекомендація
- Габапентин не розглядайте як засіб профілактичного лікування для пацієнтів з епізодичною або хронічною мігренню.
Інгібітори ангіотензин-перетворювального ферменту (іАПФ)
За даними систематичного огляду (одне дослідження за участю 60 пацієнтів з епізодичною мігренню, зокрема з АГ або без неї), у якому 12-тижневе лікування лізиноприлом перевершувало плацебо щодо зменшення кількості днів / тяжкості мігрені та болю в тілі, не сприяло зменшенню використання засобів невідкладної терапії (Shamliyan et al., 2013). Результати іншого невеликого РКД (n=24) продемонстрували, що каптоприл зменшує ГБ та ознаки депресії при застосуванні впродовж 32 тижнів (Shamliyan et al., 2013).
Селективні інгібітори зворотного захоплення серотоніну (СІЗЗС) та селективні інгібітори зворотного захоплення серотоніну й норадреналіну (СІЗЗСН)
Кокранівський огляд виявив 11 РКД і одне РКД, у яких СІЗЗС і СІЗЗСН (венлафаксин) відповідно застосовували для лікування пацієнтів із мігренню (Banzi et al., 2015). Більшість із них визнано низькоякісними. Доказів на користь застосування СІЗЗС чи венлафаксину для профілактики мігрені недостатньо. Результати одного дослідження засвідчили, що венлафаксин має ефективність, подібну до амітриптиліну, але краще переноситься (Banzi et al., 2015).
Інші протиепілептичні препарати
За даними Кокранівського огляду не виявлено доказів ефективності ацетазоламіду, ламотриджину, клоназепаму, окскарбазепіну, вігабатрину або зонізаміду в пацієнтів з епізодичною мігренню порівняно з плацебо (Linde et al., 2013). Леветирацетам (1000 мг/добу) перевершував плацебо щодо зменшення частоти ГБ та частки тих, хто відповідав на лікування, але не топірамат (100 мг/день) у зменшенні частоти ГБ. Для визначення його ефективності необхідні подальші дослідження. Карбамазепін перевершував плацебо за часткою тих, хто відповідав на лікування, яке вважалося клінічно значущим, але мало високий рівень побічних ефектів (Linde et al., 2013).
Ботулінічний токсин типу А
Систематичні огляди ефективності ботулінічного токсину типу А ґрунтуються переважно на даних двох великих багатоцентрових РКД оцінювання профілактичної терапії мігрені – PREEMPT 1 і PREEMPT 2. Обидва виконували за участю пацієнтів із хронічною мігренню впродовж 24 тижнів. Пацієнти отримували два набори ін’єкцій з інтервалом 12 тижнів, після чого відбувалася відкрита фаза (Shamliyan et al., 2013; Jackson et al., 2012; Kim et al., 2014). У дослідженні PREEMPT 1 результат за первинною кінцевою точкою – зменшенням кількості епізодів ГБ проти вихідного рівня порівняно з плацебо – був негативним. Хоча виявлено значне поліпшення за вторинними кінцевими точками – зменшення днів із ГБ у разі застосування ботулінічного токсину А порівняно з плацебо (-7,8 проти -6,4; р=0,006) та днів із мігренню (-7,6 проти -6,1; р=0,002) (Aurora et al., 2010).
Первинну кінцеву точку було змінено у дослідженні PREEMPT 2 (до завершення дослідження і перед аналізом даних) на зменшення кількості днів із ГБ. Як було зазначено, це кращий показник, ніж кількість епізодів ГБ у пацієнтів із хронічною мігренню через тривалий безперервний характер їхнього ГБ. Встановлено значне скорочення як днів із ГБ при застосуванні ботулінічного токсину А порівняно з плацебо (-9,0 проти -6,7; p<0,001), так і днів із мігренню (-8,7 проти -6,3; p<0,001) проти вихідного рівня. Крім того, у дослідженні PREEMPT 2 підтверджено значне зменшення кількості епізодів ГБ у разі застосування ботулінічного токсину А порівняно з плацебо (-5,3 проти -4,6; p=0,003) (Diener et al., 2010).
Ретроспективний аналіз об’єднаних даних обох досліджень щодо тих пацієнтів, які раніше застосовували три або більше препаратів для профілактики мігрені, засвідчив більшу різницю, порівняно з плацебо, щодо кількості днів із ГБ та днів із мігренню при застосуванні ботулінічного токсину А (-7,4 проти -4,7; p<0,001) та днів із мігренню (-7,1 проти -4,3; p<0,001) порівняно з початковим рівнем (Scottish Medicines Consortium, 2017).
В обох дослідженнях PREEMPT близько двох третин пацієнтів зловживали засобами невідкладного лікування нападів мігрені. У таких осіб передусім слід розглядати можливість лікування ГБЛЗ, однак у пацієнтів, у яких воно було невдалим, необхідно аналізувати можливість застосування ботулінічного токсину А.
Метааналіз даних досліджень за участю пацієнтів з епізодичною мігренню або ГБ напруження не виявив різниці щодо ефективності застосування ботулінічного токсину А та плацебо (Jackson et al., 2012).
За результатами п’ятьох окремих РКД отримано докази низької сили щодо порівняльної ефективності ботулінічного токсину А порівняно з іншими препаратами для профілактики хронічної мігрені у 350 дорослих віком 18‑65 років із 12‑24 днями мігрені на місяць. Не виявлено суттєвих відмінностей щодо ймовірності запобігання мігрені або зменшення втрати працездатності через мігрень для ботулінічного токсину А порівняно з топіраматом. Абсолютні показники тесту на вплив ГБ (Headache Impact Test) були значно кращими в разі застосування топірамату, ніж ботулінічного токсину А, однак потреба в препаратах невідкладної допомоги для цих двох підходів не відрізнялася. В одному РКД порівнювали вплив ботулінічного токсину А і дивалпроексу натрію; між якими не виявлено відмінностей щодо ефективності профілактики мігрені, пов’язаної з мігренню втрати працездатності або якості життя (Shamliyan et al., 2013).
Небажані явища дещо частіше виникали у пацієнтів, які отримували ін’єкції ботулінічного токсину А, порівняно з тими, хто приймав плацебо (ВР 1,25; 95% ДІ 1,14‑1,36), хоча пацієнти не були більш схильними до припинення дослідження. Серед небажаних явищ – птоз, м’язова слабкість, біль і скутість у шиї, парестезії та зменшення пружності шкіри (Shamliyan et al., 2013; Jackson et al., 2012).
Рекомендації:
- Ботулінічний токсин А не розглядайте як засіб для профілактичного лікування пацієнтів з епізодичною мігренню.
- Ботулінічний токсин А розгляньте для профілактичного лікування пацієнтів із хронічною мігренню, якщо вирішено питання надмірного приймання ліків і не отримано користі після трьох або більше курсів пероральних засобів для профілактики мігрені.
- Ботулінічний токсин А має вводити лише підготовлений персонал під наглядом фахівців клініки з лікування ГБ або місцевої неврологічної служби.
Антитіла до кальцитонін-ген-зв’язаного пептиду (CGRP)
Чотири моноклональні антитіла до CGRP було схвалено до використання в країнах Європи та Північної Америки. Еренумаб специфічний до рецептора CGRP. Фреманезумаб, гальканезумаб та ептинезумаб зв’язують ліганд CGRP. Еренумаб, фреманезумаб і галканезумаб вводять щомісячно підшкірно. Також фреманезумаб можна вводити щоквартально. Ептинезумаб доступний лише у формі щоквартальної внутрішньовенної інфузії.
У низці метааналізів продемонстровано ефективність терапії моноклональними антитілами до CGRP зі значним скороченням кількості днів із мігренню на місяць (ДММ) порівняно з прийманням плацебо у пацієнтів з епізодичною та хронічною мігренню (Alasad et al., 2020; Deng et al., 2020; Gao et al., 2020; Gklinos and Mitsikostas, 2020; Lattanzi et al., 2019). Два РКД – STRIVE та ARISE – вивчали ефективність еренумабу в пацієнтів з епізодичною мігренню (Goadsby et al., 2017; Dodick et al., 2018). У РКД LIBERTY оцінювали його ефективність у пацієнтів з епізодичною мігренню, що важко піддається лікуванню (тобто за неефективності 2‑4 засобів профілактики мігрені) (Reuter et al., 2018). Більшість учасників цих РКД мали високу частоту епізодичних мігреней: 8‑14 днів на місяць. Встановлено значне зниження ДММ в разі застосування еренумабу порівняно з плацебо через 12 тижнів у дослідженнях STRIVE (-3,2 дня – для дози 70 мг; -3,7 дня – для дози 140 мг; -1,8 дня – для плацебо; p<0,001) та ARISE (-2,9 дня – для дози 70 мг; -1,8 дня – для плацебо; p<0,001) (Goadsby et al., 2017; Dodick et al., 2018). Зниження ДММ на >50% виявлено у 43,3% учасників, які приймали еренумаб (70 мг), та у 50%, які отримували еренумаб (140 мг), у дослідженні STRIVE, та у 39,7% у дослідженні ARISE (Goadsby et al., 2017; Dodick et al., 2018).
У групі пацієнтів, які важко піддавалися лікуванню (дослідження LIBERTY), зниження ДММ при застосуванні 140 мг протягом 12 тижнів було нижчим (-1,8 дня), але ліпшим, ніж при застосуванні плацебо (-0,2 дня). Повідомлялося про зниження ДММ на ≥50% у 30% учасників, які отримували еренумабу (140 мг), порівняно з 14%, які приймали плацебо (Reuter et al., 2018).
У пацієнтів із хронічною мігренню високоякісне РКД фази 2 засвідчило значне зниження ДММ при застосуванні еренумабу порівняно з плацебо через 12 тижнів (-6,6 дня – для дози 70 мг; -6,6 дня – для дози 140 мг; -4,2 дня – для плацебо; р<0,001) проти вихідного рівня 18 ДММ (Tepper et al., 2017). Зокрема, у 40% учасників, які приймали 70 мг, та у 41%, які застосовували 140 мг, виявлено зниження ДММ на ≥50%. Препаратами невідкладного лікування зловживали 41% пацієнтів, які брали участь у дослідженні. Результати подальшого дослідження пацієнтів з епізодичною мігренню підтвердили, що зниження ДММ було стійким (Ashina et al., 2021; Sun et al., 2016). Пацієнти, які отримували плацебо, були переведені на приймання еренумабу (70 мг) щомісяця і досягли на 16-му тижні зниження ДММ порівняного з таким у групі, яка була рандомізована для такої терапії з початку РКД. Дозу 70 мг пацієнти продовжували приймати до 64-го тижня, а потім її збільшили до 140 мг. Середня зміна ДММ проти вихідного рівня 8,7 становила -5,3 дня за 5 років, а зниження на ≥50% досягнули 71% учасників дослідження (Ashina et al., 2021).
У дослідженні HALO за епізодичної мігрені порівнювали ефективність щомісячних доз фриманезумабу (225 мг) зі щоквартальними дозами (675 мг) або плацебо. Вихідна кількість днів мігрені становила 8,9±2,6 дня для когорти, яка отримувала щомісячну дозу, і 9,3±2,7 дня для когорти за щоквартальної дози. Зокрема, встановлено значне зниження ДММ (-3,7 дня у групі, яка отримувала фриманезумаб щомісячно (225 мг), проти -3,4 дня за приймання фриманезумабу щоквартально (675 мг), проти -2,2 дня за приймання плацебо, p<0,001) (Dodick et al., 2018). У 41% учасників підтверджено зниження ДММ на ≥50% за щомісячного та у 44,4% щоквартального застосування; кількість таких учасників збільшилася до 68 і 66% відповідно через 12 місяців (Dodick et al., 2018; Goadsby et al., 2020).
До того ж у когорті пацієнтів із хронічною мігренню в дослідженні HALO спостерігалося значне зниження ДММ порівняно з плацебо через 12 тижнів (-5,0 дня у групі, яка отримувала фриманезумаб щомісяця (675 мг навантажувальної дози і надалі по 225 мг щомісяця); -4,9 дня – щоквартального приймання фриманезумабу (675 мг); -3,2 дня – за використання плацебо; p<0,001) (Silberstein et al., 2017). Зниження ДММ на ≥50% виявлено у 47,7% при застосуванні щомісячної дози та у 38% – щоквартальної дози, кількість таких учасників збільшилася до 57 і 53% відповідно через 12 місяців (Silberstein et al., 2017; Goadsby et al., 2020).
У дослідженні FOCUS у пацієнтів, які не досягли успіху за допомогою до чотирьох попередніх засобів (серед яких 60% пацієнтів мали хронічну мігрень, а 40% – епізодичну), зниження ДММ через 12 тижнів становило -4,1 дня за щомісячного приймання фриманезумабу (225 мг) і -3,7 дня – щоквартального застосуваня фриманезумабу (675 мг).
Значне зменшення ДММ порівняно з плацебо через 12 тиж. встановлено у двох РКД галканезумабу (EVOLVE1 та EVOLVE2) у пацієнтів з епізодичною мігренню (EVOLVE1: -4,7 дня – для дози 120 мг, -4,6 дня – для дози 240 мг, -2,8 дня – для плацебо; р<0,001; EVOLVE2: -4,3 дня – для дози 120 мг, -4,2 дня – для дози 240 мг,-2,3 дня – для плацебо, p<0,001) (Stauffer et al., 2018; Skljarevski et al., 2018). У межах EVOLVE1 зниження ДММ на ≥50% спостерігалося у 62,3 і 60,9% учасників, які приймали 120-240 мг відповідно; у межах EVOLVE2 – у 59,3 і 56,5% учасників, які приймали 120 і 240 мг відповідно. Базовий показник ДММ у EVOLVE1 становив 9,2±3,1 і 9,1±2,9 дня у групах застосування 120 і 240 мг, а в EVOLVE2 – 9,07±2,9 і 9,06±2,9 дня у групах 120 і 240 мг відповідно. У РКД ефективності галканезумабу REGAIN у пацієнтів із хронічною мігренню (64% зловживали засобами невідкладного лікування) було досягнуто значного зниження ДММ порівняно з плацебо через 12 тижнів (-4,8 дня – для дози 120 мг, -4,6 дня – для дози 240 мг, -2,7 дня – для плацебо; р<0,001; базовий показник ДММ 19,4 дня) (Detke et al., 2018). Зниження ДММ на ≥50% зафіксовано у 27,6 і 27,5% учасників, які приймали 120 і 240 мг відповідно. Продовжили лікування у відкритому дослідженні 99% пацієнтів, 81% із них завершили 12-місячний курс лікування. На третьому місяці всі пацієнти отримали навантажувальну дозу галканезумабу 240 мг, а потім – підтримувальні дози 120 мг/міс. або, на розсуд лікаря, 240 мг/міс. Через 12 місяців було досягнуто зменшення ДММ: -9,0 дня – у групі, що початково застосовувала 120 мг; -8,0 дня – у групі, що початково отримувала 240 мг і -8,5 дня – плацебо (Pozo-Rosich et al., 2022).
У межах РКД CONQUER за участю пацієнтів із мігренню, що важко піддається лікуванню, учасники отримували галканезумаб (120 мг) або плацебо (Mulleners et al., 2020). Дизайн передбачав отримання навантажувальної дози – дві ін’єкції галканезумабу по 120 мг або дві ін’єкції плацебо. Через 12 тиж. у пацієнтів з епізодичною мігренню зниження ДММ становило -2,9 дня для галканезумабу і -0,3 дня – для плацебо (p<0,0001); у 48,1% зафіксовано зменшення ДММ на ≥50%. Зокрема, у пацієнтів із хронічною мігренню зниження становило -6,0дня для галканезумабу і -2,2 дня – для плацебо (р<0,0001), а у 32% спостерігалося зниження ДММ на ≥50% (Mulleners et al., 2020). Крім двох, усі пацієнти перейшли до відкритої фази, і 96% із них завершили дослідження (Reuter et al., 2021). Усі пацієнти, які раніше приймали плацебо, на третьому місяці отримали навантажувальну дозу 240 мг (дві ін’єкції галканезумабу по 120 мг в групі плацебо; одну ін’єкцію 120 мг галканезумабу і одну ін’єкцію плацебо в групі, яка раніше застосовувала 120 мг галканезумабу). Через 6 місяців зменшення ДММ становило: у пацієнтів з епізодичною мігренню -3,8 дня у групі, що раніше отримувала 120 мг, і -4,5 дня – плацебо, а в осіб із хронічною мігренню -8,2 дня у групі, що раніше отримувала 120 мг, і -6,5 дня – плацебо (Reuter et al., 2021).
У пацієнтів з епізодичною мігренню у РКД ефективності ептинезумабу PROMISE1 спостерігалося значне зниження ДММ порівняно з плацебо через 12 тижнів при застосуванні в дозах 100 і 300 мг (-3,9 дня для дози 100 мг [р=0,0182]; -4,3 дня – для дози 300 мг [p=0,0001]; -3,2 дня – для плацебо) (Ashina et al., 2020). Зокрема, у 48,9 і 56,3% учасників, які приймали по 100 і 300 мг ептинезумабу відповідно, спостерігалося зниження ДММ на >50%; у 22,2 і 29,7% учасників, які приймали по 100 і 300 мг ептинезумабу відповідно, спостерігалося зниження індексу маси тіла (ІМТ) на >75%. Профілактичний ефект фіксували вже в перший день після приймання препарату: така частка пацієнтів із мігренню становила 14,8 і 13,9% за приймання 100 і 300 мг препарату відповідно та 22,5% – у разі застосування плацебо. Базовий показник ДММ становив 8,7 і 8,6 дня у групах, які отримували 100 і 300 мг ептинезумабу та 8,4 дня – у групі застосування плацебо (Ashina et al., 2020).
У РКД ептинезумабу PROMISE2 у пацієнтів із хронічною мігренню фіксували значне зниження ДММ порівняно з плацебо через 12 тижнів при застосуванні препарату в дозах 100 і 300 мг (-7,6 і -8,2 дня відповідно; -5,7 дня – для плацебо; p<0,0001) (Lipton et al., 2020). Зокрема, у 57,6 і 61,4% учасників, які приймали 100 і 300 мг ептинезумабу, спостерігалося зниження ДММ на >50%, а у 26,7 і 33,1% учасників, які приймали 100 і 300 мг ептинезумабу, спостерігалося зниження ІМТ на >75%. Профілактичний ефект фіксували вже з першого дня приймання (частка пацієнтів із мігренню становила 28,6 і 27,8% за 100 і 300 мг ептинезумабу відповідно проти 42,3% – за плацебо). Базовий показник ДММ становив 16,1 дня в групах, які отримували 100 і 300 мг ептинезумабу, та 16,2 дня – у групі плацебо (Lipton et al., 2020).
Пацієнти з епізодичною і хронічною мігренню, які мали досвід до чотирьох курсів невдалого профілактичного лікування мігрені, брали участь у дослідженні DELIVER (Ashina et al., 2022). Спостерігалося значне зниження середнього показника ДММ порівняно з плацебо через 12 тижнів приймання 100 і 300 мг ептинезумабу (-4,8 дня – для дози 100 мг; -5,3 дня – для дози 300 мг; -2,1 дня – для плацебо; p<0,0001). Цей ефект зберігався і через 24 тижні (-5,4 дня – для дози 100 мг; -6,1 дня – для дози 300 мг; -2,0 дня – для плацебо; p<0,0001). Через 12 тижнів фіксували зниження середніх показників ДММ на >50% у 42 і 49%учасників, які приймали 100 і у 300 мг ептинезумабу, а також зниження середніх значень ДММ на >75% у 16 і 17% учасників, які отримували 100 і 300 мг ептинезумабу відповідно.
Еренумаб був ефективнішим за топірамат для зниження показника ДММ (-5,86 дня – у групі приймання еренумабу проти -4,02 дня – топірамату). У 55,4% учасників у групі застосування еренумабу спостерігалося зниження ДММ на ≥50% проти 31,2% – у групі топірамату. Крім того, еренумаб переносився значно краще за топірамат у стандартних дозах (Reuter et al., 2021).
Результати аналізу підгруп пацієнтів із мігренню та супутнім надмірним вживанням ліків у дослідженнях еренумабу, фриманезумабу та галканезумабу продемонстрували ефективність препаратів, подібну до такої в осіб без надмірного вживання ліків (Dodick et al., 2021; Silberstein et al., 2020; Tepper et al., 2019). Дані аналізу в підгрупах засвідчили, що застосування моноклональних антитіл до CGRP сприяло зменшенню вживання препаратів для невідкладного лікування нападів мігрені. Є обмежена кількість даних щодо результатів переходу на інші препарати моноклональних антитіл до CGRP, якщо лікування першими виявилося неефективним (Overeem et al., 2022; Patier Ruiz et al., 2022).
Усі чотири препарати моноклональних антитіл до CGRP добре переносилися пацієнтами. Зокрема, у РКД фіксували незначні побічні явища, які були подібними для груп лікування та плацебо. Реакції в місці ін’єкції були найпоширенішим небажаним явищем, про яке повідомлялося щодо препаратів для підшкірних ін’єкцій (Alasad et al., 2020; Deng et al., 2020; Gao et al., 2020; Gklinos and Mitsikostas, 2020; Lattanzi et al., 2019). Легкі або помірні реакції гіперчутливості фіксували у невеликої кількості пацієнтів у дослідженнях ептинезумабу (Ashina et al., 2020; Lipton et al., 2020; Ashina et al., 2022). Однак у двох пацієнтів, які отримували ептинезумаб (300 мг) у дослідженні DELIVER, виникла анафілактична реакція, пов’язана з досліджуваним препаратом (Ashina et al., 2022).
Пацієнтів із високим ризиком ішемічної хвороби серця (ІХС) було виключено з досліджень. В об’єднаному аналізі РКД 8% учасників (дослідження фриманезумабу) мали АГ; 17,2% (дослідження галканезумабу) – СС ризик; від 6,6 до 9,9% (дослідження еренумабу) – в анамнезі судинні розлади, найчастіше АГ (Diener et al., 2022; Kudrow et al., 2020; Oakes et al., 2020). АГ також виявлено у невеликої кількості пацієнтів, які застосовували еренумаб; інформація про призначення цих препаратів у США скоригована (Saely et al., 2021). Є обмежена кількість даних щодо безпеки застосування моноклональних антитіл до CGRP під час вагітності та годування грудьми (BNF, 2021). До отримання додаткових даних моноклональні антитіла до CGRP не слід використовувати під час вагітності або годування грудьми. Перед плануванням вагітності рекомендовано не приймати ці засоби впродовж 6 місяців. Початок лікування моноклональними антитілами до CGRP має відбуватися під керуванням невролога чи фахівця з ГБ, а пацієнти, які отримують це лікування, потребують навчання та відповідного моніторингу. У разі підшкірного введення препаратів пацієнти або їхні опікуни мають правильно зберігати ліки для самостійного введення ін’єкцій. Для внутрішньовенного введення ептинезумабу пацієнти потребуватимуть госпіталізації (або відповідної альтернативи).
Рекомендації:
- Еренумаб, фреманезумаб, галканезумаб та ептинезумаб розгляньте як засоби профілактичного лікування для пацієнтів із хронічною мігренню, якщо вирішено питання надмірного застосування ліків і не отримано користі внаслідок застосування трьох або більше курсів пероральних профілактичних засобів для лікування мігрені.
- Фреманезумаб, галканезумаб та ептинезумаб розгляньте як засоби профілактичного лікування пацієнтів з епізодичною мігренню, якщо вирішено питання надмірного застосування ліків і не отримано користі внаслідок застосування трьох або більше курсів пероральних профілактичних засобів для лікування мігрені.
- Застосування моноклональних антитіл до CGRP розпочніть лише після консультації з неврологом або спеціалістом із ГБ.
- Перед призначенням моноклональних антитіл до CGRP ретельно зважте потенційні ризики та користь для пацієнтів із високим ризиком ішемічної хвороби серця.
- Уникайте призначення моноклональних антитіл до CGRP пацієнткам під час вагітності та годування грудьми. Перед плануванням вагітності рекомендовано не застосовувати препарат щонайменше впродовж шести місяців.
- Усуньте ГБ, спричинений надмірним вживанням ліків, до початку лікування антитілами до CGRP. Однак у пацієнтів, у яких лікування ГБЛЗ було безуспішним, розгляньте можливість застосування моноклональних антитіл до CGRP.
Блокада потиличного нерва
У чотирьох невеликих РКД визначали короткострокові переваги (від одного до чотирьох тижнів) блокади великого потиличного нерва, де використовували різні схеми. Результати трьох із них засвідчили зниження частоти ГБ порівняно з плацебо (Ashkenazi et al., 2008; Cuadrado et al., 2017; Inan et al., 2015). За даними іншого дослідження не виявлено різниці, однак це могло бути пов’язано з тим, що група плацебо отримувала низьку дозу лідокаїну (Dilli et al., 2015). Вказаний метод популярний у Шотландії, втім, необхідні додаткові докази, перш ніж можна зробити рекомендації щодо його застосування.
Профілактика мігрені, пов’язаної з менструацією
Зниження рівня естрогену безпосередньо перед менструацією є тригером мігрені. У жінок мігрень є частішою, тяжчою, і вона складніше піддається лікуванню безпосередньо перед і під час менструації (Vetvik et al., 2017; MacGregor, 2007). У деяких пацієнток мігрень виникає тільки (істино менструальна) або переважно (пов’язана з менструацією) у період від двох днів до початку кровотечі до трьох днів після неї. Тож у цих жінок перименструальні стратегії можливо використовувати замість або на додаток до стандартної безперервної профілактики. Щоб лікування мало результат, менструальний цикл має бути регулярним.
Триптани
За результатми метааналізу, триптани знижували частоту як істино менструальної, так і пов’язаної з менструацією мігрені порівняно з плацебо. Фроватриптан (2,5 мг 1 і 2 рази/добу) також був ефективним для зниження вторинних показників щодо тяжкості мігрені та потреби в препаратах для невідкладного лікування нападу. Небажані явища, пов’язані з прийманням препарату, були низькими і подібними до таких для плацебо за обох схем приймання. Золмітриптан (2,5 мг 2 і 3 рази/добу) також зменшував потребу в препаратах для невідкладного лікування нападу, а пов’язані з прийманням препарату небажані явища були подібними до таких за приймання плацебо (Hu et al., 2013).
Результати пілотного відкритого дослідження, у якому порівнювали фроватриптан та трансдермальні естрогени або напроксен, засвідчили, що частота виникнення менструальної мігрені була значно нижчою в разі застосування фроватриптану, ніж інших методів лікування (Nierenburg et al., 2015).
Рекомендації:
- Фроватриптан (2,5 мг двічі на добу) розгляньте як засіб профілактичного лікування у жінок із перименструальною мігренню у період від двох днів до початку кровотечі до трьох днів після неї.
- Золмітриптан (2,5 мг тричі на добу) або наратриптан (2,5 мг двічі на добу) розгляньте як альтернативу фроватриптану як засіб профілактичного лікування у жінок із перименструальною мігренню у період за два дні до і трьох днів після початку кровотечі.
- Жінкам із мігренню, пов’язаною з менструацією, які приймають триптани в інші дні місяця, повідомте, що додаткова перименструальна профілактика підвищує ризик розвитку ГБ, пов’язаного з надмірним застосуванням ліків.
Інгібітори простагландинів. Хоча є невелика кількість доказів того, що мефенамінова кислота ефективна для лікування гострих нападів мігрені у пацієнток із менструальною мігренню, не виявлено досліджень щодо її застосування для перименструальної профілактики (Nierenburg et al., 2015).
НПЗП. В одному РКД повідомлялося про значне полегшення ГБ при застосуванні напроксену, яке сягнуло понад 50% через три місяці, однак різниця порівняно з плацебо була незначущою (Nierenburg et al., 2015).
Естрогени. За даними одного невеликого перехресного РКД (n=37), у якому оцінювали ефективність естрадіолу, застосовуваного з десятого дня після першого дня піку фертильності до другого повного дня менструації, підтверджено зменшення ДММ на 22%, але за цим слідувало збільшення на 40% впродовж п’яти днів після приймання естрадіолу (Nierenburg et al., 2015).
Гормональна профілактика. Результати трьох досліджень із використанням комбінованих оральних контрацептивів засвідчили їхню користь для профілактики менструальної мігрені. Проте вони були недостатньо якісними, щоб зробити висновки (Nierenburg et al., 2015).
Головний біль, пов’язаний із надмірним застосуванням ліків
Більшість випадків ГБЛЗ є ускладненням мігрені (Diener et al., 2016). Часте вживання препаратів для невідкладного лікування нападів мігрені збільшує частоту та інтенсивність ГБ. Лікування стає причиною ГБ, а не засобом порятунку, і виникає замкнене коло збільшення вживання ліків та посилення ГБ. У цій групі пацієнтів скасування ліків, які вони надмірно застосовують, може зменшити частоту та інтенсивність ГБ. Проте вона часто пов’язана з тимчасовим збільшенням частоти та інтенсивності ГБ, тому слід попередити пацієнтів про це. Чинники ризику розвитку ГБЛЗ охоплюють частий ГБ, повторюване застосування препаратів для невідкладного лікування ГБ, інший больовий синдром і супутню психіатричну патологію (Diener et al., 2016). Вважається, що застосування триптанів, ерготамінів, комбінованих аналгетиків та/або опіоїдів упродовж ≥10 днів на місяць, а також простих аналгетиків – ≥15 днів на місяць спричиняє виникнення ГБЛЗ (IHS, 2013). Показово, що не всі пацієнти, які зловживають препаратами для невідкладного лікування ГБ, страждають на ГБЛЗ, – у деяких мігрень погано піддається лікуванню (Diener et al., 2016). Щодо ефективного лікування ГБЛЗ залишається багато запитань. У низці невеликих РКД (непорівняльних спостережних і ретроспективних досліджень) зазначено різні стратегії, які є ефективними для зменшення ГБЛЗ:
- Різке скасування ліків (за допомогою простих порад або структурованої програми детоксикації) (Boe et al., 2009; Munksgaard et al., 2012; Pijpers et al., 2016; Rossi et al., 2013).
- Раптова відміна ліків із профілактикою (Munksgaard et al., 2012; Rossi et al., 2013; Grazzi et al., 2013; Krymchantowski et al., 2016; Trucco et al., 2010).
- Профілактика без скасування ліків (Diener et al., 2007; Hagen et al., 2009, 2011).
Нині бракує порівняльних досліджень, щоб визначити, чи всі пацієнти мають проходити процес відміни медикаментозних засобів перед початком профілактичного лікування, скільки має тривати цей період, чи слід починати превентивну терапію раніше або відкласти її до визначення ефекту внаслідок завершення скасування / детоксикації. Бракує також доказів щодо того, де найкраще досягається детоксикація – в умовах первинної ланки, спеціалізованої (неврологічної) амбулаторної допомоги чи стаціонару. Амбулаторну відміну рекомендують передусім пацієнтам із неускладненим ГБЛЗ (Creac’h et al., 2011). Для пацієнтів з ускладненим ГБЛЗ відміна ліків у стаціонарі може бути ефективнішою, вони можуть отримати користь внаслідок застосування мультидисциплінарних програм лікування (Munksgaard et al., 2012).
Супутні захворювання можуть знизити ймовірність успішної відміни лікарських засобів (Rossi et al., 2011). Для профілактичної терапії є докази на користь застосування ботуліничного токсину А без потреби в різкому скасуванні надмірно застосовуваних ліків (Negro et al., 2015; Sandrini et al., 2011; Silberstein et al., 2013). Так, за даними невеликих РКД, кількість днів із ГБ зменшується в разі застосування топірамату або вальпроату (Diener et al., 2007; Sarchielli et al., 2014). У непорівняльному обсерваційному дослідженні пацієнти, які раніше не реагували на превентивне лікування, відповідали на нього, якщо воно було призначено повторно після вирішення питання надмірного застосування ліків (Zeeberg et al., 2006). З огляду на те, що застосування стероїдів асоціюються з побічними ефектами, а доказів їхньої користі бракує, преднізолон не варто рутинно використовувати для лікування пацієнтів із ГБЛЗ (Boe et al., 2007; Rabe et al., 2013; Taghdiri et al., 2015). Часто напроксен використовують у клінічній практиці як засіб перехідного лікування. Наразі не виявлено даних щодо його застосування у пацієнтів із ГБЛЗ, а також досліджень щодо блокади великого потиличного нерва або комбінацій триптанів, аналгетиків, НПЗП або опіоїдів.
Рекомендації:
- У пацієнтів, які зловживають препаратами для невідкладного лікування ГБ, вирішіть питання надмірного застосування ліків.
- Вибір стратегії для розв’язання проблеми надмірного застосування ліків адаптуйте до конкретного пацієнта, який може залежати від супутніх захворювань.
- Преднізолон не призначайте рутинно для лікування пацієнтів із ГБ, пов’язаним із надмірним застосуванням ліків.
Апаратні методики лікування мігрені
Використання пристроїв для лікування мігрені може слугувати альтернативою або доповненням до фармакологічної терапії, але на зараз бракує достатньої кількості проведених досліджень щодо їхньої ефективності та безпеки (NICE, 2014, 2016). За даними одного невеликого РКД щодо безпеки та переносимості неінвазивної стимуляції блукаючого нерва для профілактики мігрені, не виявлено проблем із застосуванням цього методу, але це дослідження було недостатньо потужним для визначення достовірної ефективності такого підходу (Silberstein et al., 2016). Також виявлено лише одне РКД, у межах якого використовували транскраніальну магнітну стимуляцію для лікування нападів мігрені. Метод забезпечив усунення ГБ протягом 2 год у 39% пацієнтів із нападом мігрені порівняно з 22%осіб, які отримували плацебо (Lipton et al., 2010).
Підготувала Тетяна Ткаченко
Оригінальний текст документа читайте на сайті
https://www.sign.ac.uk/our-guidelines/pharmacological-management-of-migraine
Тематичний номер «Неврологія. Психіатрія. Психотерапія» № 4 (67) 2023 р.
СТАТТІ ЗА ТЕМОЮ Неврологія
Стрес і тривожність чинять потужний несприятливий вплив і на самопочуття окремих індивідуумів, і на загальний стан здоров’я всієї популяції світу. Цей несприятливий вплив значно підсилили пандемія COVID‑19 та війна в Україні (Celuch M. et al., 2023)....
16-17 лютого в Києві відбувся науково-практичний майстер-клас «Хронічний стрес сьогодення: обрані запитання про здоров’я жінки в різні вікові періоди». Під час заходу виступили фахівці різних спеціальностей, було обговорено важливі аспекти жіночого здоров’я як психологічного, так і фізичного. Доповіді присвячувалися різноманітним питанням, зокрема репродуктивним проблемам, онкологічним захворюванням, психосоматичним розладам. Під час події виступила засновниця Академії довголіття Dr. Skytalinska, віцепрезидент Асоціації дієтологів України, лікар-дієтолог Оксана Василівна Скиталінська. Доповідь Оксани Василівни була присвячена впливу тривалого стресу на харчування та пов’язані з цим наслідки для здоров’я жінок. Окрім пояснення механізмів негативного впливу стресу, під час доповіді лікарка також надала важливі практичні рекомендації стосовно здорового харчування....
Події останніх 5 років є неабияким викликом для психічного стану кожного українця: спочатку – пандемія коронавірусу та запроваджені через неї карантинні обмеження, а далі – повномасштабне російське вторгнення, що триває уже понад 2 роки. Все це спричиняє погіршення психічного здоров’я населення. Такі надзвичайні ситуації, що характеризуються загрозою з невизначеною тривалістю, створюють масивне стресове навантаження, яке підсилюється відчуттям самотності та відчуженості, підвищують тривожність, а також є підґрунтям розвитку психічних розладів. Відомо, що ці стани порушують розумову діяльність, тобто перешкоджають концентрації та аналізу інформації. ...
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....