Лікування пацієнтів із гострим коронарним синдромом
Гострий коронарний синдром (ГКС) являє собою сукупність клінічних симптомів, які вирізняються гострою ішемією міокарда при порушенні кровопостачання серцевого м’яза, що відбувається через зменшення кровотоку в коронарних артеріях (КА). Внаслідок цього може розвинутися некроз тканин або статися зупинка серця. За своєчасної діагностики й терапії повне одужання пацієнта із ГКС є цілком можливим, зволікання ж нерідко призводить до летальних наслідків. Робоча група з лікування ГКС Європейського товариства кардіологів (ESC, 2023) розробила настанови щодо лікування пацієнтів із гострим коронарним синдромом, у якій оцінено й узагальнено сучасні наукові докази для допомоги клініцистам під час вибору оптимальної діагностичної або терапевтичного тактики в цій популяції хворих. Пропонуємо до вашої уваги основні положення цих рекомендацій.
Як відомо, ГКС пов’язаний із широким спектром клінічних ознак. Так, на момент звернення до лікаря симптомів може не бути, або можливі скарги на стійкий дискомфорт / біль за грудниною, а також зупинка серця, електрична / гемодинамічна нестабільність чи кардіогенний шок (КШ). Загалом під ГКС розуміють два стани з подібними ознаками: інфаркт міокарда (ІМ), що виникає через закупорювання судини на >70%, і нестабільну стенокардію – період загострення ішемічної хвороби серця.
Насамперед в осіб із підозрою на ГКС рекомендовано виконати електрокардіограму (ЕКГ), а потім визначити рівень серцевого тропоніну (cTр). Ці ознаки є важливими для класифікації пацієнтів із ГКС на групи ризику для відповідної діагностики та визначення початкової стратегії терапії. Після фази невідкладного лікування та стабілізації стану хворих більшість аспектів подальшої терапії є спільними для всіх пацієнтів із ГКС незалежно від початкових результатів обстеження. Однак на кожному етапі ведення пацієнтів із ГКС клініцисти мають приділяти значну увагу іншим диференційним діагнозам, оскільки вони можуть бути пов’язані зі складними патологічними механізмами, мати різні прогнози та нерідко потребувати окремих підходів до лікування.
У таблицях 1 і 2 наведено класи рекомендацій і рівні доказовості, що лежать в основі настанов з лікування пацієнтів із гострим коронарним синдромом.
|
Таблиця 1. Класи рекомендацій |
||
|
Клас |
Визначення |
Роз’яснення |
|
Клас І |
Докази та/або загальна згода стосовно того, що лікування чи процедура мають переваги, є корисними та ефективними |
Рекомендовано або показано |
|
Клас ІІ (ІІа, ІІb) |
Суперечливі докази та/або розбіжності в думках щодо користі / ефективності лікування чи процедури |
Слід (ІІа) або можна (ІІb) розглянути |
|
Клас ІІІ |
Докази або загальна згода, що лікування чи процедура не є корисними / ефективними, а в деяких випадках можуть бути шкідливими |
Не рекомендовано |
|
Таблиця 2. Рівні доказовості |
|
|
Рівень |
Визначення |
|
Рівень А |
Дані, отримані з багатьох рандомізованих клінічних досліджень або метааналізів |
|
Рівень В |
Дані, отримані з одного рандомізованого клінічного випробування або великих нерандомізованих досліджень |
|
Рівень С |
Консенсус думок експертів та/або дані, отримані з невеликих, ретроспективних досліджень, реєстрів |
Діагностична оцінка та диференціація хворих
Клінічна картина
Гострий дискомфорт у грудній клітці, який можна описати як біль, стиснення, тяжкість або печіння, є основним симптомом, що свідчить про наявність у пацієнта ГКС та необхідність проведення початкового тестування відповідно до специфічних діагностичних алгоритмів. Симптомами, еквівалентними болю у грудях, є задишка, біль в епігастральній ділянці, лівій / правій руці або шиї / щелепі. Помилковий діагноз або пізнє його встановлення інколи зумовлені неповним анамнезом або труднощами у виявленні симптомів. Для чіткого розуміння складності симптоматики, пов’язаної з ГКС, вирішальне значення мають ретельний збір анамнезу та взаємодія із хворим, що може сприяти ранній, точній діагностиці та, відповідно, визначенню швидкого та оптимального лікування.
Клініко-діагностичне обстеження в разі підозри на ГКС
Діагностика і початкова короткострокова стратифікація ризику ГКС мають ґрунтуватися на аналізі клінічного анамнезу, симптомів, життєво важливих ознак, інших фізикальних даних, ЕКГ і рівні високочутливого сТр (клас рекомендації І, рівень доказовості В) (Collet et al., 2021).
ЕКГ у 12 відведеннях у стані спокою є діагностичним інструментом першої лінії під час обстеження осіб із підозрою на ГКС. Рекомендовано якнайшвидше зробити запис та інтерпретацію ЕКГ у 12 відведеннях під час першого медичного контакту з цільовою тривалістю <10 хв (клас рекомендації І, рівень доказовості В) (Rokos et al., 2009).
Пацієнтів із підозрою на ІМ з елевацією сегмента ST (STEMI) слід негайно скеровувати для здійснення екстреної реперфузійної терапії (клас рекомендації І, рівень доказовості А).
Крім того, у всіх осіб із підозрою на STEMI, ГКС з іншими змінами на ЕКГ або болем у грудях, що триває, і після підтвердження діагнозу ІМ важливо виконати безперервний ЕКГ-моніторинг, а також має бути можливість застосування дефібрилятора (клас рекомендації І, рівень доказовості В) (Mehta et al., 2009).
Використання додаткових відведень ЕКГ (V3R, V4R і V7-V9) рекомендовано у разі нижнього STEMI, або якщо є підозра щодо наявності повної оклюзії судини, а стандартні відведення не дають точних результатів (клас рекомендації І, рівень доказовості В) (Zalenski et al., 1997).
У разі виникнення рецидиву симптомів або неможливості встановити діагноз доцільно виконати додаткову ЕКГ у 12 відведеннях (клас рекомендації І, рівень доказовості С). Слід якнайшвидше визначити концентрацію cTр за допомогою високочутливих досліджень та отримати результати протягом 60 хв після забору крові (клас рекомендації І, рівень доказовості В) (Reichlin et al., 2012; Neumann et al., 2019).
Для підтвердження чи виключення ІМ без елевації сегмента ST (NSTEMI) рекомендовано використовувати алгоритмічний підхід ESC із послідовними визначеннями високочутливого cTр (0 год/1 год або 0 год/2 год) (клас рекомендації І, рівень доказовості В) (Boeddinghaus et al., 2021; Koechlin et al., 2021).
Якщо перші два визначення високочутливого cTр за алгоритмом 0 год/1 год не дали чітких результатів, і не встановлено альтернативних діагнозів, що пояснюють стан хворого, доцільним є додаткове тестування через 3 год (клас рекомендації І, рівень доказовості В) (Lopez-Ayala et al., 2021).
Неінвазивна візуалізація під час первинного обстеження
За підозри в пацієнта ГКС і наявності нечітких діагностичних результатів може бути корисною трансторакальна ехокардіографія для виявлення ознак, які вказують на ішемію, що триває, або перенесений ІМ. Невідкладну трансторакальну ехокардіографію слід виконувати пацієнтам із підозрою на ГКС та КШ або можливими механічними ускладненнями (клас рекомендації І, рівень доказовості С). Не рекомендовано рутинну ранню комп’ютерно-томографічну ангіографію КА особам із підозрою на ГКС (клас рекомендації ІІІ, рівень доказовості В) (Gray et al., 2021).
Принципи надання первинної допомоги при ГКС
Особи з підозрою на STEMI мають високий ризик негайних ускладнень, що загрожують життю, наприклад фібриляції шлуночків. Це передбачає можливість оперативного та ефективного застосування реперфузійної терапії, до того ж первинне черезшкірне коронарне втручання (ЧКВ) має бути доступним для якомога більшої кількості пацієнтів (клас рекомендації І, рівень доказовості В) (Kalla et al., 2006).
Послуги щодо виконання ЧКВ у спеціалізованих центрах мають надаватися цілодобово, без вихідних і зволікань (клас рекомендації І, рівень доказовості В) (Hall et al., 2016).
Адже час до початку терапевтичного втручання у пацієнтів із попереднім діагнозом STEMI має важливе значення. Кандидатів на первинне ЧКВ слід скеровувати безпосередньо до лабораторії катетеризації, минаючи відділення невідкладної допомоги та реанімації / інтенсивної терапії (клас рекомендації І, рівень доказовості В) (Baran et al., 2010; Bagai et al., 2013).
Застосування кисневої терапії рекомендоване особам із підозрою на STEMI та гіпоксемією (сатурація O2 <90%) (клас рекомендації І, рівень доказовості С). За сатурації кисню >90% у таких хворих потреби в кисневій терапії немає (клас рекомендації ІІІ, рівень доказовості А) (Stub et al., 2015).
Бригади швидкої допомоги мають бути навчені та обладнані для виявлення ЕКГ-патернів, що вказують на гостру коронарну оклюзію, а також для проведення початкового лікування, зокрема дефібриляції та фібринолізу, якщо це можливо (клас рекомендації І, рівень доказовості С) (Welsh et al., 2005). Усі лікарні та служби швидкої медичної допомоги мають реєструвати й перевіряти час затримки під час надання допомоги пацієнтам із попереднім діагнозом STEMI та працювати разом для досягнення і підтримання належної якості послуг (клас рекомендації І, рівень доказовості С).
Реперфузійна терапія та інвазивні стратегії
Процедури реперфузії у пацієнтів зі STEMI
Реперфузійну терапію рекомендовано всім хворим зі встановленим діагнозом STEMI та симптомами ішемії тривалістю ≤12 год (клас рекомендації І, рівень доказовості А) (Betriu et al., 2005). Первинне ЧКВ має переваги перед фібринолізом, якщо очікуваний час від встановлення діагнозу до ЧКВ становить £120 хв (клас рекомендації І, рівень доказовості А) (Dalby et al., 2003). Якщо в пацієнтів із попереднім діагнозом STEMI виконання своєчасного первинного ЧКВ (<120 хв) неможливе, доцільною є фібринолітична терапія протягом 12 год після появи симптомів за відсутності протипоказань (клас рекомендації І, рівень доказовості А) (Pinto et al., 2011).
Рятувальне ЧКВ рекомендоване в разі невдалого фібринолізу (за регресії сегмента ST <50% упродовж 60‑90 хв після введення фібринолітика) або наявності гемодинамічної/електричної нестабільності, погіршення ішемії чи постійного болю у грудях (клас рекомендації І, рівень доказовості А) (Armstrong et al., 2013; Gershlick et al., 2005).
Крім того, у пацієнтів із підозрою на STEMI та часом від появи симптомів >12 год варто виконати первинне ЧКВ за наявності стійких симптомів, що вказують на ішемію, гемодинамічну нестабільність або небезпечні для життя аритмії (клас рекомендації І, рівень доказовості С) (Gierlotka et al., 2011). Рутинне ЧКВ на оклюзованій інфаркт-пов’язаній артерії (ІПА) не рекомендоване особам зі STEMI, якщо пройшло >48 год після виникнення симптомів та якщо стан пацієнтів є нестійким (клас рекомендації ІІІ, рівень доказовості А) (Menon et al., 2009).
Втручання після фібринолізу
Усіх пацієнтів після фібринолізу необхідно перевести до спеціалізованого центру з можливістю проведення ЧКВ (клас рекомендації І, рівень доказовості А) (Bohmer et al., 2010; Cantor et al., 2009).
Невідкладна ангіографія та ЧКВ на ІПА рекомендовані особам з уперше виниклою або стійкою серцевою недостатністю (СН) / КШ після фібринолізу за наявності показань (клас рекомендації І, рівень доказовості А) (Hochman et al., 2001).
За наявності показань ангіографію та ЧКВ на ІПА слід виконувати через 2‑24 год після успішного фібринолізу (клас рекомендації І, рівень доказовості А) (Madan et al., 2015; Fernandez-Aviles et al., 2004).
Інвазивні стратегії в осіб із NSTE-ACS
Інвазивні стратегії при госпіталізації рекомендовані пацієнтам із ГКС без елевації сегмента ST (NSTE-ACS) і критеріями високого ризику або високим індексом підозри на нестабільну стенокардію (клас рекомендації І, рівень доказовості А).
Селективний інвазивний підхід доцільний у хворих без ознак високого або дуже високого ризику та з низьким індексом підозри на NSTE-ACS (клас рекомендації І, рівень доказовості А) (Knuuti et al., 2020; Bouisset et al., 2021).
Негайні інвазивні процедури слід виконувати в осіб зі встановленим діагнозом NSTE-ACS та принаймні з одним із таких критеріїв дуже високого ризику:
- гемодинамічна нестабільність або КШ;
- повторюваний або рефрактерний біль у грудях, попри медикаментозне лікування;
- внутрішньолікарняні аритмії, що загрожують життю;
- механічні ускладнення ІМ;
- гостра СН, ймовірно, вторинна до ішемії міокарда, що триває;
- рецидивні динамічні зміни сегмента ST або зубця Т, зокрема періодична елевація сегмента ST (клас рекомендації І, рівень доказовості С).
Антитромботична терапія при ГКС
Антитромботична терапія є важливим компонентом лікування всіх пацієнтів із ГКС. Вибір терапії, час її початку і тривалість залежать від індивідуальних особливостей пацієнтів і процедурних чинників. Рішення про лікування слід приймати, зважаючи на переваги антитромботичної терапії та ризику кровотеч, зокрема тяжких, що загрожують життю (Vranckx et al., 2016; Ndrepepa et al., 2008). У таблиці 3 узагальнено рекомендації щодо застосування антиагрегантів та антикоагулянтів у відповідних дозуваннях під час та після ГКС.
|
Таблиця 3. Режим дозування препаратів, застосовуваних у межах антитромботичної терапії в пацієнтів із ГКС |
|
|
Антитромботична терапія |
|
|
Ацетилсаліцилова кислота |
Початкова НД – 150-300 мг перорально або 75-250 мг в/в, якщо пероральний спосіб неможливий, далі ПД – 75-100 мг/добу; у пацієнтів із ХХН немає потреби в спеціальному коригуванні дози |
|
Інгібітори P2Y12-рецепторів (перорально або в/в) |
|
|
Клопідогрель |
НД – 300-600 мг перорально, потім ПД – 75 мг/добу; у пацієнтів із ХХН немає потреби в спеціальному коригуванні дози Під час фібринолізу початкова доза становить 300 мг (75 мг для пацієнтів віком >75 років) |
|
Прасугрел |
НД – 60 мг перорально, потім ПД – 10 мг мг/добу. Для пацієнтів із масою тіла <60 кг ПД становить 5 мг/добу. У хворих віком ≥75 років препарат слід застосовувати з обережністю, але ПД 5 мг/добу є доцільною, якщо лікування вважають необхідним. В осіб із ХХН немає потреби в спеціальному коригуванні дози Перенесений інсульт є протипоказанням |
|
Тикагрелор |
НД – 180 мг перорально, потім ПД – 90 мг двічі на добу; у пацієнтів із ХХН немає потреби в спеціальному коригуванні дози |
|
Кангрелор |
Болюс – 30 мкг/кг в/в із подальшою інфузією 4 мкг/кг/хв упродовж щонайменше 2 год або під час процедури (залежно від того, що довше) У разі переходу з кангрелору на тієнопіридин останній слід вводити у НД (клопідогрель – 600 мг, прасугрел – 60 мг) відразу після відміни кангрелору; щоб уникнути потенційної медикаментозної взаємодії, прасугрел також можна вводити за 30 хв до припинення інфузії кангрелору. Тикагрелор (НД – 180 мг) слід використовувати під час ЧКВ, аби мінімізувати потенційний розрив в інгібуванні тромбоцитів під час перехідної фази |
|
Інгібітори глікопротеїнових рецепторів (IIb/IIIa) |
|
|
Ептифібатид |
Подвійний болюс – 180 мкг/кг в/в (з інтервалом 10 хв) із подальшою інфузією 2,0 мкг/кг/хв до 18 год У разі КК 30-50 мл/хв: перша НД – 180 мкг/кг в/в болюсно (максимальна – 22,6 мг); інфузія ПД – 1 мкг/кг/хв (максимальна – 7,5 мг/год). Друга НД (при ЧКВ) – 180 мкг/кг в/в болюсно (максимальна – 22,6 мг) через 10 хв після першого болюсу Протипоказано пацієнтам із термінальною стадією ниркової недостатності та перенесеним внутрішньомозковим крововиливом, ішемічним інсультом протягом 30 днів, фібринолізом або кількістю тромбоцитів <100 000/мм3 |
|
Тирофібан |
Болюс – 25 мкг/кг в/в упродовж 3 хв із подальшою інфузією 0,15 мкг/кг/хв до 18 год Якщо КК ≤60 мл/хв: НД – 25 мкг/кг в/в упродовж 5 хв; інфузія ПД – 0,075 мкг/кг/хв упродовж 18 год Протипоказано пацієнтам із перенесеним внутрішньомозковим крововиливом, ішемічним інсультом протягом 30 днів, фібринолізом або кількістю тромбоцитів <100 000/мм3 |
|
Антикоагулянтна терапія |
|
|
Нефракціонований гепарин |
Початкове лікування: в/в болюсно по 70-100 ОД/кг із подальшою в/в інфузією з титруванням дози до досягнення АЧТЧ 60-80 с Під час ЧКВ: 70-100 ОД/кг в/в болюсно або відповідно до АЧЗК у разі попереднього лікування НФГ |
|
Еноксапарин
|
Початкове лікування: 1 мг/кг двічі на добу п/ш протягом принаймні 2 днів і продовжувати до клінічної стабілізації. Якщо КК ˂30 мл/хв, дозу слід зменшити до 1 мг/кг/добу Під час ЧКВ: якщо останню дозу препарату було введено <8 год до роздування балона, для пацієнтів, яким виконували ЧКВ, додаткове дозування не потрібне. Якщо востаннє його застосовували п/ш >8 год до роздування балона, слід ввести 0,3 мг/кг еноксапарину натрію в/в болюсно |
|
Бівалірудин |
Під час первинного ЧКВ: 0,75 мг/кг в/в болюсно з подальшою в/в інфузією у дозі 1,75 мг/кг/год протягом 4 год після процедури У пацієнтів із КК <30 мл/хв підтримувальну інфузію слід зменшити до 1 мг/кг/год |
|
Фондапаринукс |
Початкове лікування: 2,5 мг/добу п/ш Під час ЧКВ: одноразовий болюс НФГ Уникайте призначення препарату, якщо КК <20 мл/хв |
|
Примітки: НД – навантажувальна доза, ПД – підтримувальна доза, ХХН – хронічна хвороба нирок, в/в – внутрішньовенно, в/в – внутрішньовенно, п/ш – підшкірно, КК – кліренс креатиніну, АЧТЧ – активований частковий тромбопластиновий час, АЧЗК – активований час згортання крові. |
|
Застосування антиагрегантів
Антиагреганти відіграють ключову роль у гострій фазі лікування ГКС. Під час вибору антитромбоцитарної терапії важливо враховувати ризик кровотечі в пацієнта (Urban et al., 2019). Ацетилсаліцилову кислоту (АСК) перорально у початковій навантажувальній дозі 150‑300 мг або 75‑250 мг внутрішньовенно (в/в) та підтримувальній дозі 75‑100 мг/добу як засіб тривалого лікування рекомендовано всім пацієнтам із ГКС без протипоказань (клас рекомендації І, рівень доказовості А).
Також за наявними даними, подвійна антитромбоцитарна терапія (ПАТТ), що передбачає застосування АСК та прасугрелу або тикагрелору, є оптимальною стратегією для осіб із ГКС (Wallentin et al., 2009). Тож усім хворим слід на додаток до АСК призначати інгібітор P2Y12-рецепторів у початковій навантажувальній дозі перорально з подальшим переходом на підтримувальну дозу протягом 12 міс., якщо немає високого ризику кровотечі (клас рекомендації І, рівень доказовості А).
Пацієнтам, які раніше не отримували інгібітор P2Y12-рецепторів та є кандидатами для ЧКВ, рекомендовано прасугрел у навантажувальній дозі 60 мг і підтримувальній – 10 мг/добу або для пацієнтів віком ≥75 років чи з масою тіла <60 кг – 5 мг/добу (клас рекомендації І, рівень доказовості В).
Тикагрелор застосовують незалежно від стратегії лікування (інвазивного чи консервативного) у навантажувальній дозі 180 мг і підтримувальній – 90 мг двічі на добу (клас рекомендації І, рівень доказовості В). Лікування клопідогрелем перорально в навантажувальній дозі 300‑600 мг та підтримувальній – 75 мг/добу є доцільним, якщо прасугрел або тикагрелор недоступні, не переносяться або протипоказані (клас рекомендації І, рівень доказовості С) (Aradi et al., 2015; Gimbel et al., 2020).
Для осіб із ГКС, які перенесли ЧКВ, слід розглянути застосування прасугрелу, на відміну від тикагрелору, у межах ПАТТ. За доступними даними, стратегія ПАТТ із прасугрелем порівняно з тикагрелором значно знижувала частоту загальної кінцевої точки (смерть, ІМ чи інсульт без збільшення кількості кровотеч) (Schupke et al., 2019).
Інгібітор протонної помпи в поєднанні з ПАТТ доцільно застосовувати особам із ГКС та високим ризиком шлунково-кишкової кровотечі (клас рекомендації І, рівень доказовості А). Якщо пацієнти з ГКС припиняють отримувати ПАТТ перед виконанням аортокоронарного шунтування (АКШ), рекомендовано відновити ПАТТ після операції щонайменше на період протягом 12 місяців (клас рекомендації І, рівень доказовості С).
У пацієнтів із підозрою на STEMI, які є кандидатами для первинного ЧКВ, можна розглянути попереднє лікування інгібітором P2Y12-рецепторів. Своєю чергою, у хворих на NSTE-ACS, у яких анатомія КА невідома та заплановане раннє інвазивне втручання (<24 год), не рекомендована рутинна попередня терапія інгібітором P2Y12-рецепторів (клас рекомендації ІІІ, рівень доказовості А) (Montalescot et al., 2014).
Наразі бракує переконливих доказів додаткової користі внаслідок рутинного застосування інгібіторів глікопротеїнових рецепторів (IIb/IIIa) в осіб із ГКС, яким призначено коронарографію (клас рекомендації ІІІ, рівень доказовості А). Проте їх застосування можна розглянути під час надання екстреної допомоги, якщо немає рефлюксу або тромботичних ускладнень під час ЧКВ. Іншою потенційною причиною призначення цих препаратів є ЧКВ високого ризику в пацієнтів, які раніше не отримували інгібітори P2Y12-рецепторів (Neumann et al., 2019).
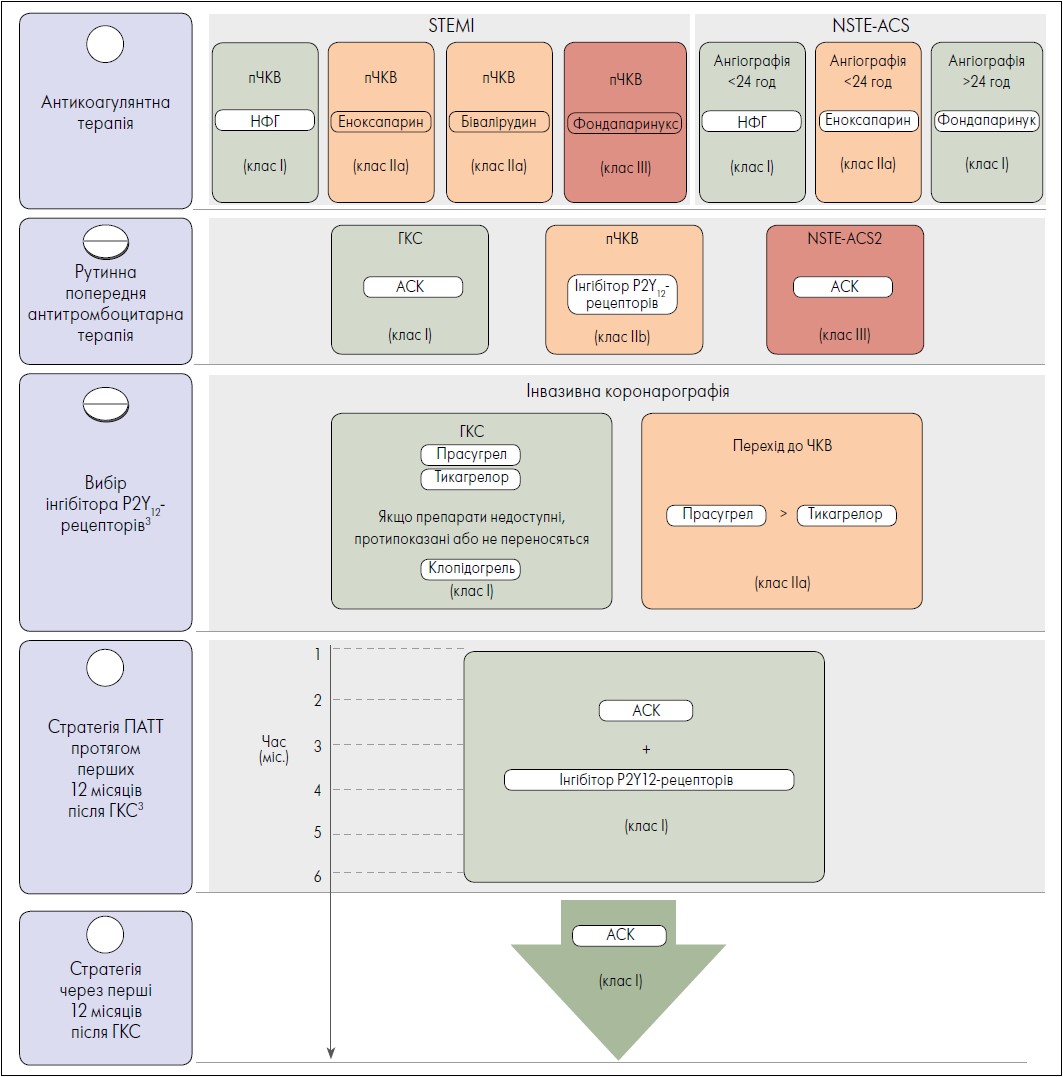
Антитромбоцитарне лікування є обов’язковим для пацієнтів із ГКС після реваскуляризації на відміну від антикоагулянтної терапії, що не є критичною для переважної більшості хворих (у яких немає показання для довгострокового застосування пероральних антикоагулянтів). Рекомендації з антитромботичної терапії в осіб із ГКС без показань до застосування пероральних антикоагулянтів подано на рисунку 1.
Рис. 1. Схеми антитромботичної терапії у пацієнтів із ГКС без показань до застосування пероральних антикоагулянтів
Примітки:1 Рекомендовано віддавати перевагу фондапарину (плюс один болюс НФГ під час ЧКВ) перед еноксапарином і осіб із NSTE-ACS за фармакотерапії або наявності обмежень для переведення пацієнта на ЧКВ протягом 24 год після появи симптомів.2 Не рекомендовано попереднє рутинне лікування інгібітором P2Y12-рецепторів у хворих на NSTE-ACS із невідомою анатомією КА та запланованим раннім інвазивним втручанням (<24 год); однак таку терапію можна розглянути для пацієнтів із NSTE-ACS без запланованого раннього інвазивного втручання (<24 год) та високого ризику кровотеч.3 Клопідогрель рекомендовано приймати впродовж 12 міс. ПАТТ, якщо прасугрел і тикагрелор недоступні, не переносяться або протипоказані, і можна розглянути для призначення пацієнтам старечого віку з ГКС (зазвичай >70‑80 років).
Призначення антикоагулянтів
Антикоагулянтна терапія є стратегією початкового лікування ГКС перипроцедурного ведення пацієнтів, у яких застосовують інвазивні втручання. Парентеральна антикоагулянтна терапія рекомендована всім пацієнтам із ГКС, щойно встановлено діагноз (клас рекомендації І, рівень доказовості А) (Eikelboom et al., 2000).
У хворих, які перенесли ЧКВ, слід використовувати рутинне болюсне введення нефракціонованого гепарину (НФГ) в/в у дозуванні 70‑100 МО/кг під час ЧКВ із поправкою на вагу (клас рекомендації І, рівень доказовості С).
Проте загалом у разі ГКС необхідно уникати перехресного застосування антикоагулянтів (особливо НФГ і низькомолекулярного гепарину), за винятком додавання НФГ до фондапаринуксу в пацієнтів із NSTE-ACS, які є кандидатами для проведення ЧКВ після періоду лікування фондапаринуксом (Ferguson et al., 2004; Cohen et al., 2006).
Доцільно наголосити, що антикоагулянтну терапію зазвичай припиняють відразу після ЧКВ, за винятком особливих клінічних ситуацій, як-от підтверджена наявність аневризми лівого шлуночка (ЛШ) з утворенням тромбу або фібриляція передсердь (ФП), що потребує призначення антикоагулянтів.
Фондапаринукс не варто призначати особам зі STEMI, які перенесли первинне ЧКВ (клас рекомендації ІІІ, рівень доказовості В). Пацієнтам із NSTE-ACS, у яких не заплановано ранню інвазивну ангіографію (протягом 24 год), фондапаринукс не рекомендований (клас рекомендації І, рівень доказовості В).
Тривалу пероральну антикоагулянтну терапію, рекомендовану певній категорії хворих, які перенесли ЧКВ, слід продовжувати під час інвазивних процедур. Переривання довгострокового застосування пероральних антикоагулянтів і перехід на парентеральні може призвести до збільшення кількості тромбоемболічних епізодів і кровотеч (Lip et al., 2014; Ruiz-Nodar et al., 2008).
Поєднання антиагрегантів і пероральних антикоагулянтів
Для пацієнтів із ФП та балом за шкалою оцінювання ризику інсульту й системної тромбоемболії при ФП (CHA2DS2-VASc) ≥1 у чоловіків та ≥2 у жінок для профілактики інсульту доцільною стратегією є ПАТТ із застосуванням перорального антикоагулянту, що не є антагоністом вітаміну К (ПОАК), у рекомендованій дозі та перорального антиагреганту (бажано клопідогреля) протягом 12 міс. через тиждень потрійної антитромботичної терапії після ГКС (клас рекомендації І, рівень доказовості А) (Lopes et al., 2019; Gargiulo et al., 2019).
Під час ЧКВ слід болюсно вводити НФГ за будь-якої з наступних обставин:
- якщо хворі отримують ПОАК;
- якщо в пацієнтів, які приймають антагоністи вітаміну К, міжнародне нормалізоване відношення становить <2,5 (клас рекомендації І, рівень доказовості С) (Beyer-Westendorf et al., 2014).
Застосування тикагрелору або прасугрелу як частини потрійної антитромботичної терапії не рекомендоване (клас рекомендації ІІІ, рівень доказовості С).
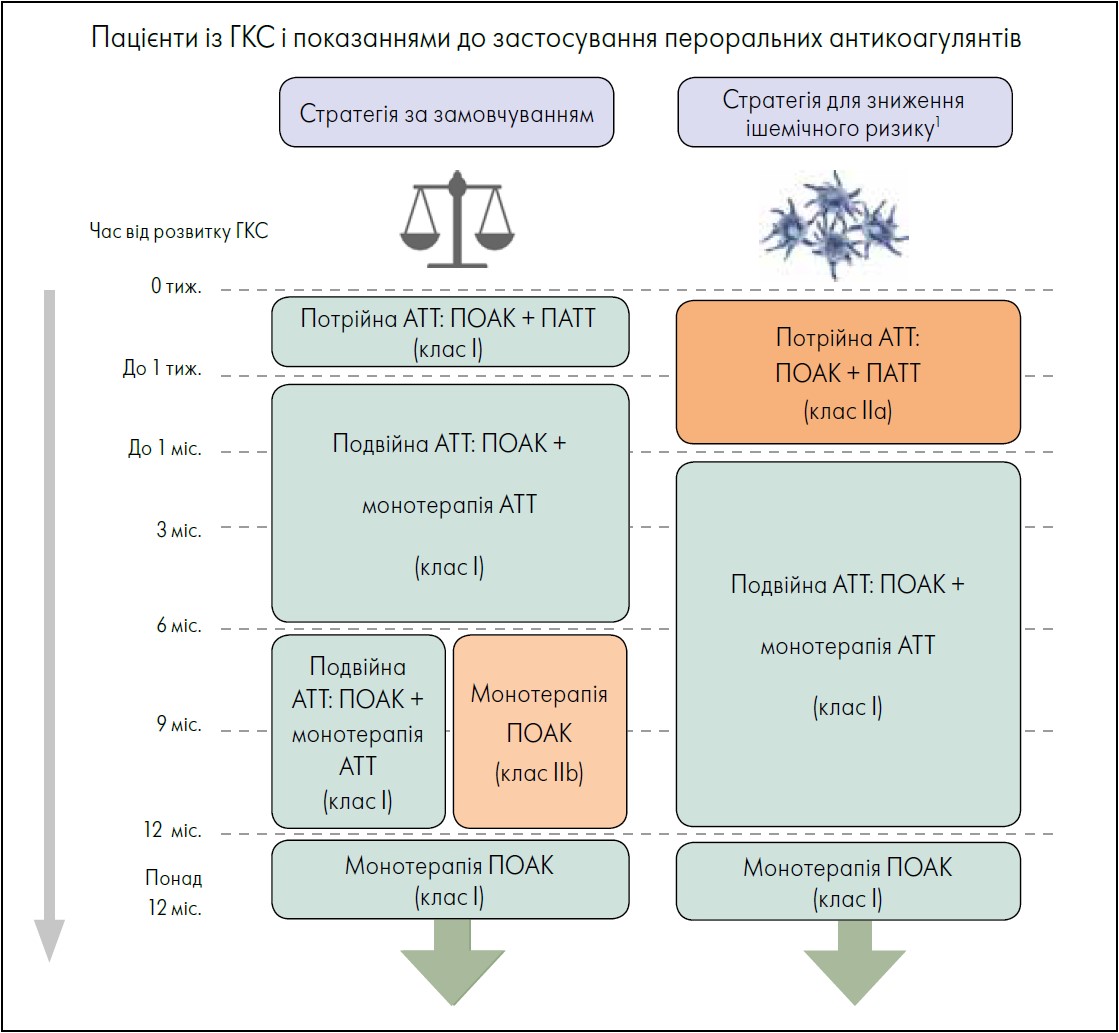
Рекомендації з антитромботичної терапії у пацієнтів із ГКС і показаннями до застосування пероральних антикоагулянтів наведено на рисунку 2.
Рис. 2. Схеми антитромботичної терапії у пацієнтів із ГКС і показаннями до застосування пероральних антикоагулянтів
Примітки: АТТ – антитромбоцитарна терапія. За антикоагулянтної терапії віддавати перевагу ПОАК перед антагоністами вітаміну К у межах стратегії за замовчуванням та в разі інших клінічних сценаріїв, якщо немає протипоказань. Для схем потрійної та подвійної АТТ рекомендовані дозування ПОАК: 5 мг апіксабану двічі на добу, 110 або 150 мг дабігатрану двічі на добу, 60 мг/добу едоксабану, 15 або 20 мг/добу ривароксабану. Зменшення доз ПОАК рекомендоване на основі певних клінічних критеріїв та особливостей хворих (як-от супутнє лікування, функція нирок, маса тіла, вік та ін.). За монотерапії віддавати перевагу інгібітору P2Y12-рецепторів (зазвичай клопідогрелю) перед АСК.
Альтернативні схеми антитромботичної терапії
У пацієнтів із ГКС, які отримують пероральний антикоагулянт, рекомендовано припинити застосування антиагрегантів через 12 місяців (клас рекомендації І, рівень доказовості В).
Деескалація антитромбоцитарної терапії у перші 30 днів після ГКС не є доцільною (клас рекомендації ІІІ, рівень доказовості В).
Лікування фібринолітиками
Якщо фібриноліз є оптимальною стратегією реперфузії, слід розпочати його на догоспітальному етапі якомога швидше після встановлення діагнозу (цільовий час до літичної терапії становить <10 хв) (клас рекомендації І, рівень доказовості А) (Bonnefoy et al., 2009).
За фібринолізу варто віддавати перевагу фібрин-специфічним засобам, як-от тенектеплаза, альтеплаза або ретеплаза (клас рекомендації І, рівень доказовості В) (ASSENT‑2 Investigators, 1999).
У разі, якщо разом із фібринолітичною терапією пацієнту необхідне застосування антиагрегантів, рекомендовано призначати АСК і клопідогрель (клас рекомендації І, рівень доказовості А) (Sabatine et al., 2005).
Своєю чергою, антикоагулянти призначають хворим, які перебувають на фібринолізі, до реваскуляризації (якщо її показано) або під час перебування у стаціонарі (до 8 днів) (клас рекомендації І, рівень доказовості А) (Wallentin et al., 2003; Giraldez et al., 2008).
Еноксапарин в/в із подальшим введенням підшкірно є антикоагулянтом вибору (клас рекомендації І, рівень доказовості А). Якщо еноксапарин недоступний, доцільно використовувати НФГ в/в болюсно з поправкою на вагу з наступною інфузією (клас рекомендації І, рівень доказовості В) (Antman et al., 2002).
Ведення хворих на ГКС із нестабільним станом
Зупинка серця
Більшість випадків зупинки серця у дорослих пацієнтів пов’язана з обструктивною ішемічною хворобою серця, своєю чергою, ГКС може бути диференційним діагнозом (Byrne et al., 2008).
ГКС є найпоширенішою причиною позагоспітальної зупинки серця (Patterson et al., 2018; Kroupa et al., 2017).
Первинну ЧКВ рекомендовано виконувати особам із реанімованою зупинкою серця та стійким підйомом сегмента ST (або еквівалентами) за даними ЕКГ (клас рекомендації І, рівень доказовості В) (Garot et al., 2007).
Контроль температури (тобто безперервний моніторинг внутрішньої температури та активну профілактику лихоманки) слід здійснювати після позагоспітальної або госпітальної зупинки серця у дорослих хворих, які не відповідають на лікування після відновлення спонтанного кровообігу (клас рекомендації І, рівень доказовості В) (Dankiewicz et al., 2021).
Не варто виконувати рутинну невідкладну ангіографію після реанімаційної зупинки серця у гемодинамічно стабільних пацієнтів без стійкого підйому сегмента ST (або його еквівалентів) (клас рекомендації ІІІ, рівень доказовості А) (Desch et al., 2021; Hauw-Berlemont et al., 2022).
Оцінювання неврологічного прогнозу (не раніше ніж через 72 год після госпіталізації) необхідно виконувати в усіх пацієнтів, які перебувають у комі після зупинки серця.
Кардіогенний шок
Ранню реваскуляризацію за допомогою ЧКВ або АКШ виконують в осіб із гострим ІМ, ускладненим КШ (Hochman et al., 2006). Так, пацієнтам із КШ як негативним проявом ГКС рекомендовано якнайшвидше здійснити коронарографію та ЧКВ на ІПА (за наявності показань) (клас рекомендації І, рівень доказовості В) (Thiele et al., 2017). Невідкладне АКШ є доцільним, якщо ЧКВ на ІПА неможливе / неуспішне (клас рекомендації І, рівень доказовості В).
У разі гемодинамічної нестабільності слід призначити екстрене хірургічне / катетерне лікування механічних ускладнень ГКС на підставі обговорення кардіологічною командою (клас рекомендації І, рівень доказовості С) (White et al., 2005).
Рутинне використання внутрішньоаортального балонного насоса в осіб із ГКС із КШ та без механічних ускладнень не рекомендовано (клас рекомендації ІІІ, рівень доказовості В) (Unverzagt et al., 2015).
Лікування пацієнтів із багатосудинним ураженням КА
Близько половини пацієнтів із ГКС мають багатосудинне ураження КА (Secemsky et al., 2021). Лікування ушкодження, не пов’язаного з ІПА, залежить від клінічної ситуації. Стратегія реваскуляризації, як-от ЧКВ на ІПА, ЧКВ/АКШ за багатосудинного ураження КА, має ґрунтуватися на клінічному статусі пацієнта та супутніх захворюваннях, а також складності патології (клас рекомендації І, рівень доказовості В) (Sabatine et al., 2021; Head et al., 2018).
В осіб із ГКС та КШ, які мають багатосудинне ушкодження КА, процедура індексації передбачає виконання ЧКВ лише на IПA (клас рекомендації І, рівень доказовості В) (Thiele et al., 2018).
За багатосудинного ураження у гемодинамічно стабільних пацієнтів зі STEMI, які перенесли первинне ЧКВ, рекомендовано виконувати повну реваскуляризацію під час процедури індексного ЧКВ або протягом 45 днів (клас рекомендації І, рівень доказовості А) (Smits et al., 2017; Mehta et al., 2019). ЧКВ не на ІПА має базуватися на тяжкості стану за даними ангіографії (клас рекомендації І, рівень доказовості В) (Puymirat et al., 2021).
Менеджмент осіб з ІМ без обструктивного ураження КА
ІМ без обструктивного ураження КА (MINOCA) спостерігають у пацієнтів із симптомами ГКС, підвищенням рівня тропоніну та наявністю необструктивних КА за даними коронарографії (Pasupathy et al., 2015). MINOCA охоплює різнорідну групу основних причин (як коронарну, так і некоронарну патологію), причому останні передбачають кардіальні та екстракардіальні порушення (Matta et al., 2022; Pargaonkar et al., 2021).
Пацієнтам із попереднім діагнозом MINOCA рекомендовано провести магнітно-резонансну томографію серця після інвазивної ангіографії, якщо остаточний діагноз неясний (клас рекомендації І, рівень доказовості В) (Reynolds et al., 2021).
Варто зауважити, що під час ведення хворих із підозрою на MINOCA важливо дотримуватися діагностичного алгоритму для визначення основного остаточного діагнозу (клас рекомендації І, рівень доказовості С).
Лікування MINOCA слід призначати відповідно до остаточно встановленого основного діагнозу на основі рекомендацій щодо конкретного захворювання (клас рекомендації І, рівень доказовості В) (Cerrato et al., 2021).
Терапія пацієнтів із пов’язаними з ГКС ускладненнями
Фібриляція передсердь
ФП є найчастішою надшлуночковою аритмією у пацієнтів із ГКС. Хворі на ГКС і ФП мають більше супутніх захворювань порівняно з такими без ФП і вищий ризик ускладнень (Reynolds et al., 2021).
Застосування β-блокаторів в/в рекомендоване пацієнтам із ГКС, які потребують контролю частоти серцевих скорочень (ЧСС) без гострої СН або артеріальної гіпотензії (клас рекомендації І, рівень доказовості С) (Segal et al., 2000).
Своєю чергою, введення аміодарону в/в є доцільним за потреби моніторингу ЧСС, наявності гострої СН і відсутності гіпотонії у таких хворих (клас рекомендації І, рівень доказовості С) (Hou et al., 1995).
Невідкладну електричну кардіоверсію виконують в осіб із ГКС і гемодинамічною нестабільністю, а також у випадках, коли неможливо швидко досягти адекватного контролю ЧСС за допомогою фармакологічних засобів (клас рекомендації І, рівень доказовості С).
Застосування аміодарону в/в рекомендовано для полегшення електричної кардіоверсії та/або зниження ризику раннього рецидиву ФП після процедури в нестабільних пацієнтів із нещодавно виниклою ФП (клас рекомендації І, рівень доказовості С) (Hofmann et al., 2004).
Шлуночкові аритмії
Із поширенням екстреної реперфузійної терапії у пацієнтів зі STEMI частота злоякісних аритмій значно знизилася. Проте у 6‑8% хворих розвивається гемодинамічно значуща вентрикулярна тахікардія та/або фібриляція шлуночків (Piccini et al., 2011). Особам із поліморфною вентрикулярною тахікардією та/або фібриляцією шлуночків варто призначати β-блокатори в/в та/або аміодарон, якщо немає протипоказань (клас рекомендації І, рівень доказовості В) (Miwa et al., 2010; Nademanee et al., 2000).
Швидка та повна реваскуляризація є доцільною для лікування ішемії міокарда, яка може виникати у пацієнтів із рецидивною вентрикулярною тахікардією та/або фібриляцією шлуночків (клас рекомендації І, рівень доказовості С) (Dumas et al., 2010; Spaulding et al., 1997).
Використання імплантованого кардіовертера-дефібрилятора (ІКД) рекомендовано для зниження частоти раптової серцевої смерті в пацієнтів із симптоматичною СН (клас II‑III за критеріями Нью-Йоркської асоціації серця [NYHA]) і фракцією викиду (ФВ) ЛШ ≤35%, попри оптимальну фармакотерапію протягом >3 міс. і щонайменше 6 тиж. після ІМ, з очікуваною виживаністю ≥1 рік і нормальним функціональним станом (клас рекомендації І, рівень доказовості А) (Priori et al., 2015; Bardy et al., 2005).
Брадиаритмії
За синусової брадикардії з порушенням гемодинаміки або атріовентрикулярною (АВ) блокадою високого ступеня без стабільного замісного ритму в пацієнтів із ГКС рекомендовано:
- Застосувати в/в препарати з хронотропним ефектом (як-от адреналін, вазопресин і/або атропін).
- За браком реакції на атропін слід виконувати тимчасову кардіостимуляцію.
- Невідкладну ангіографію для подальшої реваскуляризації, якщо пацієнт раніше не отримував реперфузійної терапії (клас рекомендації І, рівень доказовості С).
Імплантацію постійного кардіостимулятора виконують, якщо АВ-блокада високого ступеня не зникає впродовж щонайменше 5 днів після ІМ (клас рекомендації І, рівень доказовості С).
Електростимуляцію не рекомендовано, якщо АВ-блокада високого ступеня зникає після реваскуляризації або спонтанно (клас рекомендації ІІІ, рівень доказовості В) (Glikson et al., 2021; Gang et al., 2012).
За безсимптомних і гемодинамічно незначущих шлуночкових аритмій не варто призначати антиаритмічні препарати (клас рекомендації ІІІ, рівень доказовості С).
Лікування пацієнтів із ГКС, коморбідними станами та за різних клінічних умов
Хронічна хвороба нирок
Хронічна хвороба нирок (ХХН) від помірно-тяжкої до тяжкої наявна в понад 30% пацієнтів із ГКС (Szummer et al., 2010). Пацієнти з ГКС і супутньою ХХН отримують менше інтервенційного / фармакологічного лікування та мають гірший прогноз, ніж із нормальною функцією нирок (Panchal et al., 2021).
Тип і дозування антитромботичного засобу, а також кількість контрастної речовини слід вибирати відповідно до функції нирок (Kume et al., 2013).
Гідратацію в/в доцільно розглядати як частину ведення хворих на ГКС із низькою розрахунковою швидкістю клубочкової фільтрації (рШКФ), які отримують інвазивне лікування, для мінімізації ризику контраст-індукованої нефропатії, з урахуванням їхніх індивідуальних особливостей і клінічних обставин (Davenport et al., 2020; Schweiger et al., 2007).
У всіх пацієнтів із ГКС слід оцінювати функцію нирок за допомогою рШКФ (клас рекомендації І, рівень доказовості С).
В осіб із ГКС та підтвердженою ХХН рекомендовано застосовувати ті самі діагностичні й терапевтичні стратегії (може знадобитися коригування дози), що й у хворих із нормальною функцією нирок (клас рекомендації І, рівень доказовості С).
Цукровий діабет
Пацієнти із ГКС і цукровим діабетом (ЦД) частіше мають неспецифічні симптоми, що може призвести до затримки діагностики й терапії (Angerud et al., 2013; Fu et al., 2019). Як лікування у гострій фазі, так і контроль чинників ризику після ГКС є гіршими в осіб із ЦД, у таких хворих зазвичай виявляють більш пізню стадію ішемічної хвороби серця на момент встановлення діагнозу. Ці чинники, ймовірно, зумовлюють гірший довгостроковий прогноз, пов’язаний із ГКС на тлі ЦД, особливо якщо хворі потребують застосування інсуліну (Wallert et al., 2019; Ritsinger et al., 2019).
Вибір тривалої цукрознижувальної терапії має ґрунтуватися на наявних супутніх захворюваннях, зокрема СН, ХХН та ожиріння (клас рекомендації І, рівень доказовості А) (Zelniker et al., 2019).В усіх пацієнтів із ГКС під час первинного обстеження слід оцінювати глікемічний статус (клас рекомендації І, рівень доказовості В) (Ferrannini et al., 2020; Shahim et al., 2017).В осіб із підтвердженим ЦД або гіперглікемією рекомендований регулярний контроль рівня глюкози у крові (визначається як вміст глюкози ≥11,1 ммоль/л, або ≥200 мг/дл) (клас рекомендації І, рівень доказовості С).
Онкозахворювання
Серед найпоширеніших типів онкологічних хвороб у пацієнтів із ГКС – рак простати, молочної залози, товстої кишки та легень. Осіб із ГКС і раком в анамнезі слід лікувати так само, як і інших хворих на ГКС. Проте ведення пацієнтів із ГКС та активним онкозахворюванням пов’язане зі специфічними проблемами, які необхідно брати до уваги (Bharadwaj et al., 2020).
Онкологічним хворим на ГКС групи високого ризику з очікуваною тривалістю життя ≥6 міс. рекомендовано застосовувати інвазивну стратегію (клас рекомендації І, рівень доказовості В) (Mohamed et al., 2021; Guddati et al., 2016).
Тимчасове припинення онкотерапії є доцільним для пацієнтів, у яких лікування раку є ймовірною причиною ГКС (клас рекомендації І, рівень доказовості С) (Herrmann et al., 2020).
АСК не рекомендована хворим на ГКС і рак із кількістю тромбоцитів <10 000/мкл, клопідогрель – за <30 000/мкл, прасугрел або тикагрелор – у разі <50 000/мкл (клас рекомендації ІІІ, рівень доказовості С) (Long et al., 2020).
Пацієнти похилого віку
Частка осіб похилого віку серед пацієнтів із ГКС продовжує зростати. Літній вік асоційований зі слабкістю, мультиморбідністю та вищим ризиком як ішемії, так і кровотеч при ГКС (Lopes et al., 2013).
Під час ведення літніх хворих рекомендовано застосовувати такі самі діагностичні та лікувальні стратегії, як для пацієнтів молодшого віку (клас рекомендації І, рівень доказовості В) (Tegn et al., 2016; Bach et al., 2019).
Важливо адаптувати вибір і дозування антитромботичних засобів, а також препаратів для вторинної профілактики до функції нирок, супутнього лікування, коморбідних захворювань, когнітивних функцій, протипоказань та ін. (клас рекомендації І, рівень доказовості В) (Roe et al., 2012).
В ослаблених пацієнтів похилого віку із супутніми захворюваннями доцільно використовувати комплексний підхід для індивідуалізації інтервенційного та фармакологічного лікування після ретельного оцінювання користі / ризику (клас рекомендації І, рівень доказовості В) (Richter et al., 2022; Gu et al., 2019).
Довгострокова терапія
Вторинна профілактика після ГКС є ключовою для підвищення якості життя хворих і зниження захворюваності та смертності, її слід розпочинати якомога раніше після перенесеного епізоду (Ambrosetti et al., 2020; Abreu et al., 2020).
Усім пацієнтам із ГКС рекомендовано брати участь у структурованій, комплексній, мультидисциплінарній програмі кардіореабілітації та профілактики, що передбачають фізичні навантаження під медичним наглядом (клас рекомендації І, рівень доказовості А) (Dibben et al., 2021; Candelaria et al., 2020).
Хворі на ГКС мають дотримуватися здорового способу життя, зокрема:
- припинити курити тютюн;
- отримувати здорове харчування;
- обмежити споживання алкоголю;
- мати регулярні аеробні фізичні навантаження та вправи на опір;
- уникати малорухомого способу життя (клас рекомендації І, рівень доказовості В) (Becerra-Tomas et al., 2020; Saeidifard et al., 2019).
Ліпідознижувальна терапія
Незалежно від вихідних значень холестерину (ХС) ліпопротеїнів низької щільності (ЛПНЩ) у пацієнтів із ГКС, рекомендовано якомога раніше розпочинати або продовжувати застосування статинів у високих дозах (клас рекомендації І, рівень доказовості А) (Ray et al., 2005).
Важливими є досягнення цільового рівня ХС ЛПНЩ <55 мг/дл (<1,4 ммоль/л) і зниження ХС ЛПНЩ на ≥50% від вихідного значення (клас рекомендації І, рівень доказовості А) (Fulcher et al., 2015).
У разі неможливості досягти цільового рівня ХС ЛПНЩ на тлі лікування статинами через 4‑6 тиж., варто додати езетиміб (клас рекомендації І, рівень доказовості В) (Cannon et al., 2015).
Якщо не вдається досягти цільового ХС ЛПНЩ, попри терапію статинами та езетимібом у максимально переносимих дозах упродовж 4‑6 тиж., слід додати інгібітор пропротеїнової конвертази субтилізин-кексинового типу 9 (PCSK9) (клас рекомендації І, рівень доказовості А) (Schwartz et al., 2018; O’Donoghue et al., 2022). Крім того, рекомендовано інтенсифікувати гіполіпідемічну терапію під час госпіталізації з приводу ГКС у пацієнтів, які раніше отримували препарати цієї групи (клас рекомендації І, рівень доказовості С).
Бета-блокатори
Клінічну користь β-блокаторів після ГКС у пацієнтів зі зниженою ФВ ЛШ підтверджено сучасними даними (Martнnez-Milla et al., 2019; Dahl Aarvik et al., 2019).
Пацієнтам із ГКС та ФВ ЛШ ≤40% необхідно призначати β-блокатори незалежно від симптомів СН (клас рекомендації І, рівень доказовості А).
Інгібітори ренін-ангіотензин-альдостеронової системи
Інгібітори ангіотензинперетворювального ферменту (іАПФ) поліпшують результати в пацієнтів після перенесеного ІМ, що мають супутні захворювання, як-от СН та/або ФВ ЛШ ≤40%, ЦД, ХХН та/або артеріальна гіпертензія (Fox et al., 2003; Yusuf et al., 2000). Тож згідно з рекомендаціями, іАПФ слід призначати особам із ГКС та симптомами зазначених вище клінічних станів (клас рекомендації І, рівень доказовості А) (Knuuti et al., 2020).
Своєю чергою, антагоністи мінералокортикоїдних рецепторів асоційовані зі зниженням смертності та госпіталізації з приводу ССЗ у пацієнтів із нещодавно перенесеним ІМ та дисфункцією ЛШ із симптомами СН або ЦД. Ці препарати доцільно застосовувати хворим на ГКС із ФВ ЛШ ≤40% і СН або ЦД (клас рекомендації І, рівень доказовості А) (Pitt et al., 2003).
Підготувала Олена Коробка
Оригінальний текст документа читайте на сайті www.escardio.org
Тематичний номер «Кардіологія. Ревматологія. Кардіохірургія» № 6 (91) 2023 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....