Раціональний вибір НПЗП при больовому синдромі як важливий компонент алгоритму лікування остеоартриту
Відповідно до сучасних уявлень остеоартрит (ОА) розглядають як гетерогенну групу захворювань різної етіології, але зі схожими біологічними, морфологічними та клінічними наслідками, за яких у патологічний процес залучається не тільки суглобовий хрящ, а й усі структури суглоба.
Ключовим симптомом ОА є біль. Він негативно впливає на якість життя, призводить до зниження чи втрати працездатності, пов’язаний зі значними витратами для системи охорони здоров’я, а також значною мірою визначає віддалені результати перебігу патологічного процесу. Больовий синдром при ОА характеризується гетерогенністю та мультимодальністю, оскільки джерелом больових відчуттів можуть бути різні навколосуглобові тканини — субхондральна кістка, оболонка, сухожилля, зв’язки, м’язи, на відміну від суглобового хряща, що не має нервових закінчень.
Наразі запропоновано велику кількість міжнародних і національних рекомендацій з лікування ОА. Найбільший інтерес становлять рекомендації Європейського товариства клінічних та економічних аспектів остеопорозу, остеоартриту та захворювань кістково-м’язової системи (Тhe European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases — ESCEO), запропоновані в 2014 році. Ці рекомендації є першим досвідом створення докладного алгоритму покрокових дій, який дає змогу лікарям різних спеціальностей орієнтуватися в численних методах лікування ОА й обирати адекватну терапію на різних стадіях розвитку цього захворювання. У рекомендаціях ESCEO колінний суглоб фігурує як модель ОА. Згідно з рекомендаціями фармакологічне лікування необхідно модифікувати та поступово нарощувати відповідно до вказаних кроків до досягнення задовільної клінічної відповіді.
Крім загальних принципів ведення хворих на ОА (навчальні програми, зниження надлишкової ваги, програми аеробних вправ), розроблений алгоритм передбачає 4 мультимодальні кроки: (1) базове лікування ОА із застосуванням насамперед симптом-модифікувальних препаратів сповільненої дії (SYSADOA), а також локальних засобів; (2) розширений фармакологічний менеджмент пацієнтів зі стійкою симптоматикою, основою якого є раціональне застосування нестероїдних протизапальних препаратів (НПЗП), а також внутрішньосуглобові маніпуляції; (3) застосування опіоїдів короткої дії та антидепресантів при стійкому больовому синдромі; (4) хірургічне лікування.
Центральну роль у фармакологічному лікуванні при ОА традиційно відводять пероральним НПЗП. Лікування із застосуванням пероральних НПЗП можна проводити на ранній стадії для купірування болю протягом дуже коротких циклів. Фактично пероральні неселективні чи ЦОГ‑2-селективні НПЗП забезпечують істотніше полегшення симптомів, аніж парацетамол, при цьому виразність ефекту щодо болю становить 0,29 (0,22-0,35), що вдвічі більше за відповідний показник парацетамолу.
Водночас і самі пацієнти віддають більшу перевагу застосуванню НПЗП порівняно з парацетамолом. Отже, НПЗП можуть бути корисними у пацієнтів із сильнішим болем, особливо якщо SYSADOA не забезпечили достатнього контролю симптомів на першому кроці. Застосування НПЗП постає другим кроком алгоритму лікування пацієнтів із ОА колінних суглобів — розширений фармакологічний менеджмент у пацієнтів зі стійкою симптоматикою.
Вибір лікарського засобу серед доступних НПЗП продиктовано насамперед профілем безпеки з урахуванням різних факторів ризику, супутніх захворювань пацієнта й медичних умов. Із цих позицій постає питання індивідуальної оцінки ризику розвитку побічних ефектів у пацієнтів, котрим призначають НПЗП, а також вибір препарату з найменшим індексом кардіо-, гастро- та нефротоксичності.
Традиційно вважають, що прийом неселективних НПЗП асоціюється з більшим ризиком шлунково-кишкових ускладнень і розвитком НПЗП-гастропатії, а застосування селективних ЦОГ‑2-інгібіторів — із підвищеним ризиком серцево-судинних подій. Нещодавно отримані дані дають змогу припустити, що коксиби також істотно підвищують ризик розвитку ускладнень у верхньому відділі шлунково-кишкового тракту (ШКТ) порівняно з плацебо, хоч і з нижчою частотою, ніж неселективні НПЗП.
Зв’язок НПЗП із підвищеним серцево-судинним ризиком є складним питанням: окрім прямого впливу на дисбаланс простаноїдів, може існувати й непрямий вплив, пов’язаний із підвищенням артеріального тиску (АТ), застійною серцевою недостатністю та нирковою дисфункцією, що властиво всім НПЗП, і про цей факт лікарям завжди необхідно пам’ятати. Надмірний абсолютний ризик у будь-якому разі є вищим у пацієнтів із високим вихідним ризиком розвитку серйозних кардіоваскулярних подій, які отримують коксиби. У зв’язку з цим рекомендовано відмовитися від застосування коксибів у пацієнтів із високим серцево-судинним ризиком.
Підбір ЦОГ‑2-селективного чи неселективного НПЗП і супутньої протективної терапії (інгібітор протонної помпи — ІПП, ацетилсаліцилова кислота — АСК) відображено в рекомендаціях Європейської мультидисциплінарної групи експертів (2011) щодо зваженого застосування НПЗП при ревматичних захворюваннях. Ці рекомендації передбачають кількісну градацію шлунково-кишкового та серцево-судинного ризиків і, відповідно, виокремлення 6 категорій хворих. Серцево-судинний ризик пропонують кількісно оцінювати за шкалою HeartScore Європейської асоціації кардіологів, а шлунково-кишковий — залежно від кількості супутніх факторів ризику.
Наявні стратегії органопротекції, передусім гастропротекції (додатковий прийом ІПП, мізопростолу, застосування селективних інгібіторів ЦОГ‑2) та кардіопротекції (застосування АСК), цілковито не розв’язують проблему безпеки тривалого застосування НПЗП. Тож триває постійний пошук нових властивостей цих препаратів і створення НПЗП з унікальними органопротективними ефектами.
Одним із новітніх альтернативних підходів з метою підвищення безпеки НПЗП є застосування NO-асоційованих НПЗП. Вони являють собою новий клас сполук, які є похідними від звичайних НПЗП, що були змінені шляхом додавання до них молекули оксиду азоту — NO. Так у класифікації НПЗП з’явився термін CINODs (COX-inhibiting nitric oxide donators), який поєднує хімічні сполуки, що є донаторами NO, зі здатними пригнічувати ЦОГ. Цей новий клас НПЗП забезпечує більшу безпеку щодо розвитку ушкоджень ШКТ, ніж наявні НПЗП. Добре відомо, що молекули NO здатні блокувати чи компенсувати зниження кровотоку, а також блокувати адгезію нейтрофілів до ендотелію судин, тобто небажані шлунково-кишкові ефекти НПЗП. Дослідженнями in vitro та клінічними випробуваннями підтверджено, що використання CINODs відкриває перспективи застосування НПЗП зі значно поліпшеним профілем безпеки.
Амтолметин гуацил (АМГ) є одним із новітніх NO-асоційованих з’єднань. Він синтезований за допомогою комбінованої методики хімічного синтезу в результаті відновлення толметину амінокислотою (гліцином) і гваяколом. АМГ (Найзилат) має відразу декілька механізмів, що забезпечують його виразні гастропротективні властивості, пов’язані насамперед із пригніченням активності інгібіторів індуцибельної NO-синтетази (iNOS), що призводить до істотного підвищення концентрації NO в слизовій оболонці ШКТ. Принциповою відмінністю АМГ від CINODs, що є донорами NO-груп, які вивільнюють NO в системну циркуляцію, є унікальна властивість препарату збільшувати продукцію NO переважно в слизовій оболонці шлунка, тобто локально.
В експериментальних роботах продемонстровано багаторазове наростання активності iNOS у слизовій оболонці лабораторних тварин, які отримували АМГ; ані плацебо, ані толметин такого впливу не чинили. Згідно з результатами експериментальних робіт АМГ гальмує біосинтез простагландинів, проте одночасно здійснює прямий захисний вплив на стінку шлунка за рахунок стимуляції вивільнення шлунково-кишкових пептидів: АМГ стимулює рецептори капсаїцину, підсилює синтез кальцитонін-ген-зв’язаного пептиду, пригнічує перекисне окислення ліпідів, що приводить до зменшення секреції соляної кислоти й прискорення репарації епітеліоцитів. Активація рецепторів капсаїцину відбувається за прямого контакту молекул цієї лікарської речовини зі слизовою оболонкою шлунка, і максимальні прояви цього ефекту спостерігають при прийомі препарату натще.
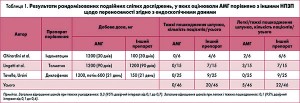
У клінічних дослідженнях продемонстровано, що протизапальний, знеболювальний і жарознижувальний ефекти АМГ зіставні з такими ефектами неселективних НПЗП. Результати систематичного огляду літератури (метааналіз опублікованих і неопублікованих рандомізованих клінічних досліджень при лікуванні ОА, ревматоїдного артриту й патогенетично пов’язаних із ними захворювань) стосовно переносимості АМГ порівняно з іншими НПЗП показали, що частота випадків із небажаними реакціями й раннім припиненням лікування значно нижче у пацієнтів, які приймали АМГ, аніж інші НПЗП.
У таблиці 1 представлено результати порівняльних досліджень щодо гастроінтестинальної переносимості препаратів.
На додаток можна зазначити, що для АМГ продемонстровано гастропротективні властивості щодо шкідливої дії інших НПЗП. Так, порівняно з плацебо на тлі уведення АМГ у лабораторних тварин було виявлено достовірне дозозалежне зменшення інтенсивності ульцерації, спричиненої прийомом індометацину.
Відомо, що кардіоваскулярні катастрофи зумовлені впливом НПЗП на баланс синтезу тромбоксану А2 (ЦОГ‑1-залежний процес) — індуктора адгезії й агрегації тромбоцитів, а також на синтез антитромботичного та вазодилятуючого простацикліну (ЦОГ‑2-залежний процес) у бік тромбоутворення. Дестабілізація АТ пов’язана з впливом НПЗП на простагландинові механізми контролю артеріальної гіпертензії (АГ). Окрім того, є дані, що ризик розвитку ускладнень з боку серцево-судинної системи підвищується в разі використання високих терапевтичних доз НПЗП упродовж тривалого часу. За наявності високого ризику серцево-судинних ускладнень НПЗП слід застосовувати в комбінації з препаратами, які знижують ризик тромбозів (найчастіше з АСК у низьких дозах). Проте сумісне призначення НПЗП із АСК підвищує ризик гастроінтестинальних катастроф, що потребує застосування гастропротективної терапії, найчастіше ІПП. Однак у разі поліморбідності й необхідності застосовувати велику кількість препаратів пацієнти не завжди приймають ІПП або АСК, що, відповідно, збільшує ризик ускладнень терапії НПЗП.
Тож застосування NO-асоційованих НПЗП, що мають доведені гастро- та кардіопротективні ефекти, є перспективним. Серед препаратів із безпечним кардіоваскулярним профілем слід розглянути АМГ.
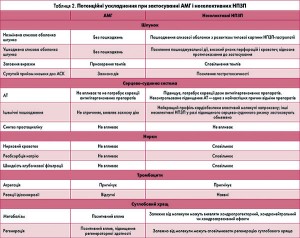
На відміну від ЦОГ‑2-селективних НПЗП, АМГ має антитромбоцитарну активність in vitro та ex vivo, зіставну з дією АСК. Завдяки цьому фармакологічному ефекту АМГ є більш відповідним, аніж селективний інгібітор ЦОГ‑2, для пацієнтів з одним або більше кардіоваскулярним фактором ризику. Тим паче використання АМГ не потребує додаткового прийому АСК. Водночас надзвичайно цікавими є результати відкритого проспективного 12-тижневого дослідження КОРОНА (эффеКтивность и кардиОваскулярная безопасность пРименения амтОлметина гуацила у пациеНтов с хронической болью в нижней части спины и контролируемой Артериальной гипертензией), проведеного з метою оцінювання не лише ефективності, а й кардіоваскулярної безпеки АМГ. Встановлено, що АМГ у максимальній добовій дозі зменшує біль у спині й інші показники активності анкілозивного спондиліту. Зниження максимальної добової дози АМГ до мінімальної підтримувальної асоціюється зі збереженням досягнутого знеболювального й протизапального ефектів у цих пацієнтів. Водночас при застосуванні АМГ упродовж 12 тиж значущих серцево-судинних подій не зареєстровано. Використання АМГ у хворих на анкілозивний спондиліт із підвищеним ризиком серцево-судинних подій (підвищений індекс маси тіла, обтяжена спадковість за АГ та ішемічною хворобою серця, куріння) призводило до підвищення АТ в окремих хворих, що потребувало корекції АГ, але не скасування прийому НПЗП.
У хворих на анкілозивний спондиліт із контрольованою АГ застосування АМГ асоціювалося зі зниженням систолічного АТ. Інші проведені дослідження також відзначили кардіоваскулярну безпеку АМГ та відсутність підвищення АТ порівняно з диклофенаком і рофекоксибом.
Порівняння потенційних небажаних ефектів при застосуванні АМГ і селективних інгібіторів ЦОГ‑2 продемонструвало суттєві переваги NO-асоційованих НПЗП. Так, АМГ має потужний гастропротекторний механізм, що перевищує гастропротекторні ефекти коксибів, а також, на відміну від них, сприяє загоєнню виразкових дефектів. Що стосується нефропротективної дії, то АМГ не впливає на нирковий кровоток і реабсорбцію натрію, а селективні ЦОГ‑2-інгібітори пригнічують ці процеси.
Кардіопротективний ефект АМГ докладно описаний вище й також має суттєві переваги над коксибами. У цьому аспекті слід іще раз підкреслити власний антитромбоцитарний ефект АМГ, що дає змогу застосовувати його без супутнього прийому АСК. У разі призначення АМГ знижується ризик розвитку тромбоемболій. Окрім того, для АМГ не описано реакцій ідіосинкразії, що доволі часто трапляються при використанні неселективних і селективних НПЗП. У таблиці 2 представлено сумарні порівняльні дані щодо потенційних небажаних ефектів АМГ та неселективних НПЗП.
Отже, наявні стратегії органопротекції (насамперед гастропротекції) не розв’язують повністю проблему безпеки тривалого застосування НПЗП. Подвійний унікальний механізм захисту шлунка й добра переносимість АМГ при тривалих курсах терапії, що приводять до зниження витрат на лікування, вирізняють цей препарат зі списку подібних. Добра кардіоваскулярна переносимість препарату розширює межі його використання. З огляду на гастропротекторні властивості АМГ, а також його кардіоваскулярну безпеку, цей препарат слід розглядати як вдалу альтернативу традиційним НПЗП для довготривалого лікування ОА, особливо в пацієнтів із підвищеними гастроінтестинальним і кардіоваскулярним ризиками. Можливу тактику застосування АМГ у цієї когорти пацієнтів представлено в таблиці 3.
АМГ постає ефективним неселективним НПЗП, що позбавлений небажаних реакцій селективних інгібіторів ЦОГ‑2, таких як кардіо- та нефротоксичність, і має кращу гастроінтестинальну переносимість, аніж інші неселективні НПЗП, унаслідок додаткового ефекту у вигляді стимуляції вивільнення ендогенного NO. Тож, зважаючи на гастропротекторні властивості АМГ, а також його кардіоваскулярну, ренальну безпеку й позитивний вплив на метаболізм хряща, препарат слід розглядати як вдалу альтернативу традиційним НПЗП для довготривалого лікування захворювань опорно-рухового апарату, особливо в пацієнтів із супутнім ураженням серцево-судинної системи, нирок і печінки.
Список літератури знаходиться в редакції.
СТАТТІ ЗА ТЕМОЮ Ревматологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Після десятиліть, а часом і запеклих суперечок про переваги та недоліки застосування глюкокортикоїдів (ГК) досягнута певна конвергенція. Сучасні рекомендації лікування таких захворювань, як ревматоїдний артрит (РА), ревматична поліміалгія (РПМ) та васкуліт великих судин відображають поточний стан консенсусу терапії ГК. Однак залишаються відкритими питання щодо можливості тривалого лікування дуже низькими дозами ГК у пацієнтів із РА, а також успішності пошуку інноваційних ГК (лігандів ГК-рецепторів) із покращеним співвідношенням користь/ризик....
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....
Зв’язок між рівнем сироваткової сечової кислоти (ССК) і ризиком серцево-судинних захворювань (ССЗ) упродовж багатьох років є предметом вивчення дослідників. Установлено, що рівень ССК – незалежний предиктор смерті від усіх причин і серцево-судинної смерті, зокрема від гострого коронарного синдрому, інсульту та серцевої недостатності (СН). Також опубліковано багато робіт про зв’язок між ССК і функцією нирок. Попри значну кількість публікацій, деякі моменти, а саме: яким є оптимальний поріг ССК для визначення ризику ССЗ, чи необхідна корекція значень ССК для функції нирок, чи є ССК ключовим патологічним елементом метаболічної дисрегуляції, потребують прояснення....