4 серпня, 2020
Рекомендації Американського товариства фахівців з інфекційних хвороб (Infectious Diseases Society of America, IDSA) щодо діагностики, лікування та профілактики COVID‑19

(Перегляд 25.06.2020)
Рекомендації IDSA щодо лікування та ведення пацієнтів з COVID‑19
Adarsh Bhimraj, Rebecca L. Morgan, Amy Hirsch Shumaker, Valery Lavergne, Lindsey Baden, Vincent Chi-Chung Cheng, Kathryn M. Edwards, Rajesh Gandhi, Jason Gallagher, William J. Muller, John C. O’Horo, Shmuel Shoham, M. Hassan Murad, Reem A. Mustafa, Shahnaz Sultan, Yngve Falck-Ytter
Рекомендація 1. Гідроксихлорохін/хлорохін рекомендовано лише для використання у клінічних дослідженнях (недостатньо даних).
Рекомендація 2. IDSA застерігає від застосування комбінації гідроксихлорохін/хлорохін плюс азитроміцин поза межами клінічних досліджень (умовна рекомендація, низький рівень доказовості).
Відомо, що гідроксихлорохін і хлорохін мають противірусні властивості, в тому числі щодо SARS і MERS. Вони демонструють активність щодо SARS-CoV‑2 in vitro [14, 16–18]. Азитроміцин у деяких дослідженнях також продемонстрував противірусну антивність in vitro [20–22]. Хоча достовірно невідомо, яким саме є механізм противірусної активності препарату, імовірні механізми полягають у пригніченні ендоцитозу, що обмежує реплікацію вірусу [23], а також у здатності індукувати інтерферонову відповідь [22, 24]. Макроліди демонструють протизапальну активність [25, 26].
Наявні 3 рандомізовані клінічні дослідження (РКД) та 6 порівняльних когортних досліджень лікування госпіталізованих пацієнтів з підтвердженим COVID‑19 [27–35].
Гідроксихлорохін
У 2 РКД серед 180 пацієнтів, які отримували і не отримували гідроксихлорохін, не було жодного летального випадку [27, 29]. Доступні натепер найкращі докази не продемонстрували, а також не змогли виключити переваг гідроксихлорохіну щодо клінічного розвитку COVID‑19 і кліренсу вірусу, оцінюваного за допомогою полімеразної ланцюгової реакції (ПЛР), хоча дещо більша частина пацієнтів у групі гідроксихлорохіну продемонструвала клінічне покращення (відносний ризик (ВР) 1.47; 95% довірчий інтервал (ДІ) 1.02, 2.11), але достовірність цих доказів була дуже низькою.
Два нерандомізовані порівняльні дослідження вказують на підвищений ризик подовження інтервалу QT серед пацієнтів, що отримували гідроксихлорохін [32, 33]. Rosenberg (2020) повідомив, що у 16% пацієнтів з групи гідроксихлорохіну виникали аритмії порівняно з 10% пацієнтів групи, що не отримувала препарат.
Відомі випадки, коли на тлі лікування COVID‑19 гідроксихлорохіном, хлорохіном і 4-амінохінолонами у пацієнтів з недостатністю глюкозо‑6-фосфатдегідрогенази виникав гемоліз [42, 43]. Існує імовірність, що коронавірус сам є тригером гемолізу в таких пацієнтів [44–46], однак усе ж таки слід з обережністю використовувати ці препарати в пацієнтів з дефіцитом глюкозо‑6-фосфатдегідрогенази.
Гідроксихлорохін + азитроміцин
Три нерандомізованих дослідження не змогли встановити зв’язок між прийомом гідроксихлорохіну в комбінації з азитроміцином і летальністю.
У 2 дослідженнях було описано значне подовження сегменту QT у 10 з 95 пацієнтів, які отримували лікування комбінацією гідроксихлорохін–азитроміцин, що в результаті спричинило подовження сегменту до більш ніж 500 мс або припинення лікування [48, 49]. У дослідженні типу випадок–контроль було повідомлено про вищу мінімальну (415 проти 376 мс), середню (453 проти 407 мс) і максимальну тривалість інтервалу QT (533 проти 452 мс) серед пацієнтів з коронавірусною інфекцією, що отримували цю комбінацію (n=22), порівняно з контрольною групою (n=34) [36].
Зверніть увагу, що ця рекомендація не стосується використання азитроміцину для лікування вторинної бактеріальної пневмонії.
Рекомендація 3. У госпіталізованих пацієнтів з COVID‑19 комбінація лопінавір/ритонавір рекомендована лише для використання у клінічних дослідженнях (недостатньо даних).
Застосування комбінації лопінавір/ритонавір [56–58] не продемонструвало, але й не виключило позитивний вплив на рівень смертності (ВР 0.67; 95% ДI 0.38, 1.17), хоча відсутність клінічного покращення рідше зустрічалась у групі лопінавіру (ВР 0.78; 95% ДI 0.63, 0.97). Близько 14% пацієнтів не змогли завершити 14-денний курс лікування через побічні ефекти з боку травного тракту, у тому числі анорексію, нудоту, абдомінальний дискомфорт або діарею, а також 2 випадки серйозного побічного ефекту – гострого гастриту. У 2 пацієнтів також виникли шкірні висипання, які мали самолімітуючий характер. Для цієї комбінації характерний ризик ураження печінки, панкреатиту, висипань на шкірі, подовження QT, а також потенційна взаємодія з іншими препаратами внаслідок інгібування CYP3A.
РКД, проведене Cao та співавт., вказує, що така комбінація не має значного противірусного ефекту.
Рекомендація 4. Рекомендовано застосування глюкокортикостероїдів (ГКС) для лікування важкохворих* госпіталізованих пацієнтів (умовна рекомендація, середній рівень доказовості).
- *Важкохворими вважають пацієнтів з SpO2 ≤94% при диханні кімнатним повітрям, а також тих, хто потребує оксигенотерапії, механічної вентиляції легень чи екстракорпоральної мембранної оксигенації (ЕКМО).
- Ремарка: Доза дексаметазону – 6 мг внутрішньовенно або перорально впродовж 10 днів (або до виписки, якщо пацієнт виписується раніше), також може бути використана еквівалентна доза іншого ГКС – метилпреднізолон у дозі 32 мг або преднізон у дозі 40 мг.
Рекомендація 5. Поміж госпіталізованих пацієнтів з COVID‑19 без гіпоксемії, що потребують оксигенотерапії, IDSA не рекомендує застосовувати ГКС (умовна рекомендація, низький рівень доказовості).
На початку пандемії SARS-CoV‑2 ГКС не були рекомендовані у зв’язку з ризиком погіршення клінічного стану пацієнта, подовженим кліренсом вірусу та імовірними побічними реакціями [60–62]. Однак нещодавно проведені мультицентрові РКД у пацієнтів із захворюванням середньої тяжкості та тяжким продемонстрували зменшення кількості днів перебування на ШВЛ, а також зниження смертності при застосуванні дексаметазону впродовж 10 днів [64].
У РКД RECOVERY, проведеному у Великобританії, взяли участь 2 104 пацієнти, які отримували дексаметазон, і 4 321 пацієнт, які отримували стандартне лікування. Кількість смертельних випадків упродовж 28 днів була на 17% нижчою серед пацієнтів, які отримували дексаметазон; ці пацієнти також мали вищі шанси бути виписаними з лікарні впродовж 28 днів. Натомість, у пацієнтів без гіпоксії жодної користі препарату виявлено не було. Могли виникнути такі побічні ефекти: гіпоглікемія, розлади з боку центральної нервової системи (ЦНС; порушення свідомості), пригнічення функції наднирників і ризик бактеріальних чи грибкових інфекцій [67, 73, 74].
Рекомендація 6. Застосування тоцилізумабу у госпіталізованих пацієнтів з COVID‑19 рекомендовано лише в контексті клінічних досліджень.
Наявне 1 дослідження [75], у яке було залучено 21 пацієнта з тяжким або критичним захворюванням. У такій групі пацієнтів очікувана летальність становить 20%, однак з-поміж 21 пацієнта у дослідженні Xu (2020) не було жодного летального випадку. Побічних ефектів також не спостерігалося.
Рекомендація 7. Застосування плазми реконвалесцентів у госпіталізованих пацієнтів з COVID‑19 рекомендовано лише в контексті клінічних досліджень (недостатньо даних).
Наявні 1 РКД, 2 порівняльних когортних дослідження та 2 дослідження без контрольної групи щодо використання плазми конвалесцентів.
Достеменно невідомо, який повинен бути мінімальний титр антитіл у плазмі для використання у лікуванні. У більш ніж 80% донорів титр IgG в ІФА становить ≥1:320 [85]. Щодо того, коли варто застосовувати таке лікування, рекомендовано якомога раніше призначати плазму [87, 88].
Joyner та співавт. (2020) повідомили про 5 000 важких пацієнтів, частота тяжких побічних реакцій становила <1%. Отримані результати щодо користі такого лікування були недостовірними. У найбільшому дослідженні безпечності плазми реконвалесцентів повідомлялось про 15 смертельних випадків упродовж 4 год після трансфузії серед 5 000 пацієнтів (0.3%) [90], ще 4 (0.08%) було розцінено як імовірно пов’язані з трансфузією.
Крім того, було зареєстровано 21 випадок серйозної несмертельної побічної реакції (0,4%): 7 випадків перевантаження системи кровобігу, пов’язаного з переливанням крові (transfusion-associated circulatory overload, ТАСО), 11 випадків посттрансфузійного гострого ураження легенів (transfusion-related acute lung injury, TRALI) та 3 випадки тяжких алергічних реакцій. В меншому дослідженні, в якому взяли участь 52 пацієнти, у 2 суб’єктів розвинулися пов’язані з трансфузією побічні реакції (такі як озноб і висип; задишка, ціаноз і сильна задишка) протягом 6 год після переливання [87].
Рекомендація 8. Для лікування важких госпіталізованих пацієнтів з COVID‑19 рекомендовано застосування ремдесивіру в порівнянні з відсутністю противірусної терапії (умовна рекомендація, середній рівень доказовості).
- Ремарка: У разі потреби вибору пацієнтів у зв’язку з нестачею препаратів: ремдесивір демонструє вищу ефективність у пацієнтів з тяжким перебігом COVID‑19, що отримують оксигенотерапію, аніж у тих, хто перебуває на ШВЛ чи ЕКМО.
Рекомендація 9. Пацієнтам з тяжким перебігом COVID‑19, які отримують оксигенотерапію, але не перебувають на ШВЛ чи ЕКМО, рекомендована тривалість лікування ремдесивіром становить 5 днів, а не 10 днів (умовна рекомендація, низький рівень доказовості).
- Ремарка: У пацієнтів на ШВЛ чи ЕКМО тривалість лікування становить 10 днів.
У резус-макак лікування ремдесивіром продемонструвало зменшення вірусного навантаження SARS-CoV‑2, патологічних змін і сповільнювало прогресування клінічних проявів хвороби [94]. У цій тваринній моделі лікування ремедесивіром, розпочате через 12 год після інокуляції, зменшило клінічні ознаки, реплікацію вірусу в легенях і тяжкість ураження легенів. Серія випадків з 53 пацієнтами з тяжкою пневмонією COVID‑19, які отримували ремдесивір, продемонструвала клінічне поліпшення на 68% після спостереження вродовж 18 днів, з летальністю 13% і загальноприйнятим профілем токсичності [95].
Два РКД, що порівнювали лікування ремдесивіром (200 мг у 1-й день, далі – 100 мг щодня протягом 2–10 днів) та інше лікування [96, 97], а також одне РКД, у якому порівнювали лікування протягом 5 днів (200 мг у 1-й день, 100 мг на день протягом 2–5 днів) проти 10 днів (200 мг у 1-й день, 100 мг на добу протягом 2–10 днів) [98], були найкращими доступними доказами серед госпіталізованих осіб з тяжким перебігом COVID‑19.
Попередні дані дослідження Beigel і співавт. (наприклад, Adaptive Covid‑19 Treatment Trial [ACTT‑1]) показали тенденцію до зниження смертності при застосуванні ремдесивіру на 14-й день [96]. Крім того, пацієнти, які отримували ремдесивір, мали коротший середній час до одужання [96]. У іншому дослідженні Goldman та співавт. порівнювали лікування із застосуванням ремдесивіру протягом 5 та 10 днів; коротший режим лікування продемонстрував зниження летальності та клінічне покращення протягом 14 днів.
Рекомендація 10. IDSA не рекомендує застосовувати фамотидин у госпіталізованих пацієнтів з тяжким перебігом COVID‑19 поза межами клінічних досліджень (умовна рекомендація, дуже низький рівень доказовості).
Існують повідомлення про випадки з Китаю про те, що пацієнти, заражені коронавірусом, які отримували фамотидин, антагоніст Н2-рецепторів для лікування таких станів, як гастроезофагеальна рефлюксна хвороба (ГЕРХ) і виразкова хвороба, мали вищі рівні виживаності порівняно з тими, хто отримував інгібітори протонної помпи (ІПП) [99]. Одна з теорій полягає в тому, що фамотидин, як і багато інших сполук, зв’язує і інгібує основну протеазу коронавірусу, 3С-подібну основну протеазу (3CLpro) [100].
Було проведено одне когортне дослідження, у якому порівнювали 84 пацієнтів, які отримували фамотидин, з 1 536 пацієнтами, які його не отримували [101]. Фамотидин може зменшувати смертність пацієнтів або наслідки інтубації, проте докази є дуже неточними.
Фамотидин добре переносився. Найпоширенішими побічними явищами були закреп або діарея (< 5%). Тяжкі побічні явища реєстрували у менше ніж 1% пацієнтів, що приймали фамотидин.
Інші методи лікування, які наразі досліджуються
Антиретровірусні препарати
Дарунавір не виявив активності проти SARS-CoV‑2 у клінічно значущих концентраціях in vitro. Janssen, виробник дарунавір/кобіцистату, повідомив, що в одному з випробувань [102] було зроблено висновок, що дарунавір/кобіцистат разом зі звичайними методами лікування не були ефективними для досягнення кліренсу вірусу на 7-й день порівняно зі звичайними методами лікування.
Комбінація лопінавір–ритонавіру з інтерфероном-β або іншими противірусними препаратами
Лопінавір–ритонавір – це комбінація інгібіторів протеази для лікування ВІЛ-інфекції. Лопінавір–ритонавір має противірусну активність in vitro щодо β-коронавірусів, таких як SARS-CoV і MERS-CoV [103–106]. У відкритому дослідженні затосування лопінавіру–ритонавіру з рибавірином знижувало смертність пацієнтів та потребу в інтенсивній терапії у госпіталізованих хворих із SARS-CoV‑1 порівняно з контрольною анамнестичною групою [105]. Було показано, що багато інтерферонів, особливо інтерферон-β, мають in vitro скромну антивірусну активність проти SARS-CoV і MERS-CoV [103, 104]. Лопінавір–ритонавір та інтерферон-β1b окремо або в комбінації оцінюються в клінічних дослідженнях.
Плазма реконвалесцентів з метою профілактики
Очікується, що незабаром розпочнеться дослідження використання плазми реконвалесцентів для профілактики SARS-CoV‑2 у дорослих групи високого рівня зараження [114].
Рибавірин
Наразі є лише дані, отримані in vitro, про активність рибавірину щодо SARS-CoV‑2. У систематичному огляді лікування рибавірином у пацієнтів, інфікованих SARS-CoV‑1, 26 досліджень були віднесені до категорії непереконливих, а 4 – виявили можливу шкоду препарату [115].
Озельтамівір
Озельтамівір – інгібітор нейрамінідази, який використовують для профілактики й лікування грипу. Зважаючи на його специфічність до ферменту, який не зустрічається у коронавірусів, незрозуміло, яким мав би бути механізм його дії проти COVID‑19. Однак його було використано в комбінаціях противірусної терапії в Ухані [117], і він розглядається для застосування у складі комбінованих схем.
Внутрішньовенний імуноглобулін (ВВІГ)
Потенційна корисність ВВІГ для лікування SARS-CoV‑2 наразі невідома. Повідомлялося про його використання у кількох пацієнтів з COVID‑19 [121], але необхідні дослідження, щоб визначити роль ВВІГ у лікуванні SARS-CoV‑2.
Чи слід припиняти застосування нестероїдних протизапальних препаратів (НПЗП) у пацієнтів з COVID‑19?
Роль НПЗП у лікуванні SARS-CoV-2 широко обговорюється. Коронавіруси людини, у тому числя SARS-CoV‑2, використовують ангіотензинперетворювальний фермент 2 (АПФ-2) для проникнення у клітини-мішені [122]. Існує теорія, що НПЗП через підвищення регуляції АПФ-2 у клітинах людини можуть обтяжувати перебіг COVID‑19 у осіб, які приймають НПЗП. Але ні FDA, ні Європейське агентство з лікарських засобів, ні ВООЗ не знайшли доказів того, що прийом НПЗП пов’язаний з клінічним погіршенням стану пацієнтів з COVID‑19. Хоча жодних причинно-наслідкових доказів несприятливих наслідків застосування НПЗП при лікуванні COVID‑19 опубліковано не було, відомі ризики застосування НПЗП, у тому числі серцево-судинні, шлунково-кишкові та ниркові побічні явища [123, 124]. Нині проводиться РКД для оцінки ролі напроксену в пацієнтів у критичному стані [127].
Чи слід припиняти прийом інгібіторів АПФ і блокаторів рецепторів ангіотензину ІІ при гіпертонічній хворобі у пацієнтів з COVID‑19?
АПФ-2 є рецептором для SARS-CoV‑2 у людських клітинах. Оскільки інгібітори АПФ і блокатори ангіотензинових рецепторів (БАР) можуть збільшувати експресію АПФ-2, існує імовірність, що ці препарати можуть збільшити ймовірність зараження SARS-CoV‑2 або погіршити перебіг COVID‑19. На сьогодні, однак, немає клінічних даних, які б підтверджували цю гіпотетичну проблему. З цієї причини Американська асоціація серця (American Heart Association), Американське товариство з серцевої недостатності (Heart Failure Society of America) та Американський коледж кардіології (American College of Cardiology) рекомендують продовжувати лікування інгібіторами АПФ або БАР за наявності відповідних показань [128].
Рекомендації IDSA щодо профілактики COVID‑19
John B. Lynch, Perica Davitkov, Deverick J. Anderson, Adarsh Bhimraj, Vincent Chi-Chung Cheng, Judith Guzman-Cottrill, Jasmine Dhindsa, Abhijit Duggal, Mamta K. Jain, Grace M. Lee, Stephen Y. Liang, Allison McGeer, Valéry Lavergne, M. Hassan Murad, Reem A. Mustafa, Rebecca L. Morgan, Yngve Falck-Ytter, Shahnaz Sultan
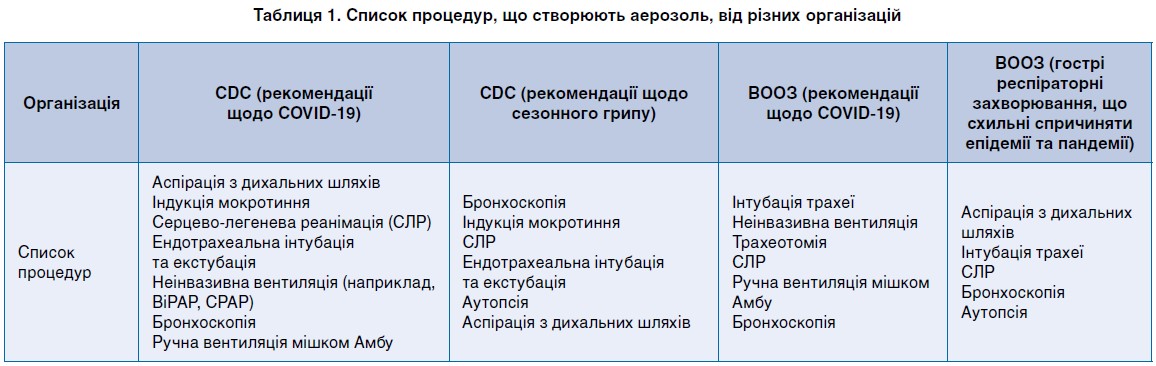
Трансмісія вірусу SARS-CoV‑2 від людини до людини відбувається насамперед через краплі, що містяться у видихуваному повітрі інфікованого. Дихальний захист (тобто хірургічна маска) запобігає потраплянню крапель на слизові оболонки носа і рота людини. Деякі медичні процедури спричиняють утворення вищих концентрацій інфекційних аерозолів з дрібними частинками (<0,5 мкм). Ці процедури, що називаються аерозоль-генеруючими процедурами (АГП), можуть збільшувати ризик інфікування медперсоналу SARS-CoV‑2.
Таким чином, для захисту медиків від вдихання менших частинок аерозолю, ймовірно, потрібен вищий рівень захисту органів дихання. Респіратори N95 і респіратори вищого рівня, такі як одноразові фільтруючі респіратори, респіратори з очищенням повітря (PAPR) та еластомерні респіратори забезпечують додатковий захист завдяки функції фільтрування повітря. Як і при крапельній трансмісії, необхідний захист очей у вигляді окулярів або захисного щита.
Звичайні умови: засоби індивідуального захисту (ЗІЗ) наявні та використовуються
Непередбачувані обставини: консервація, адаптація та заміна ЗІЗ з рідкісними випадками їх повторного використання.
Кризові умови: критична нестача ЗІЗ.
Затягнуте використання ЗІЗ: використання ЗІЗ для більш ніж одного пацієнта без заміни ЗІЗ з або без використання додаткових засобів (наприклад, захисний екран для обличчя поверх хірургічної маски). Рекомендовано лише у випадку надзвичайних чи кризових ситуацій [3].
Повторне використання ЗІЗ: використання ЗІЗ, що знімаються після кожного контакту з пацієнтом та використовуються повторно після певного періоду часу та/або обробки, рекомендовано лише у випадку надзвичайних чи кризових ситуацій [3].
Рутинний догляд за пацієнтами у ЗВИЧАЙНИХ умовах
Рекомендація 1: IDSA рекомендує медичному персоналу, який доглядає за пацієнтами з підозрою на COVID‑19 або відомою інфекцією, використовувати хірургічну маску або респіратор N95 (або N99, або PAPR) як частину відповідного ЗІЗ* (сильна рекомендація, докази середньої сили).
Рутинний догляд за пацієнтами при НЕПЕРЕДБАЧУВАНИХ ОБСТАВИНАХ або у КРИЗОВИХ УМОВАХ
Рекомендація 2: У випадку надзвичайних ситуацій або в кризових умовах (наприклад, у випадку дефіциту респіраторів) медичному персоналу, який доглядає за пацієнтами з підозрою на COVID‑19 або відомою інфекцією, рекомендовано використовувати хірургічну маску або повторно оброблений респіратор як частину відповідного ЗІЗ*, аніж бути без маски взагалі (сильна рекомендація, докази середньої сили).
*Відповідними ЗІЗ персоналу, крім маски чи респіратора, є захист очей, халат і рукавички. Відповідно до досліджень, близько 30% медперсоналу, які не були захищені (не носили маски) під час контакту з інфікованими пацієнтами, заразилися коронавірусом [15]. У ретроспективному когортному дослідженні, в якому порівнювали медперсонал, що носив респіратори N95 (N=278) та доглядав за пацієнтами групи високого ризику COVID‑19, з тими, що не використовували маски (N=213) та доглядали за пацієнтами з низьким рівнем ризику, заразилося 10/213 незахищених працівників порівняно з 0/278 працівників, які використовували респіратори N95 [16]. Загалом, рівень зараження медперсоналу був утричі вищим порівняно із загальною популяцією, ймовірно, через неадекватне використання ЗІЗ [17].
На основі існуючого систематичного огляду 5 обсерваційних досліджень медичного персоналу, носіння будь-якої маски (хірургічна маска або респіратор N95) продемонструвало значне зниження ризику розвитку інфекції [18]. Чотири дослідження, що порівнювали респіратори N95 з хірургічними масками для профілактики гострих вірусних респіраторних інфекцій також не виявили переваг респіраторів, хоча й не виключили їх [19].
Рутинний догляд за пацієнтами у ЗВИЧАЙНИХ умовах, у випадку НЕПЕРЕДБАЧУВАНИХ ОБСТАВИН або КРИЗОВИХ СИТУАЦІЙ
Рекомендація 3: IDSA не рекомендує використовувати подвійні рукавички як частину ЗІЗ* (недостатньо даних).
*Відповідними ЗІЗ персоналу, крім маски чи респіратора, є захист очей, халат і рукавички.
Існує теоретичний ризик передачі вірусу з контамінованих ЗІЗ на руки після зняття забруднених рукавичок чи одягу, що може призвести до розвитку COVID‑19. В одному дослідженні були зібрані мазки з 30 ЗІЗ після того, як їх було знято. Серед 90 зібраних зразків не було жодного позитивного [20]. В іншому дослідженні порівнювали ефективність захисту від одних рукавичок, одягнених поверх рукава халату, та двох пар рукавичок, одну з яких вдягали під рукав, а одну – поверх рукава [21]. Для цього провели лабораторний експеримент, що симулював повітряно-краплинну контамінацію. Результати дослідження показали, що використання двох пар рукавичок пов’язане з меншим забрудненням. Але експертна група не знайшла достатньо даних для створення рекомендації щодо двох пар рукавичок.
Рекомендація 4: Керівна панель IDSA не дає жодних рекомендацій щодо використання бахіл для медичного персоналу, який опікується пацієнтами з підозрою на COVID‑19 або відомою інфекцією, як частини відповідного ЗІЗ* (недостатньо даних). Не було жодних досліджень, які б оцінювали бахіли як частину ЗІЗ та їхню роль у трансмісії COVID‑19. У дослідженні Ong та співавт. було взято зразки з ЗІЗ (~ 90 отриманих зразків). Лише один зразок із ЗІЗ, отриманий з поверхні передньої частини взуття, виявився позитивним [20].
Процедури, що супроводжуються генеруванням аерозолю
Деякі медичні процедури, швидше за все, утворюють вищі концентрації дрібних інфікованих частинок (<0,5 мкм), що утворюють дихальні аерозолі. Ці АГП можуть збільшувати ризик інфікування SARS-CoV‑2 серед медичних працівників (список АГП наведено в таблиці 1). Таким чином, ймовірно, необхідний вищий рівень захисту органів дихання медичного персоналу від вдихання дрібніших частинок аерозолю. Респіратори N95 та вищого рівня захисту (наприклад, одноразові фільтруючі респіратори, моторизовані респіратори для очищення повітря (powered air-purifying respirator, PAPR) та еластомерні респіратори) забезпечують додатковий захист завдяки своїм можливостям фільтрації. Як і у випадку крапельної передачи, необхідний захист очей у вигляді окулярів чи захисного щита.
АГП в ЗВИЧАЙНИХ умовах
Рекомендація 5: IDSA рекомендує медичному персоналу, який бере участь у проведенні АГП для пацієнтів з підозрою наCOVID‑19 і підтвердженою інфекцією, використовувати респіратор N95 (або N99, або PAPR) замість хірургічної маски як частину відповідного ЗІЗ* (сильна рекомендація, дуже низька достовірність доказів).
Коментар: Незважаючи на дуже низьку якість і непрямі докази, що підтверджують цю рекомендацію, IDSA вважає необхідним уникати серйозної шкоди залученому медичному персоналу.
Не було прямих доказів зв’язку між АГП і частотою зараження COVID‑19 серед медпрацівників. На підставі даних спостереження серед заражених медпрацівників, участь у АГП, таких як інтубація трахеї, була пов’язана з вишим ризиком зараження [23]. Дані, отримані шляхом лабораторного моделювання, також надавали непрямі докази життєздатності аерозолізованого SARS-CoV‑2 [24].
Крім того, дані про забруднення навколишнього середовища були отримані шляхом відбору проб різних поверхонь і проб повітря з палат, де перебували пацієнти з COVID‑19: зразки з 87% (13/15) приміщень (у тому числі системи вентиляції; SARS-CoV‑2 було виявлено методом ПЛР) та з 60% (3/5) туалетних приміщень (у тому числі унітазу, мийки та дверної ручки) були позитивними. Зразки повітря були негативними, незважаючи на ступінь забруднення навколишнього середовища [25].
АГП при НЕПЕРЕДБАЧУВАНИХ ОБСТАВИНАХ або у КРИЗОВИХ УМОВАХ
Рекомендація 6: У випадку надзвичайних ситуацій або в умовах кризи (наприклад, у випадку дефіциту респіраторів) медичному персоналу, який бере участь у проведенні АГП для пацієнтів з підозрою на COVID‑19 або відомою інфекцією, рекомендовано використовувати повторно оброблений респіратор, а не хірургічну маску як частину відповідного ЗІЗ* (умовна рекомендація, докази дуже низької достовірності).
Прямих доказів щодо рівня зараженості медичного персоналу, що застосовував оброблений чи повторно використовуваний респіратор N95, знайдено не було.
Три дослідження, проведені в лабораторних умовах з використанням випаровуваного перекису водню (ВПВ), показали ефективне знезараження респіраторів N95 без помітних фізичних змін і без погіршення їх фільтраційних властивостей після 30–50 циклів ВПВ, однак через 20 циклів еластичні ремінці стали жорсткішими, тому виникало занепокоєння щодо комфортності такого респіратора та його положення на обличчі [26–28].
Ультрафіолетове бактерицидне опромінення (УФБО) для знезараження та повторного використання респіраторів N95 показало подібні результати протягом 20 циклів знезараження без впливу на ефективність фільтрації в різних лабораторних дослідженнях [26, 29–31]. Однак було виявлено розбіжність у придатності після 10–20 циклів УФБО залежно від моделі тестованого респіратора N95 [30].
Метод знезараження у сухожаровій шафі було використано в 4 дослідженнях, в яких повідомлялося, що тепло, яке подається за температури 70–80 °C, не впливає на ефективність фільтрації або деградацію респіратора N95 [31, 33, 34]. В одному з досліджень респіратор N95 став непридатним для використання, тому рекомендується лише 2 використання після теплової деконтамінації [35].
Не знайдено жодних досліджень ефективності повторного використання оброблених хірургічних масок для профілактики SARS-CoV‑2-інфекції у медичних працівників.
Дуже низький ризик доказів цієї рекомендації – через відсутність досліджень, що порівнюють ефективність нових та оброблених респіраторів N95, і даних про рівень інфікування медичних працівників, які повторно використовували знезаражені респіратори.
Рекомендація 7: У випадку надзвичайних ситуацій або в кризових умовах (наприклад, у випадку дефіциту респіраторів) медичному персоналу, який бере участь у проведенні АГП для пацієнтів з підозрою на COVID‑19 або відомою інфекцією, рекомендовано також використовувати лицевий щит або хірургічну маску як прикриття для респіратора N95, щоб забезпечити ДОВШЕ його використання як частини відповідного ЗІЗ* (сильна рекомендація, дуже низька доказовість).
Коментар: ця рекомендація передбачає правильну послідовність знімання ЗІЗ та гігієну рук до та після зняття щита для обличчя або хірургічної маски, що покриває респіратор.
Рекомендація 8: У випадку надзвичайних ситуацій або в кризових умовах (наприклад, у випадку дефіциту респіраторів) медичному персоналу, який бере участь у проведенні АГП для пацієнтів з підозрою на COVID‑19 або відомою інфекцією, рекомендовано також використовувати лицевий щит або хірургічну маску як прикриття для респіратора N95, щоб забезпечити ПОВТОРНЕ його використання як частини відповідного ЗІЗ* (умовна рекомендація, докази дуже низької достовірності).
Коментар: ця рекомендація передбачає правильну послідовність знімання ЗІЗ та гігієну рук до та після зняття щитка для обличчя або хірургічної маски, що покриває респіратор.
Тривале використання [36] визначається як носіння одного респіратора N95 під час безлічі різних послідовних контактів з пацієнтами без його знімання між прийомами пацієнтів. За даними Центрів з контролю та профілактики захворювань в США (Centers for Disease Control and Prevention, CDC), максимальна тривалість використання респіратора становить 8–12 год [36]. Повторне використання – носіння одного респіратора N95 для безлічі різних пацієнтів, коли між оглядами пацієнтів є перерви. Якщо виробник не встановить інше, CDC пропонує обмежити повторне використання респіраторів N95: не більше ніж 5 разів [36].
Лицевий щит або хірургічна маска вважаються бар’єром для поверхневого забруднення, тим самим продовжуючи термін служби респіратора N95. Однак про вплив тривалого використання цієї комбінації на рівень зараження серед медиків не повідомляється [40].
Виходячи з лабораторних даних, тестування in vitro на міцність і витривалість респіраторів N95, можна стверджувати, що респіратори можна використовувати 3–5 разів підряд, поки вони не стануть непридатними [41].
*Відповідними ЗІЗ, крім маски чи респіратора, є засоби для захисту очей, халат і рукавички.
Рекомендації IDSA щодо діагностики COVID‑19
Kimberly E. Hanson, Angela M. Caliendo, Cesar A. Arias, Janet A. Englund, Mark J. Lee, Mark Loeb, Robin Patel, Abdallah El Alayli, Mohamad A. Kalot, Yngve Falck-Ytter, Valéry Lavergne, Rebecca L. Morgan, M. Hassan Murad, Shahnaz Sultan, Adarsh Bhimraj, Reem A. Mustafa
Рекомендація 1: IDSA рекомендує проведення тесту методом ампліфікації нуклеїнових кислот SARS-CoV‑2 (nucleic acid amplification test, NAAT) у осіб з наявністю симптомів у громадах, в яких підозрюється наявність COVID‑19, навіть коли клінічно імовірність COVID‑19 низька (сильна рекомендація, дуже низька точність доказів).
 В цій і наступних рекомендаціях експертна група вважає пацієнтами з наявністю симптомів осіб, що мають хоча б один з найпоширеніших симптомів COVID‑19 (табл. 2).
В цій і наступних рекомендаціях експертна група вважає пацієнтами з наявністю симптомів осіб, що мають хоча б один з найпоширеніших симптомів COVID‑19 (табл. 2).
- Клінічна оцінка сама по собі не є точним предиктором COVID‑19.
- Експертна група вважає своєчасність результатів NAAT SARS-CoV‑2 важливою як для ведення окремого пацієнта, так і для закладу охорони здоров’я та громадського здоров’я загалом. В амбулаторних умовах оптимально отримувати результати впродовж 48 год після взяття зразків на аналіз.
Часто встановлення діагнозу грунтувалось лише на клінічних ознаках, що призвело до того, що велика частка пацієнтів, яким діагностували COVID‑19, насправді не мали захворювання (гіпердіагностика коливалася між 62 і 98%). Навіть у госпіталізованих хворих з пневмонією частка хибнопозитивних діагнозів у деяких дослідженнях сягала 62%.
Рекомендація 2: IDSA пропонує проводити забір назофарингеальних зразків, носових мазків або мазків з середньої носової раковини, аніж орофарингеальних зразків або тільки слину для виявлення РНК SARS-CoV‑2 у осіб з симптомами інфекції верхніх дихальних шляхів або грипоподібного захворювання з підозрою на COVID‑19 (умовна рекомендація, дуже низька достовірність доказів).
Зауваження:
- Ця рекомендація не стосується тестування комбінацій різних зразків через відсутність доказів.
Всього в 11 звітах представлено дані про точність тестувань різних зразків; 8 з них [35, 36, 38–41, 43, 44] надали порівняльні дані для двох або більше методів забору зразків; 3 інші [33, 37, 45] надали дані зразків, відібраних з однієї ділянки. Дослідження з порівняльними даними показали, що тестування зразків, отриманих з ротової порожнини, були менш чутливими, ніж назофарингеальні зразки, зразки із середньої носової раковини або назальні змиви.
Дослідження Osterdahl M. та співавт. [34] показало, що в 3 пацієнтів з негативними результатами проб, отриманих з горла, взятих на 3-й день після появи симптомів, позитивний результат було отримано, коли було проаналізовано проби, одержані з горла, взяті на 4-й день після появи симптомів. Zou L. та співавт. (2020) [42] спостерігали більшу кількість вірусної РНК у зразках з носа порівняно з мазками з горла. Одне дослідження [41] продемонструвало, що чутливість дослідження слини становила 85% (95% ДІ 69–94%) при меншому вірусному навантаженні.
Назофарингеальні зразки тривалий час розглядали як зразки вибору при заборі матеріалу в пацієнтів з гострою респіраторною інфекцією верхніх дихальних шляхів для виявлення вірусів методом ампліфікації нуклеїнових кислот. Потенційною шкодою від альтернативних зразків є отримання псевдонегативних результатів. Однією з потенційних переваг отримання назальних зразків, мазків з горла та середньої носової раковини є менш інвазивний характер забору порівняно з назофарингеальними мазками. Крім того, вимоги до ЗІЗ для медичних працівників, які забирають зразки, що не спричинюють кашель, можуть бути менш суворими. Нарешті, відбір не назофарингеальних проб може виконувати сам пацієнт, що може додатково зменшити контакт медичних працівників з інфекцією.
Рекомендація 3. IDSA припускає, що зразки з носової порожнини та середньої носової раковини можуть бути зібрані для тестування на РНК SARS-CoV‑2 як самими пацієнтами, так і медичними працівниками у осіб з симптомами інфекції верхніх дихальних шляхів або грипоподібного захворювання з підозрою на COVID‑19 (умовна рекомендація, низька достовірність доказів).
Зауваження:
- Відповідний забір зразка та транспортування до лабораторії є критично важливим.
- Пацієнтам, які намагаються здійснити забір самостійно, необхідно надати чітку покрокову інструкцію у вигляді короткого відео або друкованої брошури з ілюстраціями.
- Більшість самостійних заборів матеріалу проводились у присутності медичного працівника.
Ця рекомендація грунтується на 3 когортних дослідженнях. Дослідження, які використовували для створення рекомендації, були невеликими та неоднорідними, оскільки для проведення заборів використовували різні матеріали та консерванти. Терміни забору щодо виникнення симптомів також важливі, але не були добре зафіксовані у цих дослідженнях. Через таку неоднорідність даних загальна достовірність доказів була низькою.
Самостійно зібрані зразки, у тому числі мазки з передньої частини носової порожнини, середньої носової раковини та слина (без кашлю), зменшать контакт медпрацівників з інфікованими та можуть зменшити використання масок і респіраторів. Загальна чутливість тестування була подібною для зразків, відібраних пацієнтами та медичними працівниками. Проблеми із самостійним збором охоплюють відсутність досвіду чи відповідної документації; невідповідний забір зразків і/або поводження з ними може призвести до неточних результатів.
Рекомендація 4: IDSA пропонує спочатку аналізувати зразки, отримані з верхніх дихальних шляхів (наприклад, носоглотки), а не з нижніх дихальних шляхів для тестування на РНК SARS-CoV‑2 у госпіталізованих пацієнтів з підозрою на інфекцію нижніх дихальних шляхів COVID‑19. Якщо перший результат є негативним, але є підозра на COVID‑19, рекомендують отримати зразок з нижніх дихальних шляхів (наприклад, мокротиння, бронхоальвеолярні змиви, аспірат із трахеї), а не проводити інший забір з верхніх дихальних шляхів (умовна рекомендація, дуже низька достовірність доказів).
Зауваження:
- Для госпіталізованих пацієнтів результати тестів повинні бути отримані впродовж 24 год.
Було проведено 9 досліджень, під час яких виконували забір зразків з верхніх і нижніх дихальних шляхів послідовно в одного пацієнта. У 2 дослідженнях повідомляли про вірусне навантаження, однак відсутня інформація щодо чутливості [47, 48]. У 7 дослідженнях було вказано чутливість, з яких 3 були проведені у вигляді дослідження типу випадок–контроль [35, 49, 50], а в одному дослідженні було вказано результати зразків, але не пацієнтів [51].
Дані свідчать про те, що дослідження зразків, отриманих з нижніх дихальних шляхів, збільшує чутливість тестування на РНК SARS-CoV‑2, зменшуючи кількість помилково негативних результатів. Очевидною перевагою використання для тестування зразків з нижніх дихальних шляхів є зменшення кількості пацієнтів, у яких не було діагностовано коронавірусну інфекцію. Існують також ризики для медперсоналу, оскільки під час забору проб з нижніх дихальних шляхів у заражених пацієнтів можливе поширення аерозолю з інфекційними часточками, а також підвищується потреба в ЗІЗ, які можуть бути дефіцитними.
Рекомендація 5: IDSA рекомендує проводити єдиний тест на вірусну РНК і не повторювати його у осіб з симптомами з клінічно малоймовірною COVID‑19 (умовна рекомендація, низька достовірність доказів).
Зауваження:
Про низьку клінічну імовірність COVID‑19 свідчить епідеміологічна ситуація в регіоні в поєднанні з клінічною оцінкою.
Рекомендація 6: IDSA пропонує повторити тестування на вірусну РНК, коли початковий тест є негативним (проти виконання одного тесту) у осіб з симптомами з клінічною підозрою на COVID‑19 середньої чи високої імовірності (умовна рекомендація, низька достовірність доказів).
Зауваження:
- Клінічна підозра середньої або високої імовірності, як правило, стосується стаціонару та базується на важкості стану пацієнта, кількості та часу виникнення клінічних ознак/симптомів.
- Повторне тестування зазвичай має відбуватися через 24–48 год після першого тестування та тоді, коли було отримано негативний результат першого дослідження.
- Для повторного тестування рекомендовано використовувати інший тип зразка, у випадку симптомів інфекції нижніх дихальних шляхів – бажано зразок, отриманий з нижніх дихальних шляхів.
Ця рекомендація ґрунтується на даних 3 когортних досліджень [11, 54, 55]. У цих дослідженнях проводили тестування NAAT, використовуючи назофарингеальний зразок, отриманий у пацієнтів з симптомами та ознаками ураження нижніх дихальних шляхів. Якщо перший результат був негативним, другий зразок було відібрано через 2 або 3 дні для повторного тестування.
На думку IDSA, частота хибнонегативних результатів (ХНР) <2% буде прийнятною. Одноразове тестування порівняно з повторним тестуванням призводить до частоти ХНР приблизно 10–20 випадків з 1 000 у групі пацієнтів з недостовірною клінічною підозрою та до вищих показників (ПН >60 випадків з 1 000) у групі пацієнтів з клінічною підозрою середньої чи високої достовірності.
Рекомендація 7: IDSA не дає жодних рекомендацій за або проти використання швидкого тесту (час тестування ≤1 год) порівняно зі стандартним тестуванням для виявлення РНК у осіб з симптомами, у яких підозрюють наявність COVID‑19.
Було виявлено 7 досліджень, у яких було описано використання швидкого NAAT-дослідження [34, 56–59], лише 2 з них повідомляли про застосування тестів, сертифікованих для використання в умовах невідкладної ситуації (emergency use authorization – EUA) [60, 61]. Чутливість і специфічність швидких ізотермічних EUA порівняно зі стандартними лабораторними аналізами коливалася між 75–94% і 99–100% відповідно.
Головною перевагою швидкого результату є можливість своєчасно приймати клінічні рішення та впроваджувати заходи для захисту інших. Можлива шкода швидких тестів – це потенційне збільшення кількості хибнонегативних результатів, що може призвести до невстановлених діагнозів, коли пацієнтів не ізолювали, якщо чутливість нижча, аніж у стандартних тестах.
Рекомендація 8: IDSA пропонує проводити тестування на РНК SARS-CoV‑2 у безсимптомних осіб, які були в контакті з хворим на COVID‑19 або пацієнтом з підозрою на інфекцію (умовна рекомендація, дуже низька достовірність доказів).
Зауваження:
- Ця рекомендація передбачає, що пацієнт не носив відповідних ЗІЗ.
- Рішення щодо тестування безсимптомних пацієнтів залежатиме від наявності ресурсів для проведення тестування.
Ми оцінювали дослідження, в яких повідомлялося про поширеність COVID‑19 серед безсимптомних осіб у домашніх кластерах [15, 17, 19], при спалахах у будинках престарілих [14], серед пасажирів, які перебувають у карантині на круїзному судні, або пасажирів репатріаційних рейсів [18], працівників лікарні, які тісно контактували з пацієнтами з COVID‑19 [13], та клієнтів і працівників ресторанів, у яких виник спалах COVID‑19 [16]. Загалом, поширеність становила від 10 до 50% у місцях, де перед проведенням тестування підозрювалось значне поширення інфекції.
Тестування безсимптомних осіб, які контактували з інфікованими, дає змогу ізолювати пацієнтів з позитивними результатами. Зважаючи на відсутність доказів, негативний тест після експозиції не означає, що можна припинити карантин. Деякі особи можуть перебувати в інкубаційному періоді. Як результат, негативний тест після контакту з хворим не може бути використаний для уникнення карантину. Позитивний результат, однак, вкаже на важливість ізоляції, а також відстеження контактів.
Рекомендація 9: IDSA не рекомендує проводити тестування на РНК SARS-CoV‑2 у безсимптомних осіб без відомого контакту з COVID‑19, які госпіталізуються у районах з низькою поширеністю COVID‑19 у популяції (умовна рекомендація, дуже низька точність доказів).
Зауваження:
- Безсимптомними вважають пацієнтів без жодного симптому з таблиці 2.
- Низькою вважали поширеність COVID‑19 <2%.
- Ця рекомендація не поширюється на людей з ослабленим імунітетом.
- Рекомендація не поширюється на осіб, які перенесли великі оперативні втручання або отримують АГП.
Рекомендація 10: IDSA рекомендує проведення тестування на РНК SARS-CoV‑2 у безсимптомних осіб без відомого контакту з COVID‑19, які госпіталізуються у районах з високою поширеністю COVID‑19 у популяції (умовна рекомендація, дуже низька точність доказів).
Зауваження:
- Високою вважали поширеність COVID‑19 у популяції >10%.
- Рішення про тестування безсимптомних пацієнтів (у тому числі, коли поширеність інфекції становить від 2 до 9%) залежатиме від наявності ресурсів для проведення тестування.
Розглянувши наслідки невстановлення діагнозу COVID‑19 як на індивідуальному, так і на популяційному рівні та врахувавши чутливість наявних тестів, було визначено, що допустимий максимальний поріг <10–20 пропущених випадків на 1 000 осіб. При непроведенні тестувань у районах з низькою поширеністю захворювання (<2%) цей поріг не перевищується. Однак у районах з проміжними та високими показниками поширеності (>2%) непроведення тестування призведе до більшої кількості пропущених випадків, що перевищує прийнятний поріг.
Виявлення позитивних пацієнтів та їх ізоляція зменшить ризик розвитку нозокоміальних спалахів. З іншого боку, хибнонегативні результати є потенційно шкідливими. Зважаючи на те, що загальна чутливість тестування становить 75–95% [35, 36, 38–40, 44], є підстави очікувати хибнонегативних результатів, а тому може бути необхідним повторне тестування. На противагу, хибнопозитивні результати можуть призвести до непотрібної ізоляції, використання ЗІЗ і гуртування з іншими пацієнтами з позитивними результатами.
Не всі лікарні мають у доступі швидкі тести. Окрім того, в умовах обмежених ресурсів можлива необхідність пріоритизації симптоматичних пацієнтів.
Рекомендація 11: Комісія IDSA рекомендує проводити тестування РНК на SARS-CoV‑2 у імуноскомпрометованих безсимптомних осіб, які госпіталізуються, незалежно від контакту з інфікованими на COVID‑19 (сильна рекомендація, дуже низька достовірність доказів).
Зауваження:
- До імуносупресивних процедур відносять цитотоксичну хіміотерапію, трансплантацію органів або стовбурових клітин, тривалу біологічну терапію, клітинну імунотерапію або високі дози ГКС.
Рекомендація 12: Панель IDSA рекомендує тестувати РНК SARS-CoV‑2 у безсимптомних осіб перед проведенням імуносупресивних процедур незалежно від контакту з інфікованими на COVID‑19 (сильна рекомендація, дуже низька достовірність доказів).
Зауваження:
- Тестування в ідеалі слід проводити якомога ближче до запланованого лікування/процедури (наприклад, протягом 48–72 год).
- Ця рекомендація не стосується ризиків або стратегій боротьби з передачею SARS-CoV‑2 в амбулаторних умовах, таких як інфузійні центри.
Наявні докази підтверджують, що у безсимптомних або досимптомних пацієнтів вірусне навантаження та виділення вірусу таке саме, як і в пацієнтів з симптомами [62, 63].
Liang та співавт. [67] показали, що поширеність раку серед пацієнтів з COVID‑19 становила 1%, що було вище порівняно із загальною популяцією (0,2%). Yu та співавт. [21] показали, що поширеність COVID‑19 серед пацієнтів, яких госпіталізували для проведення променевої терапії або у відділення медичної онкології, становила 0,8%. Нарешті, систематичний огляд, проведений Desai та співавт. (2020) [68], показав, що загальна поширеність раку серед пацієнтів з COVID‑19 становила 2–3%. Загальна достовірність доказів щодо ефективності тестування у людей з ослабленим імунітетом була дуже низькою через надзвичайно обмежені дані в цій популяції.
Допустимий максимальний поріг було визначено як <2–5 пропущених випадків на 1 000 осіб. Проведення тестування залежно від того, у якому районі проживає особа, призвело б до збільшення кількості невстановленої інфекції та перевищення прийнятного порогу.
Існують повідомлення, що підтверджують спалахи респіраторних вірусів у госпіталізованих імуноскомпрометованих осіб [69]. Крім того, в цій популяції існує підвищений ризик тяжких наслідків респіраторних вірусних інфекцій [70]. Повідомляється про вищий рівень госпіталізації таких пацієнтів у відділення анестезіології та інтенсивної терапії (ВАІТ) з COVID‑19 (39% проти 8% серед хворих без онкопатології) [67]. Потенціал нозокоміальної передачі захворювання в стаціонарному відділенні серед пацієнтів високого ризику також може спричинити розвиток важкого захворювання з тяжкими наслідками.
Рекомендація 13: Рекомендовано проводити тестування на РНК SARS-COV‑2 у безсимптомних осіб (без відомого контакту з хворими на COVID‑19), які підлягають плановому час-залежному оперативному втручаннюя (умовна рекомендація, дуже низька достовірність доказів).
Зауваження:
- Час-залежними оперативними втручаннями вважають медично необхідні операції, які повинні бути проведені впродовж 3 міс.
- Тестування в ідеалі слід проводити якомога ближче до запланованої операції (наприклад, протягом 48–72 год).
- Слід розглянути можливість відстрочення операції для пацієнтів, які мають позитивний аналіз на SARS-CoV‑2.
- Рішення про використання ЗІЗ при проведенні АГП можуть залежати від результатів тестування, коли обмежена доступність ЗІЗ. Однак існує ризик хибнонегативних результатів тестів, тому ті, хто тісно контактуватиме з верхніми дихальними шляхами пацієнта (наприклад, анестезіологічні та ЛОР-процедури), повинні бути обережними.
- Рішення про тестування безсимптомних пацієнтів залежатиме від наявності ресурсів для проведення тестування.
- Ця рекомендація не стосується необхідності повторного тестування, якщо пацієнтам потрібні численні операції впродовж певного часу.
Рекомендація 14: IDSA не рекомендує проведення тестування для виявлення РНК SARS-CoV‑2 у безсимптомних осіб без відомих контактів з хворими на COVID‑19, які отримують АГП (наприклад, бронхоскопію), коли ЗІЗ доступні (умовна рекомендація, дуже низька достовірність доказів).
Рекомендація 15: Пропонується проводити тестування на РНК SARS-CoV‑2 у безсимптомних осіб без відомих контактів з хворими на COVID‑19, які отримують час-залежні АГП (наприклад, бронхоскопію), коли ЗІЗ обмежені, але тестування доступне (умовна рекомендація, дуже низька точність доказів).
Важливо визначити вірогідність захворювання або його поширеність серед безсимптомних пацієнтів, яким проводитиметься операція. Дослідження, в яких оцінювали поширеність COVID‑19 серед безсимптомних осіб, продемонстрували, що поширеність захворювання становила від <1 до 10% на основі оцінки частоти зараження серед безсимптомних осіб у загальній популяції у ділянках з низькою поширеністю захворювання та районах з високою поширеністю захворювання [8, 20, 21].
Рекомендація грунтувалася на важливості запобігання зараженню медичних працівників під час великих операцій, враховуючи тривалість втручання та утворення аерозолю під час операції. Крім того, наявні обмежені дані, що у SARS-CoV‑2-позитивних пацієнтів, яким проводилось серйозне хірургічне втручання, що потребувало інтубації, гірший прогноз [71].
Медпрацівники, які зазнають ризику під час проведення оперативного втручання, повинні завжди використовувати ЗІЗ, незалежно від результатів тестування. Це особливо актуально при втручаннях на дихальних шляхах пацієнта.
Реферативний огляд статті
«Infectious Diseases Society of America
Guidelines on the Treatment and Management of Patients with COVID‑19», last update 25.06.2020,
підготувала Христина Ключківська.
Повну версію дивіться на сайті:
https://www.idsociety.org/practice-guideline
Клінічна імунологія. Алергологія. Інфектологія. № 5 (126) 2020