Аванафіл: сучасне та ефективне лікування еректильної дисфункції
Еректильна дисфункція (ЕД) є поширеним захворюванням чоловічої репродуктивної системи, яке впливає на якість життя пацієнтів та їхніх сексуальних партнерів. ЕД розглядають як соціально-психолого-фізіологічний розлад зі складною етіологією. З огляду на високий профіль безпеки, добру переносимість і зручність застосування, пероральні інгібітори фосфодіестерази 5‑го типу (ФДЕ‑5) є препаратами першої лінії для лікування ЕД.
Однак побічні явища, специфічні для представників першого покоління інгібіторів ФДЕ‑5, а також необхідність очікування настання бажаного ефекту після їх прийому мінімум 30-45 хвилин часто змушує чоловіків припиняти терапію. Аванафіл, інгібітор ФДЕ‑5 нового покоління, має унікальні фармакологічні властивості, які сприяють мінімізації побічних ефектів і забезпечують швидкий початок дії та кращий комплаєнс.
Ключові слова: еректильна дисфункція, інгібітори фосфодіестерази 5‑го типу, селективність, Міжнародний індекс еректильної функції, аванафіл.
Порушення еректильної функції: проблема, яка не зважає на вік
ЕД визначається як стійка нездатність досягати та підтримувати ерекцію, достатню для здійснення задовільного статевого акту [1]. ЕД є поширеною чоловічою проблемою в будь-якому віці, яка має великий вплив на якість життя хворих та їхніх партнерів. Повідомляється, що понад 150 млн чоловіків у всьому світі страждають від ЕД різного ступеня [2]. У США захворюваність на ЕД становить 25,9 випадку на 1000 осіб і зростає з віком, досягаючи 70% серед чоловіків старше 70 років.
Притому що похилий вік залишається одним із найважливіших немодифікованих факторів ризику ЕД [3], поширеність патології серед молодих чоловіків також має тенденцію до збільшення останнім часом. Так, за даними багатоцентрового дослідження Rosen et al. (2004), у якому взяли участь понад 27 тис. чоловіків із восьми країн світу, кожен п’ятий учасник віком від 20 до 40 років повідомляв про симптоми ЕД [4]. Епідеміологічна картина ЕД в європейських країнах значно варіюється залежно від методології, яка використовується для визначення дисфункції, популяції, збору даних і вибору інструментів для дослідження цього розладу: у середньому частота ЕД становить 10% серед чоловіків віком <40 років [5-7].
У дослідженні Capogrosso et al. (2013), проведеному в урологічній клініці Мілану (Італія), було виявлено, що кожен четвертий чоловік, який звернувся по медичну допомогу з приводу ЕД, не досяг 40 років [8]. Дані, зібрані в Австралії та США, свідчать про подібний діапазон поширеності ЕД серед молодих пацієнтів. Натомість у популяції чоловіків віком >40 років частка ЕД у структурі урологічних захворювань становила вже >52% (Feldman et al., 1994). Прогнозується, що до 2025 року 322 млн чоловіків у всьому світі матимуть ЕД [9-11].
Виникнення ЕД пов’язане з багатьма супутніми захворюваннями та факторами ризику, серед яких [12-14]:
•вживання алкоголю та куріння;
•ожиріння;
•зниження рівня андрогенів;
•серцево-судинні захворювання, у тому числі атеросклероз;
•неврологічна патологія, зокрема хвороба Альцгеймера, множинний склероз;
•травми статевого члена та хвороба Пейроні;
•депресія;
•ендокринні захворювання, такі як цукровий діабет (ЦД), гіпертиреоз, гіпотиреоз, гіпогонадизм, гіперпролактинемія;
•ураження спинного мозку;
•хірургічні втручання в ділянці таза, у тому числі на передміхуровій залозі;
•прийом лікарських засобів (гіпотензивних, антидепресантів, гормонів, транквілізаторів).
Нормальна ерекція статевого члена – це нервово-судинний феномен, який контролюється психологічними факторами й координується ендокринною, судинною та нервовою системами [15].
! Упродовж останніх десятиліть експерти кардинально переглянули погляди на етіологію ЕД. Було встановлено, що у 80% пацієнтів порушення ерекції зумовлене органічними змінами, що спричиняють розлади кровообігу та іннервації кавернозних органів статевого члена, а не психічними факторами, як вважалося раніше [16, 17].
Одночасно з усвідомленням органічної природи ЕД стався революційний прорив щодо її терапії.
Потенційні переваги інгібіторів ФДЕ‑5 у лікуванні еректильної дисфункції
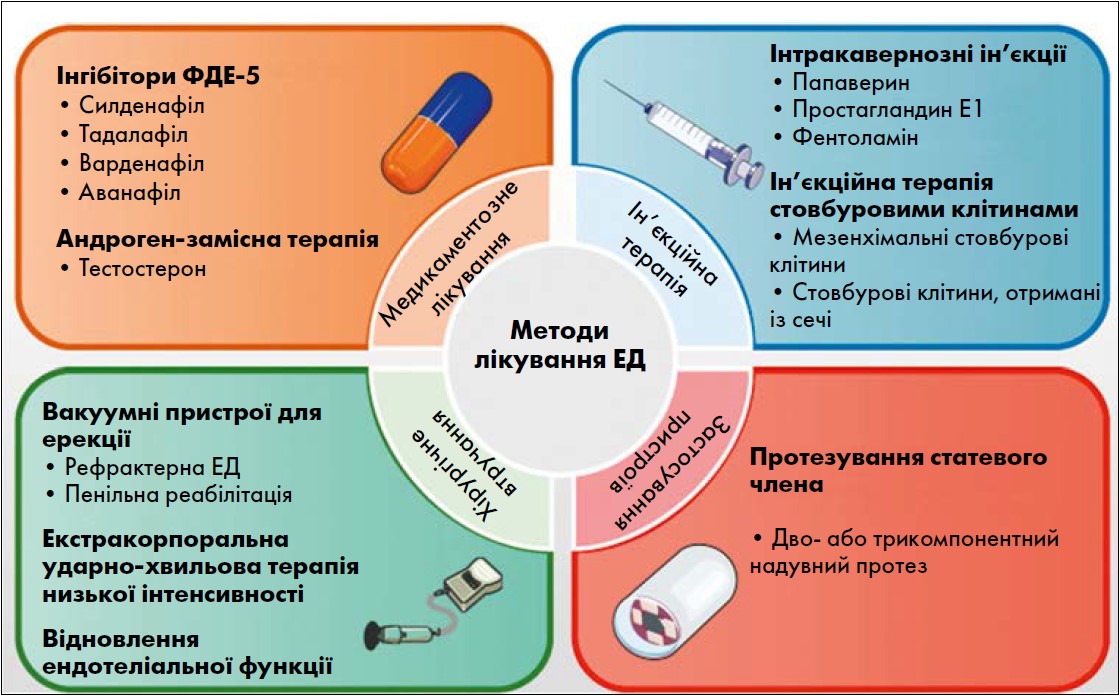
Сучасні підходи до лікування ЕД включають різні фармакологічні та інтервенційні методи, такі як прийом інгібіторів ФДЕ‑5, застосування вакуумних пристроїв для ерекції, інтракавернозні ін’єкції, протезування статевого члена, екстракорпоральна ударно-хвильова терапія низької інтенсивності (Li-ESWT) та ін’єкційна терапія стовбуровими клітинами [18] (рисунок). Однак завдяки клінічно доведеній ефективності, зручності застосування, а також сприятливому профілю безпеки, інгібітори ФДЕ‑5 були визнані першою лінією терапії ЕД [19-21].
Рис. Існуючі методи лікування ЕД (Wang C.M. et al., 2023)
ФДЕ‑5, яка експресується у гладких м’язах судин, є найпоширенішим підтипом ФДЕ у гладких м’язах статевого члена. Ерекція статевого члена переважно залежить від активації сигнального шляху NO/цГМФ (циклічний гуанозинмонофосфат), а функція ФДЕ‑5 полягає у блокуванні розкладання цГМФ [22, 23]. NO, що виробляється неадренергічними/нехолінергічними нейронами та ендотеліальними клітинами, виділяється в кавернозні тіла. Це спричиняє збільшення концентрації цГМФ, таким чином сприяючи розслабленню гладкої мускулатури в кавернозних тілах і розширенню кровоносних судин статевого члена, що зрештою призводить до наповнення судин та ерекції [24]. Таким чином, інгібітори ФДЕ‑5 здатні посилювати еректильну відповідь і купірувати ЕД шляхом потенціювання ефекту цГМФ, зумовленого дією NO.
Ефективність цієї групи препаратів складає до 80% у пацієнтів з ЕД, пов’язаною, у тому числі, із такими патологіями, як ЦД, артеріальна гіпертензія, серцево-судинні захворювання, неврологічні розлади, ниркова недостатність, а також внаслідок урологічних операцій на органах малого таза в анамнезі. Дієвість інгібіторів ФДЕ‑5 була доведена як при прийомі за потреби, так і при тривалому застосуванні [25].
Висока селективність і швидкість настання бажаного результату: основні відмінності першого та другого поколінь інгібіторів ФДЕ-5
Незважаючи на наявність ефективних методів лікування, лише незначна частка чоловіків із ЕД звертаються по допомогу, при цьому 60-70% тих, хто звернувся до лікаря, припиняють лікування з різних причин після 2-3 років спостереження [26]. Повідомлялося, що через 6-12 місяців спостереження силденафіл був повторно призначений лише у 30% випадків [27]. Ці дані свідчать про те, що припинення прийому препарату не завжди зумовлене його неефективністю. Однак прихильність до терапії є основним фактором її успіху. Невідповідність очікуванням пацієнта щодо швидкості настання бажаного ефекту може спонукати до припинення терапії інгібіторами ФДЕ‑5. Коморбідність і побічні ефекти, пов’язані з пригніченням інших ФДЕ- або не-ФДЕ-мішеней, також є одним із частих факторів відмови від лікування. Супутні патології, зокрема серцево-судинні захворювання та ЦД, часто пов’язані із психічними та поведінковими розладами, які, у свою чергу, можуть призводити до зниження лібідо та неспроможності до статевого акту, зменшуючи тим самим у чоловіків бажання продовжувати терапію.
Виникнення побічних ефектів зумовлено насамперед ступенем селективності інгібітора ФДЕ‑5 [28]. Хоча силденафіл, варденафіл і тадалафіл були першими інгібіторами ФДЕ‑5, затвердженими Управлінням із санітарного контролю за якістю харчових продуктів і медикаментів США (FDA) для лікування ЕД, побічні явища (головний біль, припливи, диспепсія, розлади зору, біль у спині, тахікардія та закладеність носа), пов’язані з неселективним інгібуванням інших ізоферментів ФДЕ в організмі, а також відсутність клінічної реакції на терапію у певних груп пацієнтів спонукали вчених та експертів з усього світу до пошуку й створення нового покоління інгібіторів ФДЕ‑5 для досягнення максимальної ефективності та мінімізації побічних ефектів [29, 30].
Аванафіл являє собою високоселективний інгібітор ФДЕ‑5 з унікальною хімічною структурою та фармакологічними властивостями.
! Найважливішою перевагою аванафілу над препаратами першого покоління є його висока селективність щодо ФДЕ‑5 й особливо щодо ФДЕ‑6, ФДЕ‑1 і ФДЕ‑11 [31]. Ця характеристика дозволяє мінімізувати фармакодинамічний вплив аванафілу на інші підтипи ФДЕ, зменшуючи тим самим ризик побічних явищ.
Основні фармакокінетичні відмінності інгібіторів ФДЕ‑5 включають початок, тривалість дії та профіль побічних ефектів. Аванафіл має найшвидший початок дії (15-30 хв) серед інших представників цієї групи (порівняно із силденафілом та варденафілом [30-60 хв], а також тадалафілом [60-120 хв]). Аванафіл досягає максимальної концентрації у плазмі крові (Tmax) через 35 хв і має кінцевий період напіввиведення (T1/2) 3-5 год [32]. Цей фармакокінетичний профіль забезпечує швидкий початок дії, завдяки чому у 72% випадків спроби статевого акту протягом 15 хв після застосування препарату були успішними [33]. Одночасний прийом їжі не впливає на всмоктування аванафілу [32], на відміну від силденафілу і варденафілу, ефективність яких знижується при споживанні їжі з високим вмістом жирів [34]. Метаболізм препарату відбувається в печінці, а жовч є основним шляхом виведення аванафілу та його метаболітів. Дослідження показали, що прийом препарату 1-2 рази на день не викликає значного накопичення діючої речовини в організмі [33].
Результати дослідження in vitro, у якому інгібуючу дію аванафілу на 11 ізоферментів ФДЕ порівнювали з дією силденафілу, варденафілу та тадалафілу, свідчили, що аванафіл значно пригнічує ФДЕ‑5 (інгібуюча концентрація IC50=5,2 нМ) у конкурентному та дозозалежному режимі [32].
Аванафіл продемонстрував високу (>1000‑кратну) селективність щодо всіх ізоферментів із нижчим рівнем інгібування ФДЕ‑1 (>10 000 разів), ФДЕ‑6 (120 разів) і ФДЕ‑11 (>10 000 разів), які присутні у тканинах серця, сітківці ока та яєчках відповідно, порівняно із силденафілом [33].
! Завдяки високій селективності та низькій перехресній реактивності аванафілу його прийом значно рідше асоціюється з такими небажаними явищами, як розлади зору, гемодинамічні зміни та порушення опорно-рухового апарату, які часто спостерігаються при застосуванні інших інгібіторів ФДЕ‑5 [35].
До поширених побічних ефектів, які можуть спричиняти всі інгібітори ФДЕ‑5, належать: головний біль (10-16%), припливи (5-12%), диспепсія (4-12%), закладеність носа (1-10%) і запаморочення (2-3%) [30]. У ході клінічних випробувань найбільш часто задокументовані небажані реакції, пов’язані з прийомом аванафілу, включали біль у спині, закладеність носа, головний біль, припливи та назофарингіт, які спостерігалися у близько 2% пацієнтів. Натомість під час терапії аванафілом жодного разу не повідомлялося про такі побічні ефекти, як діарея, порушення зору та дальтонізм, які є специфічними для силденафілу та варденафілу [36].
За даними електроретинограми, аванафіл не порушує функцію сітківки, на відміну від силденафілу, застосування якого призводить до затримки піку позитивної хвилі електроретинограми [37]. Цей ефект можна пояснити посиленим інгібуванням ФДЕ‑6 силденафілом, що сповільнює фототрансдукцію в сітківці. Оскільки еректогенна функція при застосуванні аванафілу не знижується під час прийому їжі, пацієнтам не потрібно турбуватися про режим перорального прийому. Незважаючи на існуючі застереження щодо застосування інгібіторів ФДЕ‑5 разом із нітратами, було встановлено, що, порівняно із силденафілом, аванафіл значно меншою мірою посилює спричинену нітрогліцерином гіпотензію, із меншими змінами систолічного артеріального тиску та частоти серцевих скорочень [32]. Це відкриває можливість призначення аванафілу пацієнтам, яким показаний нітрогліцерин для лікування ішемічної хвороби серця [38].
Унікальні фармакологічні властивості аванафілу: коли час вирішує все
Аванафіл має швидкий початок дії (уже через 15 хв), час досягнення Tmax становить 30-45 хв, а кінцевий T1/2 складає 3-5 год. Аванафіл схвалений до використання у США (із 2012 року), Європейському Союзі (із 2013 року) та в інших країнах світу, зокрема у Південній Кореї, Австралії, Новій Зеландії, РФ, Йорданії, ОАЕ, Туреччині та Саудівській Аравії, ґрунтуючись на ефективності та сприятливому профілі безпеки, підтвердженому в ряді подвійних сліпих плацебо-контрольованих рандомізованих клінічних досліджень, проведених як у загальній популяції, так й у «важких» для лікування підгрупах пацієнтів, зокрема хворих на ЦД або тих, кому було проведено радикальну нервозберігаючу простатектомію [32, 39-42].
За результатами дослідження I фази, середній Tmax аванафілу становив 20-31 хв, що свідчить про швидке всмоктування зі шлунково-кишкового тракту. Показник T1/2 варіювався між 5,36 та 10,66 год [32]. Важливо зазначити, що аванафіл не накопичувався значною мірою у плазмі пацієнтів після 7 днів прийому найвищої добової дози (200 мг), що свідчить про високий профіль безпеки.
Завдяки унікальним фармакокінетичним властивостям препарату пацієнтам вдається досягати ерекції в найкоротший проміжок часу після прийому.
У багатоцентровому рандомізованому перехресному дослідженні ІІ фази оцінювали ефективність і швидкість початку дії аванафілу порівняно із силденафілом і плацебо в пацієнтів віком 35-70 років зі скаргами на ЕД від легкого до помірного ступеня, що турбували більше 6 міс [43]. Під час кожного прийому пацієнти отримували візуальну сексуальну стимуляцію (VSS) для спостереження протягом окремих 20‑хвилинних періодів, починаючи за 20 хв до прийому препаратів/плацебо та закінчуючи через 120 хв після прийому. Еректильну функцію оцінювали шляхом вимірювання твердості статевого члена за допомогою апарата RigiScan.
Пікова відповідь на аванафіл спостерігалася в ранньому інтервалі (20-40 хв після прийому) в усіх чоловіків при різних дозах (50, 100 та 200 мг). Час від початку VSS до досягнення ≥60% твердості статевого члена протягом раннього інтервалу був значно коротшим при застосуванні аванафілу 100 мг і 200 мг порівняно із плацебо та силденафілом. Аванафіл також перевершив силденафіл і плацебо за показниками еректильної функції, визначеними за допомогою апарата RigiScan. Усі зареєстровані побічні ефекти у пацієнтів, які отримували аванафіл, були легкими та подібними до тих, що спостерігаються при застосуванні інших інгібіторів ФДЕ‑5 (окрім порушення зору, про яке повідомили пацієнти із групи силденафілу й яке не спостерігалося ані в групі аванафілу, ані в групі плацебо).
У рандомізованому контрольованому подвійному сліпому клінічному дослідженні Kumar et al. (2022) 220 пацієнтів з ЕД, які були розподілені на дві групи (1:1), отримували низькі дози аванафілу 100 мг або силденафілу 50 мг для ініціації терапії. Через 4 тижні лікування, якщо виникала необхідність у підвищенні дози, учасники дослідження приймали таблетки аванафілу 200 мг або силденафілу 100 мг. Ефективність досліджуваних препаратів оцінювали за даними опитувальника Міжнародного індексу еректильної функції (IIEF), який заповнювався пацієнтами під час кожного візиту до лікаря, ґрунтуючись на їхньому сексуальному досвіді протягом останніх 4 тижнів. Чоловіки також відповідали на три запитання для оцінки профілю сексуальних контактів (SEP1, SEP2 та SEP3) після прийому кожної дози препарату та кожної спроби статевого акту. У ході дослідження аванафіл продемонстрував значно швидший початок дії та вищу частоту задовільної ерекції вже протягом 15 хв після прийому [25].
Клінічний досвід застосування аванафілу: дані міжнародних досліджень
За повідомленнями дослідників, потужний і високоселективний інгібітор ФДЕ‑5 аванафіл має кращий клінічний ефект із нижчою частотою побічних реакцій порівняно з інгібіторами першого покоління [20]. Усі рандомізовані контрольовані дослідження, які увійшли до метааналізу Warli et al. (2023), продемонстрували, що аванафіл у дозах 100 і 200 мг був однаково ефективним у покращенні модифікованої оцінки SEP‑2 (Чи вдалося досягти проникнення в піхву партнерші?) і SEP‑3 (Чи достатньо довго тривала ерекція для успішного статевого акту?) у пацієнтів з ЕД [44]. Ці висновки узгоджуються з результатами дослідження Goldstein et al. (2012) та метааналізу Li et al. (2019), які не виявили статистично значущих відмінностей у SEP‑2 між двома дозами препарату [40, 45], а також метааналізу Zhao et al. (2012), у якому повідомлялося про подібну оцінку SEP‑3 при прийомі 100 і 200 мг аванафілу [46].
Kumar et al. (2022) доповіли, що результати оцінки за IIEF-EF були значно кращими у групі прийому аванафілу порівняно із групою силденафілу [25]. Крім того, середній відсоток успішних вагінальних проникнень і задовільного статевого акту суттєво збільшився у групі аванафілу порівняно з групою силденафілу наприкінці 8‑го та 12‑го тижнів спостереження (р<0,05).
! Автори зазначали, що аванафіл добре переносився усіма учасниками дослідження. При цьому жодний із побічних ефектів, які виникли впродовж періоду спостереження, не вимагав зміни дозування або припинення терапії.
Belkoff et al. (2013) проводили 52‑тижневу оцінку ефективності та безпечності аванафілу у 712 пацієнтів із ЕД від легкого до тяжкого ступеня з/без супутнього ЦД [42]. Початкова доза препарату становила 100 мг, однак за запитом п ацієнтам було дозволено збільшити дозу до 200 мг для підвищення ефективності або зменшити до 50 мг для покращення переносимості. У ході дослідження близько 66% пацієнтів мали клінічну відповідь на терапію аванафілом у дозі 100 мг, натомість близько 65% із тих, хто підвищив дозу до 200 мг, підтвердили ефективність останньої. Примітно, що лише троє (0,4%) чоловіків попросили знизити дозу аванафілу до 50 мг, що підтверджує хороший профіль безпеки препарату.
За даними Corona et al. (2016), аванафіл 100 і 200 мг значно перевершив плацебо за частотою успішного статевого акту (SEP‑3) [47]. Регресійний метааналіз показав, що цей ефект не залежав від тяжкості та тривалості ЕД і зберігався при врахуванні індексу маси тіла та наявності ЦД і артеріальної гіпертензії. Подібні результати спостерігалися під час аналізу даних SEP‑2. Крім того, було встановлено, що прийом аванафілу в дозі як 100 мг, так і 200 мг асоціювався зі значно вищим балом домену еректильної функції IIEF порівняно з плацебо (IIEF-EFD=3,92 [2,68; 5,15] та 4,92 [3,66; 6,19] відповідно, р<0,0001). Різниці між аванафілом 100 мг і 200 мг і плацебо щодо частоти серйозних побічних ефектів не спостерігалося (відносний ризик – 1,99 [0,67; 5,93] і 1,70 [0,54; 5,31] відповідно, p=дані не значущі). Частота припинення лікування через побічні ефекти була однаковою у групі як аванафілу (100 та 200 мг), так і плацебо. Крім того, коли досліджувалися специфічні побічні ефекти, застосування аванафілу асоціювалося з підвищеним ризиком припливів і головного болю, однак не спостерігалося істотної різниці щодо закладеності носа та болю в спині порівняно із плацебо.
Отримані результати свідчать про те, що аванафіл є ефективним і безпечним засобом лікування ЕД. Клінічне покращення спостерігалося за всіма розглянутими показниками ефективності, включаючи оцінку SEP‑3, SEP‑2 і IIEF-ED. Крім того, прийом аванафілу супроводжувався трикратним підвищенням імовірності нормалізації еректильної функції порівняно з плацебо. Вплив аванафілу на SEP‑3 не залежав від тяжкості й тривалості ЕД та супутніх захворювань. Враховуючи фармакокінетичний профіль препарату, зокрема швидкий початок дії, застосування аванафілу було пов’язане з чотирикратним підвищенням ймовірності успішного статевого акту вже протягом 15 хв після прийому. Автори метааналізу дійшли висновку, що прийом аванафілу не корелює з підвищеним ризиком серйозних побічних ефектів. Повідомляється про відсутність ризику припинення терапії аванафілом через побічні ефекти, асоційовані з прийомом препарату, що підтверджує сприятливий профіль безпеки та добру переносимість.
Перспективи щодо безрецептурного призначення аванафілу
Після схвального рішення FDA аванафіл може стати першим інгібітором ФДЕ‑5, який буде відпускатися без рецепта. За повідомленням Petros Pharmaceuticals, цьогоріч відбулося успішне завершення ІІ фази еквівалентного дослідження самостійного вибору (Self-Selection Study, SSS) у початковій когорті [48]. Це відкрите дослідження у двох групах було розроблено для оцінки здатності учасника здійснити правильний вибір препарату лише за допомогою інформації на етикетці лікарського засобу (Drug Facts Label – DFL) (група 1) порівняно із DFL та допоміжним застосунком (група 2). За результатами дослідження, аванафіл правильно обрали понад 78% учасників, які користувалися застосунком, порівняно з 56% із тих, хто робив вибір, орієнтуючись лише на дані з етикетки. Отримані результати були подані до FDA для перевірки з наміром продовжити обговорення щодо затвердження першого безрецептурного інгібітора ФДЕ‑5. До кінця 2024 року очікуються результати дослідження самостійного вибору за участю великої когорти з використанням лише інформації з DFL.
Процес заміни ліків, що відпускаються за рецептом, на безрецептурні спочатку передбачає створення дизайну етикетки з інформацією про лікарський засіб (DFL), який добре зрозумілий для потенційних споживачів. Останні мають прийняти відповідне рішення щодо використання чи невикористання засобу, враховуючи лише DFL та свою історію хвороби. Перед затвердженням безрецептурного продажу споживачі мають продемонструвати, що вони можуть правильно обирати засіб з урахуванням DFL. Для підтвердження цього FDA вимагає перевірку, а саме проведення ітераційних досліджень розуміння етикетки (LCS) у загальній популяції, досліджень самостійного вибору в популяції, зацікавленій у використанні продукту, і в конкретних групах, яким може бути завдано шкоди, якщо вони будуть приймати лікарський засіб, і зазвичай одне випробування фактичного використання (AUT), яке демонструє безпечне та належне застосування засобу споживачами в імітованих безрецептурних умовах. Наразі FDA запроваджує критерії Додаткових умов для безрецептурного використання (ACNU), що дозволить розширити безрецептурний доступ до ліків, які раніше можна було отримати лише за рецептом [49].
Клінічно доведена ефективність, добра переносимість і високий профіль безпеки аванафілу, у тому числі в пацієнтів із коморбідністю, стали передумовами для розширення використання препарату в популяції.
На фармацевтичному ринку України аванафіл представлений препаратом Аваналав (АТ «Київський вітамінний
завод»), який зарекомендував себе як ефективний високоселективний лікарський засіб для лікування ЕД із високим профілем безпеки та унікальними фармакокінетичними властивостями, що забезпечують швидкий початок дії. Рекомендована доза становить 100 мг, яку приймають за потреби приблизно за 15-30 хв до сексуальної активності. Враховуючи клінічну відповідь пацієнта та індивідуальну переносимість, дозу можна підвищити до максимальної – 200 мг або знизити до 50 мг.
Список літератури знаходиться в редакції.
Підготувала Дарина Чернікова
Тематичний номер «Урологія. Нефрологія. Андрологія» № 2 (33), 2024 р.
СТАТТІ ЗА ТЕМОЮ Урологія та андрологія
Карбапенем-резистентні Enterobacteriaceae (carbapenem-resistant Enterobacteriaceae, CRE) становлять значну загрозу для здоров’я людини, а інфекції, спричинені CRE, є тягарем для системи охорони здоров’я в цілому. Метою цього дослідження було порівняння ефективності та безпеки застосування цефтазидиму/авібактаму (CAZ-AVI) та поліміксину в лікуванні інфекцій, зумовлених CRE. У хворих, які отримували CAZ-AVI, відмічена значно нижча 30-денна смертність, вищий клінічний коефіцієнт виліковування та більший рівень мікробної елімінації порівняно з терапією поліміксинами. Рівень смертності серед пацієнтів з інфекцією кровотоку, якім призначали CAZ-AVI, був значно нижчим порівняно з тими, хто отримував терапію поліміксином. Результати дослідження свідчать про те, що CAZ-AVI може бути кращим варіантом для лікування інфекцій CRE порівняно з поліміксином завдяки вищій клінічній ефективності...
У статті описано варіанти малоінвазивної простатектомії — лапароскопічної та робот-асистованої, які виконують у хворих на доброякісну гіперплазію передміхурової залози (ДГПЗ) великого об’єму (понад 80 мл). Розглянуто показання, техніку виконання й результати лапароскопічної та робот-асистованої простатектомії на основі досвіду українських спеціалістів...
Проблема доброякісної гіперплазії передміхурової залози (ДГПЗ) не втрачає своєї актуальності. Існує припущення, що в дійсності на ДГПЗ страждає не одна сотня мільйонів чоловіків у світі. При цьому статистичні дані в різних регіонах планети значно різняться, не надаючи об’єктивної епідеміологічної статистики. Визначення ролі запалення в розвитку ДГПЗ вважається перспективним напрямком розуміння її патогенезу, гістологічного та клінічного прогресування і вказує на нові стратегії лікування. Останні, з огляду на доведені протизапальні й антипроліферативні властивості, передбачають використання екстракту Serenoa repens (Sr) як монотерапії при легких ступенях ДГПЗ та у складі комбінованої терапії (α1‑адреноблокатори, інгібітори фосфодіестерази 5‑го типу) при середньо-тяжкому ступені...
Восени минулого року відбувся 7‑й Глобальний саміт із прецизійної діагностики та лікування раку передміхурової залози. У рамках заходу професор кафедри урології Університету Генріха Гейне в Дюссельдорфі, керівник відділу персоналізованої ранньої діагностики раку передміхурової залози Німецького центру дослідження раку (DKFZ) Пітер Альберс від імені дослідників PROBASE у м. Гейдельберзі представив доповідь щодо оновленої інформації по дослідженню «Вихідний рівень ПСА у молодих чоловіків (віком 45 та 50 років)»...