Нове глобальне визначення гострого респіраторного дистрес-синдрому
У результаті консенсусної конференції за участю 32 експертів з інтенсивної терапії гострого респіраторного дистрес-синдрому (ГРДС), а також спільної роботи членів кількох товариств із реаніматології було сформульовано нове глобальне визначення ГРДС, яке включає певні критерії ідентифікації пацієнтів із цим синдромом, методи швидкої діагностики розладу, у тому числі в медичних закладах з обмеженими ресурсами, а також особливості проведення високопотокової назальної оксигенотерапії (HFNO) та неінвазивної вентиляції легень (NIV) у пацієнтів із ГРДС.
Ключові слова: гострий респіраторний дистрес-синдром, гостре ураження легень, набряк легень.
ГРДС – це клінічний синдром гострої гіпоксемічної дихальної недостатності (ДН), який настає внаслідок запалення легень, не спричиненого кардіогенним набряком легень. ГРДС уперше був описаний у 1967 році [1], натомість у 1988 році з’явилося більш чітке клінічне визначення, яке дало можливість кількісної оцінки тяжкості фізіологічного порушення дихання (оцінка травми легень) [2]. Відтоді клінічне визначення ГРДС було переглянуто, спочатку під час Американсько-європейської консенсусної конференції, скликаної в 1992 році Американським торакальним товариством (ATS) і Європейським товариством інтенсивної терапії (ESICM) [3], а пізніше – робочою групою з визначення ГРДС, скликаною ESICM у Берліні в 2012 році [4, 5].
Упродовж десятиліття після публікації Берлінського визначення виникло декілька подій, пов’язаних із лікуванням та вивченням ГРДС, які спонукали експертів до розгляду нового, розширеного, Берлінського визначення синдрому [6]. По-перше, неінвазивні пульсоксиметричні методи для оцінки критеріїв оксигенації при ГРДС були валідовані та застосовані у спостережних дослідженнях і клінічних випробуваннях [7-11]. По-друге, використання HFNO для лікування тяжкої гіпоксемічної ДН суттєво зросло після публікації дослідження FLORALI (Клінічний ефект асоціації NIV і HFNO під час реанімації пацієнтів із гострим ураженням легень) у 2015 [12]. Крім того, застосування HFNO набуло значної поширеності під час пандемії COVID‑19 [13-15]. Виявилося, що пацієнти із гострою гіпоксемічною ДН, які отримують HFNO, не відповідають Берлінському визначенню ГРДС, яке вимагає інвазивної або неінвазивної штучної вентиляції легень (ШВЛ) із мінімум 5 см H2O позитивного тиску наприкінці видиху (PEEP) [5, 16, 17]. По-третє, використання Берлінського визначення є проблематичним в умовах обмежених ресурсів, оскільки в закладах охорони здоров’я не завжди доступні рентгенографія грудної клітки (ГК), газометрія артеріальної крові та ШВЛ. Це стало причиною створення модифікації Берлінського визначення для медичних закладів з обмеженими ресурсами, запропонованої Кігалі [18]. Однак ця модифікація не була офіційно включена до сучасного визначення ГРДС. Нарешті, ультразвукове дослідження (УЗД) все частіше використовується у тяжкохворих пацієнтів із гострою гіпоксемічною ДН, іноді замінюючи традиційну рентгенографію ГК [19-21].
З метою детального розгляду вищезазначених змін у доказах і практиці у червні 2021 року було скликано глобальну консенсусну конференцію з широким міжнародним представництвом та досвідчених експертів галузі для надання рекомендацій щодо оновлення визначення ГРДС. Щойно було досягнуто консенсусу щодо розширеного глобального визначення ГРДС, експертна група надала можливість клініцистам, дослідникам і представникам суміжних медичних спеціальностей з усього світу зробити свій внесок в оновлення дефініції. Цей звіт містить рекомендації, прийняті під час консенсусної конференції, а також визначає пріоритети для подальших досліджень із метою оцінки впровадження оновлених критеріїв ГРДС, їх надійності та прогностичної валідності.
Результати
Глобальна дефініція ГРДС представлена в табл. 1. Резюме оновленого Берлінського визначення наведено в табл. 2. Рисунок ілюструє більшість елементів розширеної глобальної дефініції ГРДС і порівняння його з Берлінським визначенням. Консенсусні рекомендації для кожної категорії разом із обґрунтуванням і коментарями наведені нижче.
|
Таблиця 1. Діагностичні критерії нового глобального визначення ГРДС |
|||
|
Критерії, які застосовуються до всіх категорій ГРДС |
|||
|
Фактори ризику та походження набряку |
Спровокований гострим фактором ризику, таким як пневмонія, нелегенева інфекція, травма, гемотрансфузія, аспірація або шок. Набряк легень не пов’язаний виключно або головним чином із кардіогенним набряком легень/перевантаженням рідиною, а гіпоксемія/порушення газообміну не асоційовані головним чином з ателектазом. Однак ГРДС можна діагностувати за наявності цих станів, якщо також присутній фактор ризику ГРДС |
||
|
Терміни |
Гострий початок або погіршення гіпоксемічної ДН протягом одного тижня після передбачуваної появи фактора ризику або появи нових чи погіршення наявних респіраторних симптомів |
||
|
Візуалізація ГК |
Двосторонні помутніння на рентгенографії ГК та КТ або двосторонні лінії B і/або консолідації на УЗД*, що не повністю визначається випотом, ателектазом чи вузлами (<3 см у діаметрі)/утвореннями (>3 см у діаметрі) |
||
|
Критерії, які застосовуються до певних категорій ГРДС |
|||
|
|
Неінтубований ГРДС† |
Інтубований ГРДС |
Модифіковане визначення |
|
Оксигенація§ |
PaO2/FіO2 ≤300 мм рт. ст. або SpO2/FіO2 ≤315 (якщо SpO2 ≤97%) на HFNO з потоком ≥30 л/хв або NIV/CPAP із щонайменше 5 см H2O наприкінці видиху |
Легкий¶: 200 < PaO2/FіO2 ≤300 мм рт. ст. †Помірний: 100 < PaO2/FіO2 ≤200 мм рт. ст. або 148< SpO2/FіO2 ≤235 (якщо SpO2 ≤97%) Тяжкий: PaO2/FіO2 ≤100 мм рт. ст. або SpO2/FіO2 ≤148 (якщо SpO2 ≤97%) |
SpO2/FіO2 ≤315 (якщо SpO2 ≤97%)†. Для діагностики в умовах обмежених ресурсів не потрібні ані PEEP, ані мінімальна швидкість потоку кисню. |
|
Примітки: CPAP – постійний позитивний тиск у дихальних шляхах; HFNO – високопотокова назальна оксигенотерапія; NIV – неінвазивна вентиляція легень; PEEP – позитивний тиск наприкінці видиху; SpO2 – сатурація, виміряна за допомогою пульсоксиметрії. * Оператор УЗД має добре володіти навичками використання ультразвуку для виявлення ознак двосторонньої втрати аерації легень (наприклад, численні лінії B і/або консолідації) та інших ультразвукових ознак, які вказують на некардіогенний набряк легень (наприклад, аномалії плевральної лінії). † Розрахунковий FiO2 = вміст кисню у видихуваному повітрі (FiO2) (наприклад, 0,21) + 0,03 Ч швидкість потоку O2 (л/хв). ‡ Модифіковані критерії оксигенації можуть бути застосовані в медичних закладах, де газометрія артеріальної крові й/або HFNO, NIV та ШВЛ недоступні. § Аналіз газового складу крові та оксиметрію слід проводити, коли пацієнт перебуває у стані спокою та щонайменше через 30 хв після зміни положення, FіO2 або швидкості потоку. Перед проведенням пульсоксиметрії слід переконатися у відповідній формі сигналу та правильному розташуванні оксиметра. Показник SpO2/FіO2 недійсний при сатурації >97%. Пульсоксиметрія не рекомендована для діагностики, якщо є підозра на аномалію гемоглобіну (наприклад, метгемоглобінемія або карбоксигемоглобінемія). || Якщо висота над рівнем моря становить >1000 м, застосуйте наступний коригуючий коефіцієнт: (PaO2 або SpO2)/FіO2 Ч (барометричний тиск/760). ¶ Для всіх категорій тяжкості інтубованого ГРДС необхідний мінімальний PEEP складає 5 см H2O. Пацієнти можуть переходити з однієї категорії в іншу залежно від перебігу захворювання. |
|||
|
Таблиця 2. Резюме ключових відмінностей між новим глобальним визначенням ГРДС і Берлінським визначенням, включно з обґрунтуванням оновлених діагностичних критеріїв |
||
|
Берлінське визначення |
Обґрунтування |
Як це розглядається в глобальному визначенні |
|
Гострий початок протягом одного тижня після відомого патологічного стану (фактора ризику) або появи нових чи погіршення респіраторних симптомів |
Початок може бути більш млявим у випадку певних захворювань, наприклад COVID‑19 |
Включення пацієнтів із HFNO охоплюватиме пацієнтів із більш млявим перебігом, тому терміни виникнення ГРДС не були змінені |
|
Двосторонні помутніння на рентгенографії ОГК або КТ, які не повністю пояснюються випотом, колапсом частки/легені або вузлами |
Рентгенографія ГК та КТ недоступні в деяких медичних закладах |
УЗД можна використовувати для виявлення двосторонньої втрати аерації легеневої тканини (множинні лінії B і/або консолідації), якщо оператор володіє достатніми навичками інтерпретації результатів УЗД |
|
Три категорії тяжкості, визначені за |
Пульсоксиметричне вимірювання |
SpO2/FіO2 може використовуватися для діагностики та оцінки тяжкості, якщо SpO2 ≤97% |
|
PEEP ≥5 см H2O є вимогою до інвазивної або неінвазивної ШВЛ, необхідною для всіх категорій тяжкості ГРДС. Цій вимозі також відповідає CPAP ≥5 см H2O |
HFNO все частіше використовується у пацієнтів із тяжкою гіпоксемією, які відповідають критеріям ГРДС. Інвазивна та неінвазивна ШВЛ недоступна в медичних закладах з обмеженими ресурсами |
Нова категорія неінтубованого ГРДС, створена для пацієнтів на HFNO ≥30 л/хв, які відповідають критеріям ГРДС. Модифіковане визначення ГРДС для закладів охорони здоров’я з обмеженими ресурсами не вимагає PaO2/FiO2, PEEP або HFNO |
|
Примітки: ГРДС – гострий респіраторний дистрес-синдром; COVID‑19 – коронавірусна хвороба; CPAP – постійний позитивний тиск у дихальних шляхах; |
||
Концептуальна модель
Члени комітету дійшли згоди в тому, що концептуальна модель, викладена в Берлінському визначенні, із незначними змінами продовжує відображати сучасне розуміння та патофізіологію ГРДС (табл. 1).
ГРДС – це гостре дифузне запальне ураження легень, спричинене такими факторами ризику, як пневмонія, нелегенева інфекція, травма, трансфузія, опік, аспірація або шок. Отримане ураження призводить до набряку легень через збільшення проникності легеневих судин і альвеолярного епітелію. Крім того, гравітаційний ателектаз сприяє втраті аерованої легеневої тканини. Клінічними ознаками ГРДС є артеріальна гіпоксемія та двостороннє помутніння на рентгенограмі ГК, пов’язане зі збільшенням шунтування, розширенням альвеолярного мертвого простору та зниженням еластичності легень. На клінічну картину ГРДС впливають стратегія лікування, зокрема початковий рівень PEEP [4], режим інфузійної терапії [22], седація та нервово-м’язова блокада [10, 23] і положення пацієнта лежачи [24]. Отримані гістологічні дані при ГРДС включають внутрішньоальвеолярний набряк, запалення, утворення гіалінової мембрани та альвеолярний крововилив, який часто називають дифузним альвеолярним ураженням; однак ці гістологічні особливості присутні не завжди і не є необхідними для клінічного діагностування ГРДС [25].
Час, фактори ризику та позалегеневі фактори
Експерти, які увійшли до складу комітету, погодилися з тим, що чинний термін (часові рамки) для діагностування ГРДС має бути збережений: гострий початок або погіршення гіпоксемічної ДН визначається як таке, що виникло протягом одного тижня після появи сприятливого фактора ризику або впродовж одного тижня після появи або погіршення респіраторних симптомів. Комітет розглянув можливість подовження часу до виникнення гіпоксемічної ДН, оскільки тривалі симптоми можуть передувати прогресуванню до тяжкої ДН, як у випадку з COVID‑19; однак розширення визначення для включення HFNO дозволяє проводити ранню діагностику ГРДС, тому однотижневий термін для гострого початку ДН було збережено. Експерти наголосили, що гострий початок або погіршення гіпоксемічної ДН і набряку легень не слід асоціювати виключно або головним чином з кардіогенним набряком легень або перевантаженням рідиною, ателектазом або колапсом легень, плевральним випотом або легеневою емболією. ГРДС можна діагностувати за наявності цих станів, за умови що присутній фактор ризику ГРДС і клініцист вважає, що інші стани (наприклад, перевантаження рідиною, ателектаз) малоймовірні як основні причини гіпоксемії. ГРДС також може бути діагностований за наявності хронічного захворювання легень, наприклад хронічного обструктивного захворювання легень, інтерстиціального захворювання легень або легеневої гіпертензії, у випадку якщо гостра гіпоксемічна ДН не є головною причиною основних захворювань, зазначених вище.
Візуалізація грудної клітки
Комітет погодився, що візуалізація ГК має включати двосторонні рентгенологічні (рентгенографія ГК або комп’ютерна томографія [КТ]) або ультразвукові зображення, на яких виявлені зміни вказують на втрату аерації легень, що не повністю пояснюється випотом, ателектазом або вузлами (<3 см у діаметрі)/утвореннями (>3 см у діаметрі).
Хоча ідентифікація двосторонніх помутнінь за допомогою рентгенографії ГК має низьку надійність [26], цей метод візуалізації все ж є найпоширенішим діагностичним підходом у тяжкохворих пацієнтів. Цей факт сприяв створенню рекомендації щодо збереження рентгенографії ГК у визначенні ГРДС, незважаючи на існуючі обмеження. Крім того, експерти рекомендували визнати УЗД як метод виявлення ознак втрати аерації легень, що відповідає набряку (некардіогенному) легень або консолідації легень, особливо коли рентгенографія ГК або КТ недоступні [27-29]. Є докази того, що УЗД може бути надійним методом, якщо оператор (спеціаліст УЗД) має необхідну компетенцію та навички для виявлення двосторонньої консолідації та некардіогенного набряку легень. Таким чином, УЗД є цінним методом візуалізації, особливо у медичних закладах з обмеженими ресурсами [18-20].
Оксигенація
Із метою розширення чинного визначення експерти запропонували три категорії ГРДС: неінтубований, інтубований та модифікована категорія для закладів з обмеженими ресурсами (табл. 1, рисунок). Були надані рекомендації щодо включення пацієнтів, які потребують мінімального рівня кисневої підтримки або методом NIV (згідно з Берлінськими критеріями), або HFNO, до категорії неінтубованого ГРДС. Проте цей підхід обмежує визначення ГРДС медичними закладами, які мають доступ до апаратів підтримки дихання. Члени комітету дійшли згоди, що обмеження ресурсів не має впливати на потенціал відповідності діагностичним критеріям синдрому. Таким чином, офіційно затверджене клінічне визначення ГРДС у модифікації Кігалі [18, 30] є рекомендованим для закладів охорони здоров’я, у яких недоступні сучасні апарати підтримки дихання.
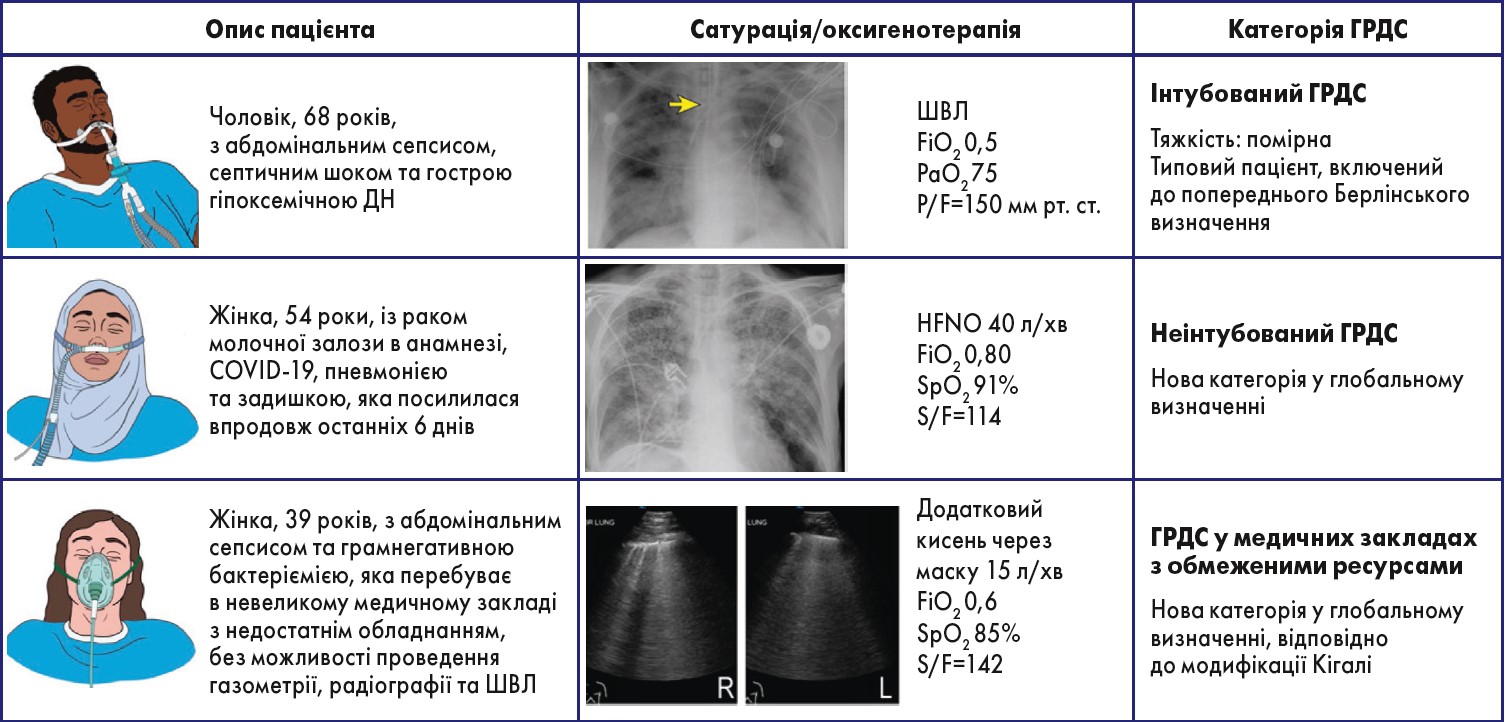
Рис. Репрезентативні випадки з описами пацієнтів, зображеннями легень і даними щодо сатурації для трьох категорій ГРДС у глобальному визначенні: інтубований (зверху), неінтубований (посередині) та категорія для медичного закладу з обмеженими ресурсами (знизу)
Пацієнта, що перебуває в закладі охорони здоров’я з обмеженими ресурсами, можна ідентифікувати або за допомогою УЗД (знімок знизу демонструє двосторонні дифузні В-лінії в незалежних ділянках легень), або за допомогою рентгенографії ГК чи КТ. Крім того, лише пацієнт з інтубованим ГРДС (зверху) відповідає критеріям Берлінського визначення ГРДС.
Стрілкою позначено ендотрахеальну трубку. F – жіноча стать; HFNO – високопотокова назальна оксигенотерапія; М – чоловіча стать; P/F – PaO2/FiO2; S/F – SpO2/FiO2; SpO2 – сатурація, виміряна за допомогою пульсоксиметрії.
Від моменту публікації результатів дослідження FLORALI [12] використання HFNO значно зросло. Пандемія COVID‑19 продемонструвала, що пацієнти, які отримували HFNO, справді можуть мати ГРДС [31]. У дослідженні V.M. Ranieri et al. (2022) 93% пацієнтів із COVID‑19, яким було проведено HFNO, продовжували відповідати критеріям оксигенації при ГРДС, включаючи критерії тяжкого ГРДС, після інтубації та лікування за допомогою ШВЛ і PEEP [13]. Хоча рівень летальності пацієнтів, які отримували лише HFNO (тобто тих, хто ніколи не прогресував до інвазивної ШВЛ), був нижчим і зіставним із рівнем летальності тих хворих, кому була проведена виключно неінвазивна ШВЛ [13] і які наразі відповідають Берлінським критеріям ГРДС. Важливою перевагою включення пацієнтів, яким проводять HFNO, до категорії ГРДС згідно з переглянутим визначенням є те, що ГРДС можна розпізнати раніше, що робить доцільним проведення клінічних досліджень, які вивчають наслідки ранніх втручань. Оновлення діючого визначення ГРДС дозволить дослідникам порівняти лікувальні підходи та результати пацієнтів у кожній категорії ГРДС (неінтубовані, інтубовані та категорії для медичних закладів з обмеженими ресурсами). Варіант з обмеженими ресурсами дозволить науковцям у країнах із низьким рівнем доходу ідентифікувати пацієнтів із ГРДС у своїх лікарнях і проводити клінічні дослідження.
Члени комітету схвалили використання сатурації, виміряної за допомогою пульсоксиметрії SpO2/FіO2, як альтернативу PaO2/FіO2 для діагностики ГРДС. Хоча аналіз газового складу артеріальної крові є золотим стандартом для оцінки гіпоксемії при ГРДС, альтернативне використання показника SpO2/FіO2 було додано з двох причин: 1) неможливість постійного контролю газометрії артеріальної крові у закладах охорони здоров’я з обмеженими ресурсами і 2) зниження частоти моніторингу газового складу крові у країнах із високим доходом. Як лінійне, так і нелінійне обчислення PaO2/FіO2 із SpO2/FіO2 демонструють хороші показники, якщо SpO2 становить ≤97% (за відсутності аномалії гемоглобіну, про що йдеться у примітці до таблиці) [7, 8, 32, 33]. У нещодавно опублікованих клінічних дослідженнях, метою яких було вивчення ГРДС, показник SpO2/FіO2 використовувався як критерій включення пацієнтів [10]. Пацієнти із ГРДС, діагностованим за допомогою співвідношення SpO2/FіO2, мають клінічні результати, зіставні з тими хворими, у яких ГРДС був підтверджений шляхом аналізу газового складу артеріальної крові [34]. Експерти дійшли згоди щодо використання лінійного рівняння Райса для визначення граничних показників SpO2/FіO2 [7], оскільки його чутливість і специфічність для гіпоксемії можна порівняти з нелінійними розрахунками, і його простіше обчислити [32, 35].
Хоча доступність перевіреного неінвазивного та економічно вигідного методу оцінки оксигенації крові має очевидні переваги, пульсоксиметри можуть бути недостатньо чутливими до гіпоксемії у пацієнтів із темним відтінком шкіри та хворих у шоковому стані [36-41]. Ці обмеження викликають занепокоєння, враховуючи те, що оновлене визначення ГРДС має сприяти рівності в закладах охорони здоров’я та може бути застосоване до більшості груп пацієнтів з огляду на те, що багато пацієнтів із ГРДС мають погану системну перфузію. Тим не менше комітет вважає, що доступність пульсоксиметрії в усіх закладах охорони здоров’я переважає недолік, зумовлений недіагностованою гіпоксемією у деяких пацієнтів при застосуванні цього методу, оскільки загальний ефект полягатиме в підвищенні рівності в медичних закладах, умови яких не забезпечують достатній рівень діагностики ГРДС. Результати деяких досліджень продемонстрували більш високу прогнозовану летальність, оскільки включали лише пацієнтів із PaO2/FіO2 150 мм рт. ст., що не є межею, зазначеною у Берлінських критеріях. Згідно з висновками клінічних досліджень, Берлінські категорії тяжкості ідентифікують зростаючий рівень летальності зі збільшенням ступеня тяжкості, незалежно від того, чи використовуються початкові співвідношення PaO2/FіO2 [4], чи умовний розрахунок SpO2/FіO2 [42]. Переконливих доказів щодо необхідності зміни категорій тяжкості надано не було. Однак значення SpO2/FіO2 мають відповідати критеріям гіпоксемії для кожної категорії.
Висновки
Нове глобальне визначення ГРДС містить рекомендації щодо оновлення Берлінських критеріїв ГРДС у певних ключових пунктах, ґрунтуючись на існуючих доказах і даних клінічної практики. Пацієнти, які отримують HFNO при швидкості потоку O2 ≥30 л/хв, можуть бути включені до оновлених критеріїв ГРДС, а рівень сатурації, виміряний за допомогою пульсоксиметрії, може бути використаний замість газометрії артеріальної крові при діагностиці ГРДС. Пацієнти медичних закладів з обмеженими ресурсами більше не будуть виключені з визначення ГРДС і можуть бути включені до епідеміологічних та клінічних досліджень. УЗД може використовуватися як метод візуалізації, коли рентгенографія ГК і/або КТ недоступні, за умови що оператор має достатню кваліфікацію та володіє необхідними навичками. Нарешті, оновлені рекомендації щодо глобального визначення ГРДС сприятимуть певним важливим напрямкам майбутніх досліджень.
Реферативний огляд підготувала Дарина Чернікова
За матеріалами: Matthay M.A., Arabi Y., Arroliga A.C., Bernard G., Bersten A.D., Brochard L.J., Calfee C.S., Combes A., Daniel B.M., Ferguson N.D., Gong M.N., Gotts J.E., Herridge M.S., Laffey J.G., Liu K.D., Machado F.R., Martin T.R., McAuley D.F., Mercat A., Moss M., Mularski R.A., Pesenti A., Qiu H., Ramakrishnan N., Ranieri V.M., Riviello E.D., Rubin E., Slutsky A.S., Thompson B.T., Twagirumugabe T., Ware L.B., Wick K.D.
A New Global Definition of Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med. 2024 Jan 1;209(1):37-47. doi: 10.1164/rccm.202303-0558WS. PMID: 37487152.
Тематичний номер «Хірургія. Ортопедія. Травматологія. Інтенсивна терапія» № 2 (59), 2024 р.
СТАТТІ ЗА ТЕМОЮ Алергія та імунологія
У статті представлено особливості будови, класифікацію та принципи застосування сітчастих імплантатів для пахвинної герніопластики, а також описано пристрої та способи їх фіксації при відкритих і лапароскопічних операціях...
У травні відбулася науково-практична конференція «Мультидисциплінарний підхід у лікуванні хірургічного хворого – вимоги часу», під час якої провідні спеціалісти різних галузей хірургічної практики обговорили актуальні проблеми сучасної хірургії та розглянули способи їх вирішення. У доповіді «Сучасні можливості періопераційного супроводу в хірургії судинних патологій» професор кафедри хірургії та судинної хірургії Національного університету охорони здоров’я України ім. П.Л. Шупика, доктор медичних наук Сергій Іванович Саволюк висвітлив проблему хронічної венозної недостатності та синдрому діабетичної стопи і представив патогенетично обґрунтовані методи менеджменту цих патологій у пері- та післяопераційному періодах...
Восени минулого року в рамках семінару «Академія хірургії, анестезіології та інтенсивної терапії від А до Я: Хірургічні аспекти лікування гострого панкреатиту та його ускладнень. Анестезія у пацієнтів високого ризику» відбулася сателітна сесія, присвячена ефективним стратегіям антибіотикотерапії хірургічної інфекції шкіри, м’яких тканин і кісток. У своїй доповіді доцент кафедри загальної хірургії Львівського національного медичного університету ім. Данила Галицького, кандидат медичних наук Всеволод Васильович Ващук висвітлив сучасні класифікації інфекцій шкіри та м’яких тканин (ІШМТ), ключові принципи контролю джерела інфекції, а також актуальні рекомендації щодо лікування синдрому діабетичної стопи (СДС)...
Карбапенем-резистентні Enterobacteriaceae (carbapenem-resistant Enterobacteriaceae, CRE) становлять значну загрозу для здоров’я людини, а інфекції, спричинені CRE, є тягарем для системи охорони здоров’я в цілому. Метою цього дослідження було порівняння ефективності та безпеки застосування цефтазидиму/авібактаму (CAZ-AVI) та поліміксину в лікуванні інфекцій, зумовлених CRE. У хворих, які отримували CAZ-AVI, відмічена значно нижча 30-денна смертність, вищий клінічний коефіцієнт виліковування та більший рівень мікробної елімінації порівняно з терапією поліміксинами. Рівень смертності серед пацієнтів з інфекцією кровотоку, якім призначали CAZ-AVI, був значно нижчим порівняно з тими, хто отримував терапію поліміксином. Результати дослідження свідчать про те, що CAZ-AVI може бути кращим варіантом для лікування інфекцій CRE порівняно з поліміксином завдяки вищій клінічній ефективності...